人參莖葉總皂苷的人腸內細菌生物轉化△
馬麗媛,王洪平,楊秀偉
北京大學 藥學院 天然藥物學系/天然藥物及仿生藥物國家重點實驗室,北京 100191
傳統中藥人參Ginseng Radix et Rhizoma系五加科多年生草本植物人參PanaxginsengC.A.Mey.的干燥根和根莖,其主要成分為人參皂苷(ginsenoside)[1],具有延緩衰老、抗疲勞、保護肝臟和心血管系統、抗應激、抗誘變、抗癌、抗糖尿病、抗氧化、抗炎等藥理作用[2]。研究表明,人參莖葉總皂苷[3-7]與人參根和根莖總皂苷[1,8]具有類似的達瑪烷型三萜皂苷組成,因此,人參莖葉總皂苷有廣闊的開發利用前景。在長期的臨床實踐中,中藥形成了以口服為主的給藥途徑,其化學成分吸收進入系統循環之前往往要在腸道菌群的作用下活性化,才能更好地發揮作用,這一機制的闡明為基于中藥化學成分體內生物轉化尋找新藥先導化合物開辟了新途徑[9]。人參莖葉皂苷經甘蔗鐮孢Fusariumsacchari轉化后可生成稀有抗腫瘤活性皂苷[10];經塔賓曲霉菌Aspergillustubingensis轉化可生成稀有人參皂苷Rh4(ginsenoside Rh4)及其苷元[11]。本實驗采用液相色譜-電噴霧離子源-四極桿-飛行時間質譜法(LC-ESI-Q-TOF-MS)研究人參莖葉總皂苷的人腸道細菌生物轉化,為源于人參莖葉皂苷的現代中藥定向研究提供理論和實驗依據。
1 材料
1.1 儀器
1290型超高效液相色譜儀(配有1290系列二元泵、在線脫氣機、自動進樣閥和柱溫箱)、Q-TOF 6540型質譜儀[配有安捷倫AJS電噴霧離子源(ESI)、Agilent MassHunter工作站]、Agilent ZORBAX RRHD Eclipse Plus C18型色譜柱(100 mm×3 mm,1.8 μm,配有Phenomenex Security GuardTMULTRA保護柱)均購于安捷倫公司;Mettler XS105DU型十萬分之一電子天平(瑞士Mettler-Toledo公司);Advantage A10型制水機(美國Millipore公司);KQ5200型超聲波清洗儀(功率:200 W,頻率:40 kHz,昆山市超聲儀器有限公司);質譜級乙腈、甲醇和甲酸購于美國Fisher科技公司。
1.2 試藥
人參莖葉采自吉林省集安人參種植場,由吉林省中醫中藥研究院中藥研究所李龍云研究員鑒定為五加科人參PanaxginsengC.A.Mey.的莖葉。
人源腸內菌叢培養基、胰蛋白胨、朊胨、消化血清粉、酵母浸膏、牛肉膏、牛肝浸出粉均購于北京市海淀區微生物培養基制品廠;硫代乙醇酸鈉(廣西新港化工廠);L-半胱氨酸鹽酸鹽(第二軍醫大學政祥醫用科學實業服務部);可溶性淀粉(成都宏博有限公司);磷酸二氫鉀、氯化鈉、葡萄糖購于北京化工廠。
對照品人參皂苷Rh20(G-Rh20)[5]、G-Rf2、G-Re[7]、3β,6α,12β,25-四羥基-達瑪-20(22)E-烯-6-O-α-L-吡喃鼠李糖基-(1→2)-β-D-吡喃葡萄糖苷(THDRG)[6]、G-Rh14[4]、G-Rd[7]、G-Rh15[4]、G-F2[7]、G-Rh4和G-Rg5[6]均由本課題組從人參莖葉總皂苷中分離鑒定;20(S)-G-Rg2、20(R)-G-Rg2、20(S)-G-Rh1、20(S)-25-hydroxy-protopanaxatriol[20(S)-25-OH-PPT]、20(R)-G-Rh1、20(R)-25-hydroxy-protopanaxatriol[20(R)-25-OH-PPT]、G-F1、G-Rh19、20(R)-G-Rh19、G-Rg6、20(22)E-G-F4、G-Rk3、20(S)-G-Rg3、20(R)-G-Rg3、G-Rh16、20(S)-PPT、20(R)-PPT、G-Rk1、20(S)-G-Rh2、20(R)-G-Rh2、異G-Rh3(Iso-G-Rh3,98)[12]和3β,12β,24S-三羥基-達瑪-20(22)E,25-二烯-3-O-β-D-吡喃葡萄糖苷(ginsenoslaloside-I,THDG)[13]從人參莖葉總皂苷的NaOH水解產物中分離鑒定;20(S)-25-OH-原人參二醇[20(S)-25-OH-PPD][14]從人參莖葉總皂苷的硫酸水解產物中分離鑒定;G-Rg1、G-Rf、三七皂苷-R2(NG-R2)、G-Rb1、G-Rc和G-Rb2從人參根和根莖[15]或紅參[16]中分離鑒定;G-CK從人參果中分離得到[17]。以上各對照品純度經液相色譜-質譜法(LC-MS)測定均大于98%。
2 方法
2.1 人參莖葉總皂苷的制備
人參莖葉粗粉及總皂苷按照專利方法制備[18]。取干燥的人參莖葉粗粉(15 kg),用水煎煮3次,加水量依次為原料的20、15、10倍量,分別提取3、2、1.5 h。合并煎煮液,濾過,減壓濃縮,加入 3倍量95%乙醇水溶液,沉淀雜質,上清液用活性炭脫色,回收乙醇,得提取物(2.625 kg)。將提取物于10倍量水中溶解,加入氯化鈉使其達到飽和后進行鹽析,靜止過夜,濾得沉淀,即為人參莖葉總皂苷(210 g)。
2.2 厭氧培養基(GAM)和人腸內菌叢的制備
2.2.1GAM配制 準確稱取胰蛋白胨10 g、朊胨10 g、消化血清粉13.5 g、酵母浸膏5 g、牛肉膏2.2 g、牛肝浸出粉1.2 g、葡萄糖3 g、磷酸二氫鉀2.5 g、氯化鈉3 g、可溶性淀粉5 g、L-半胱氨酸鹽酸鹽0.3 g和硫代乙醇酸鈉0.3 g,加入適量蒸餾水,用恒溫磁力攪拌器使其充分溶解并定容至1000 mL,用1 mol·L-1NaOH水溶液調pH為7.1~7.2,即為GAM。
2.2.2人腸內菌叢的制備 人腸內菌叢制備按標準操作規程[19]進行。取10號自封袋,充滿氮氣,置換自封袋內的氣體,擠壓出氣體后再通入氮氣。如此重復2次,再次充滿氮氣,將健康志愿者一次排出的所有糞便裝入自封袋,封口并用手擠壓自封袋使糞便均質化。通過厭氧箱的置換倉將糞便轉移至厭氧無菌操作條件下,取糞便3~5 g,放入到200 mL加熱沸騰并立即冷卻的GAM中(250 mL具塞錐形瓶),通入氮氣去除空氣,加塞封口。置厭氧培養箱中,37 ℃下培養24 h;從250 mL具塞錐形瓶中取出菌液1 mL,加至已裝有滅菌GAM的具塞錐形瓶中,37 ℃活化培養24 h,取出,置于4 ℃冰箱中保存,即為人腸內菌混合菌叢。
2.3 人參莖葉總皂苷的人腸內細菌生物轉化及其產物萃取
準確稱取人參莖葉總皂苷80 mg,用二甲基亞砜400 μL充分溶解。在厭氧培養箱內,向3只(標記為1~3號瓶)100 mL具塞錐形瓶內分別加入GAM 40 mL,向1、2號瓶內各加入菌液1 mL,再向1、3號瓶內加入人參莖葉總皂苷溶液200 μL。1~3號瓶分別標記實驗組、空白組和對照組。瓶口用封口膜密封,轉移至搖床,在37 ℃、100 r·min-1條件下培養48 h。上述實驗平行進行3次。培養結束后,加入乙酸乙酯滅活,用等體積乙酸乙酯萃取3次,再用等體積正丁醇萃取2次,合并萃取液,減壓濃縮,得到轉化產物萃取樣品。
2.4 供試品溶液制備
取2.1項下人參莖葉總皂苷1 mg,用甲醇1 mL充分溶解;取2.3項下每個處理轉化產物萃取樣品,分別用甲醇5 mL充分溶解。各待測樣品分析前在10 000×g離心10 min。用0.22 μm微孔濾膜濾過,作為供試品溶液。
2.5 對照品溶液制備
精密稱取各對照品適量,用甲醇溶解,配制成對照品儲備液。分別精密吸取各對照品儲備液適量,配制成各對照品質量濃度為50~200 ng·mL-1的混合對照品溶液。
2.6 分析條件
2.6.1HPLC條件 Agilent 1290型液相色譜儀,流動相為水(A)-乙腈(B),梯度洗脫(0~2 min,80%~70%A;2~18 min,70%~10%A),檢測波長為203 nm,柱溫為45 ℃,進樣量為1 μL,體積流量為0.8 mL·min-1,分流比為1∶1。
2.6.2MS條件 AJS ESI源,負離子模式;干燥氣溫度為300 ℃;干燥氣體積流量為5 L·min-1;霧化氣壓力為241.33 kPa;鞘氣溫度為400 ℃;鞘氣體積流量為12 L·min-1;毛細管電壓為3500 V;噴嘴電壓為1500 V;毛細管出口電壓為280 V。
2.7 分析物數據庫的建立和數據處理
2.7.1分析物數據庫的建立 依據中藥系統藥理學數據庫與分析平臺(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)、天然產物詞典(dictionary of natural product,http://www.chemnetbase.com)數據庫和文獻檢索人參莖葉的化學成分,并結合ChemSpider、PubChem、ChemBook數據庫化合物信息,建立人參莖葉的化學成分信息庫,包括化合物的名稱、分子式、相對分子質量和CAS號等。
2.7.2數據處理 將LC-ESI-Q-TOF-MS采集的原始數據導入分析軟件進行碎片和相對分子質量匹配,根據高分辨質譜信息對其分子式進行推導,偏差不得大于5×10-6,推導可能的裂解碎片,最終確定分析物。
3 結果與分析
3.1 對照品的結構表征
對照品溶液在負離子模式下的LC-ESI-Q-TOF-MS總離子流圖見圖1,化合物信息見表1,部分化合物結構見圖2。

圖1 對照品溶液總離子流圖
40個對照品可分為PPD型和原人參三醇(PPT)型。其中,屬于PPT型的有化合物1、5、7、9、20、23、24、27、33、35、36、38、41、45、50、59、63、65~67、73、76、80、82和83;屬于PPD型的有化合物30、34、39、51、74、77、78、88、89、91~95和98。這2個類型化合物的苷元具有特征性的質譜碎片,易于識別[20]。在負離子檢測模式下,明顯可見分子結構中丟失葡萄糖基(mz162)、鼠李糖基(mz146)、阿拉伯糖基或木糖基(mz132)的碎片及mz475.3為PPT的碎片等。

表1 LC-MS負離子模式各分析物的質譜數據

續表1

續表1

續表1

續表1

圖2 人參達瑪烷型三萜對照品及其人參莖葉中部分達瑪烷型三萜類的化學結構
3.2 人參莖葉總皂苷化學結構的表征
負離子模式下人參莖葉總皂苷總離子流圖見圖3。通過與對照品比對和數據解析,共確定83個化合物,定性結果見表1。沒有檢測到人參根或紅參中存在的齊墩果酸型人參皂苷,但檢測到人參根中不存在的奧柯梯隆(ocotillol)型皂苷,如擬人參皂苷F11(pseudo-G F11,13)[21-23]和20(R)-擬人參皂苷F11[20(R)-pseudo-G F11,14][23]。與人參根中的皂苷相比[20,24],人參莖葉總皂苷中含有更多低極性的人參皂苷和/或人參達瑪烷型三萜,如20(S)-G-Rh1(36)、20(R)-G-Rh1(41)、G-F1(50)、20(S)-G-Rg3(77)、20(R)-G-Rg3(78)、20(S)-G-Rh2(94)和20(R)-G-Rh2(95)。此外,人參莖葉總皂苷中還含有大量的異構體,如相對分子質量為782的化合物24、40、44、59、71、75和79,相對分子質量為784的化合物20、21、33、64、74、77和78,相對分子質量為800的化合物1、7、10、13、14、25、37、46、52和55等。因此,人參莖葉皂苷復雜體系中含有更多低極性人參皂苷和/或人參達瑪烷型三萜,或稀有人參皂苷(rare ginsenoside),更易于吸收進入體循環。

注:A.人參莖葉總皂苷+培養基;B.培養基+人腸內菌液;C.人參莖葉總皂苷甲醇溶液;D.人參莖葉總皂苷的人腸內菌轉化產物。圖3 人參莖葉總皂苷及其人腸內細菌轉化產物LC-ESI-Q-TOF-MS總離子流圖
3.3 人參莖葉總皂苷的人腸內菌轉化產物分析
按2.6項下條件對人參莖葉總皂苷的人腸內菌轉化產物進行分析,負離子模式下的總離子流色譜圖見圖3。通過與對照品比對和數據解析,共確定67個化合物,定性結果見表1。檢出了在人參莖葉總皂苷組分中沒有檢出的15個化合物,分別為20(S)-25-OH-PPT(38)、20(R)-25-OH-PPT(45)[25]、G-O(60)[26-28]、絞股藍皂苷Ⅸ(61)、絞股藍皂苷ⅩⅦ(69)[28]、25-OH-G-Rh2(70)[29]、20(22)E-G-Rg9(71)[30]、G-Rs3(84)、20(R)-G-Rs3(86)[31]、G-Mc(85)、G-Y(87)[32]、G-Mx(90)[28]、20(S)-25-OH-PPD(92)[25]、G-CK(93)、G-CK異構體(96)[33]。這些化合物可能是由人參莖葉中的某些人參皂苷經人腸內細菌作用轉化而來。通過對比分析人參莖葉總皂苷及其人腸內細菌轉化產物,發現PPD型皂苷主要有2條生物轉化途徑,其中最主要的途徑為G-CK(93)的轉化途徑。在人參莖葉總皂苷的提取離子流圖(EIC)中未見G-CK(mz621.5)的峰,但在轉化后的產物中出現,且信號較強(圖4)。轉化后的產物中亦明顯可見絞股藍皂苷ⅩⅦ(69,mz945.5)的峰(圖4)。同時結合絞股藍皂苷ⅩⅦ(69)、G-Mc(85)、G-Y(87)和G-Mx(90)的分子結構,初步推測了PPD型皂苷轉化為G-CK的途徑(圖5)。
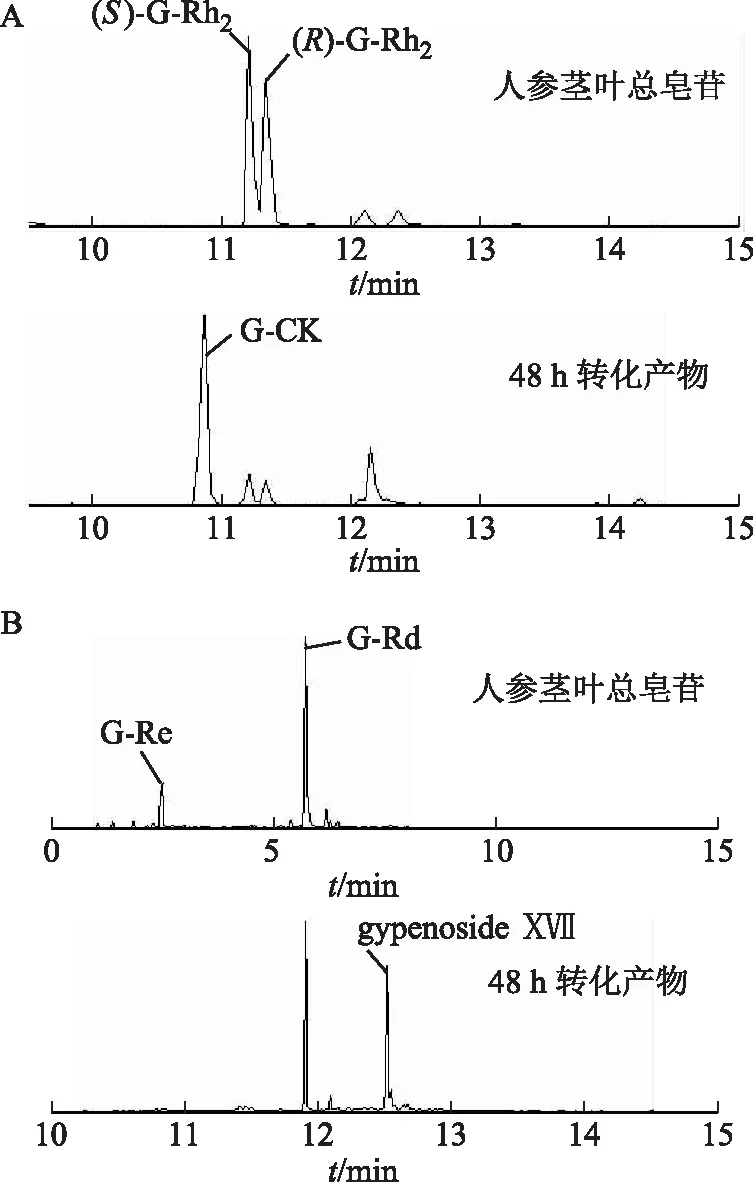
注:A.G-CK;B.絞股藍皂苷ⅩⅦ。圖4 人參莖葉總皂苷及其人腸內細菌轉化產物中G-CK及絞股藍皂苷ⅩⅦ離子色譜圖

圖5 人腸道細菌作用下PPD型皂苷轉化為G-CK的途徑
此外,在EIC中,發現轉化后的產物中G-Rg3、G-Rk1和G-Rg5的含量也顯著升高(圖6)。因此,推測PPD型皂苷的另外一條轉化途徑是通過轉變為G-Rg3來進行的,其可能的轉化途徑見圖7。
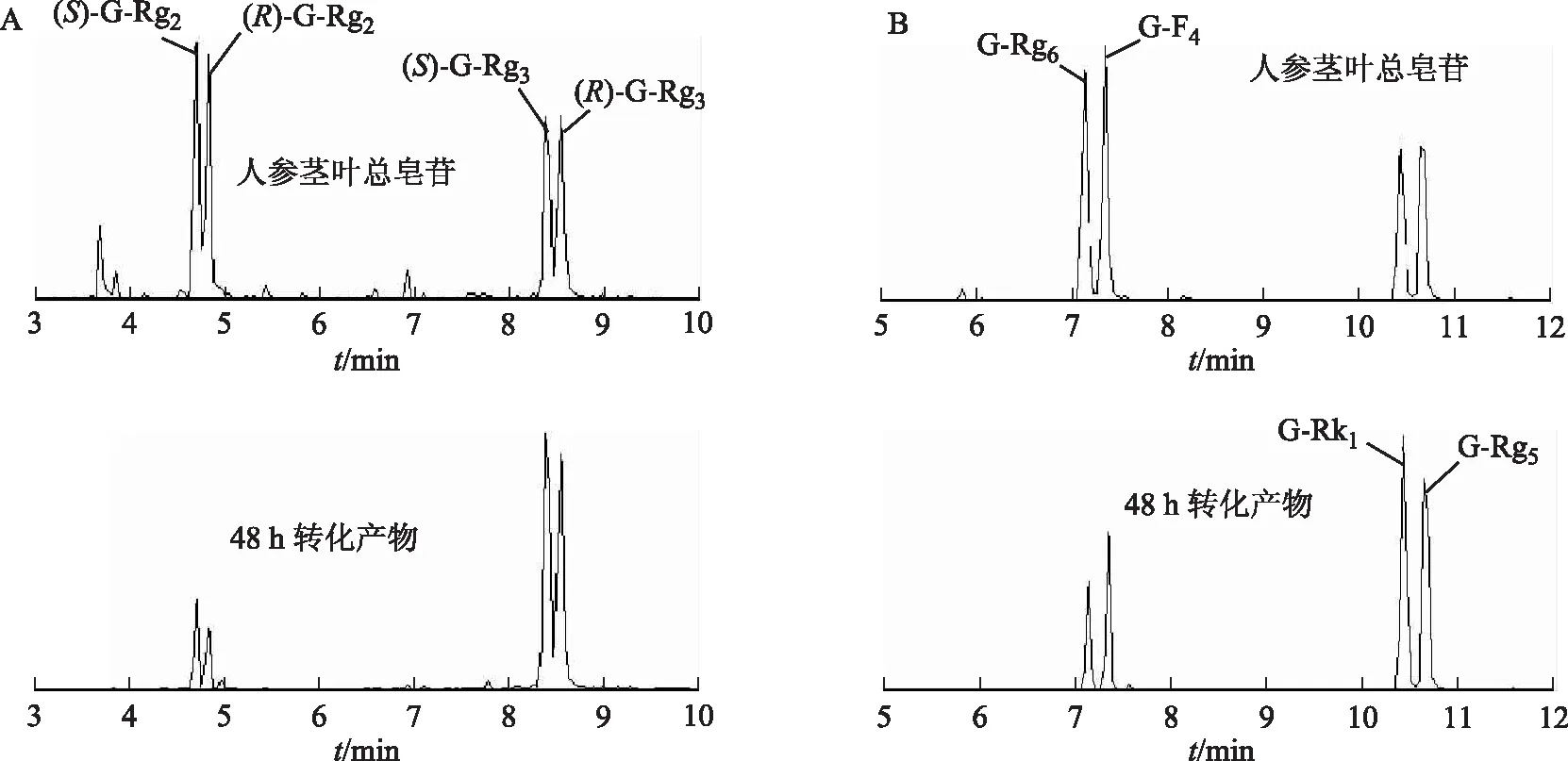
注:A.G-Rg3;B.G-Rk1和G-Rg5。圖6 人參莖葉總皂苷及其人腸內細菌轉化產物中G-Rg3、G-Rk1和G-Rg5離子色譜圖

圖7 人腸道細菌作用下PPD型皂苷轉化為G-Rg3的途徑
人參PPT型皂苷的人腸內細菌轉化途徑則較為簡單,G-Rh1(mz637.5)、G-Rk3、G-Rh4(mz619.5)以及PPT(mz475.5)的含量均較轉化前有了顯著的提高(圖8),推測其可能的轉化途徑見圖9。
人參皂苷C-17側鏈的C-24和C-25雙鍵發生水合反應可生成25-OH化合物。對于側鏈飽和的化合物,通過對各產物峰的指認,發現該類型化合物最終產物為20(S/R)-25-OH-PPT或20(S/R)-25-OH-PPD,其可能的轉化途徑見圖10。
人參皂苷C-17側鏈含有2個雙鍵的化合物在人腸內細菌轉化產物中也被檢測到,如20(22)E-G-Rg9(71)。在水參加工為紅參過程中,已知G-Rf可轉化為20(22)E-G-Rg9、20(22)Z-G-Rg9、20(22)E-25-OH-G-Rg9等,后者脫水又產生20(22)E-G-Rg9,為這類化合物的產生途徑提供了有益參考。如G-Rb1首先失去C-20糖鏈,轉化為G-Rg3,后者C20-OH與C21脫水轉化為C-17側鏈含有2個雙鍵的G-Rk1,或C20-OH與C22脫水轉化為C-17側鏈含有2個雙鍵的G-Rg5(圖7)[2]。

注:A.G-Rh1;B.G-Rk3和G-Rh4;C.PPT。圖8 人參莖葉總皂苷及其人腸內細菌轉化產物中G-Rh1、G-Rk3、G-Rh4和PPT離子色譜圖

圖9 人腸道細菌作用下人參皂苷的PPT轉化途徑

圖10 人參莖葉側鏈飽和型達瑪烷三萜的人腸內細菌轉化途徑
20(S)-G-Rs3(84)和20(R)-G-Rs3(86)兩者均屬于大極性化合物,由于其含量甚微,因此在人參莖葉總皂苷中沒有檢測到。而在轉化產物中,隨著原型化合物的減少,可能含量相對提高,因此在產物中檢測到了這些化合物的存在。某些人參達瑪烷型三萜即在人參莖葉總皂苷中存在,在其人腸內細菌轉化產物中亦存在,這與其沒有轉化完全和不同化合物之間的相互轉化有關[1]。人參莖葉生長在地上部分,與空氣接觸更充分,氧化態成分比地下部分更豐富、更具多樣性,與人參(地下部分)[20,24]經炮制而成的紅參[34]類似的成分較多,稀有人參皂苷較多,相對更易吸收,生物活性更突出。
4 討論
4.1 分離條件的優化
首先,優化了色譜分離條件,流動相包括乙腈-水、甲醇-水、乙腈-水(含0.1%甲酸)、甲醇-水(含0.1%甲酸),以獲得良好的分離度和電離效率,結果顯示,乙腈優于甲醇,流動相中加入少量的甲酸雖能調節分離度,但對于低極性的人參皂苷電離效率降低。因此,本研究最終選擇乙腈-水作為流動相。在正、負離子化模式上,發現負離子化模式靈敏度更高、質譜更清晰、背景噪音更低。因此,本研究最終選擇負離子化模式。對于碰撞能量,發現單糖苷和二糖苷在45 V效果好,三糖苷及其以上糖苷在60 V效果好。因此,本研究對每個樣品選擇45、60 V 2種碰撞能量。
4.2 人參皂苷結構的腸內菌生物轉化使活性成分濃度增高
圖3D與圖3C比較表明,人腸內細菌對人參莖葉皂苷的轉化使其復雜性簡單化,使某些成分濃度升高,達到必要的有效濃度,發揮生物學作用。如G-Rb1首先失去C-20糖鏈末端葡萄糖基,轉化為G-Rd,再依次失去C-3糖鏈的2個葡萄糖基,分別轉化為G-F2和G-CK(G-Rb1→G-Rd→G-F2→G-CK)。G-CK顯示出良好的生物學活性[2];G-Rb1→G-Rd→G-Rg3→G-Rk1或G-Rg5的轉化具有同樣的意義;此外,G-Rh1、G-Rh4、G-Rk3、PPT隨著溫孵培養時間的延長,含量也有增高的趨勢。
值得注意的是,25-OH-PPT或25-OH-PPD衍生物是有發展潛力的抗腫瘤化合物[35-37]。人腸內細菌對人參莖葉皂苷的這種轉化,無疑增加了人參莖葉皂苷的開發利用價值。

