卵巢成熟性畸胎瘤惡變為腺癌1例
劉平祎,趙小曉,張淳
430056 武漢,江漢大學醫學院 臨床醫學系(劉平祎);430014 武漢,武漢市中心醫院 病理科(趙小曉),婦科(張淳)
卵巢成熟囊性畸胎瘤(mature cystic teratoma,MCT)是最常見的卵巢生殖細胞腫瘤,常發生于女性生育期。MCT是由于第二次減數分裂失敗或第一次減數分裂失敗的前生殖細胞形成的。MCT中僅有1%~2%的病例發生惡變,多見于絕經后婦女,大多數惡變為鱗癌,約占75%,腺癌變僅占7%[1]。現將我科收治的1例育齡期婦女MCT發生腺癌變的病例匯報如下。
1 臨床資料
患者,女,33歲。因“發現盆腔包塊3年余”于2020年4月29日入院。自訴10歲時因發現一側卵巢巨大包塊行單側卵巢切除術(具體不詳);12歲再次發現另一側卵巢囊腫,自訴較小,未行特殊治療。平素月經欠規則,2020年1月25日至2020年4月22日期間間斷少量陰道出血,未予特殊診治。專科檢查:外陰、陰道、宮頸未見異常,子宮前位,正常大小,盆腔可捫及一直徑約12 cm包塊,質稍硬,活動度欠佳,無壓痛。外院資料: 2017年6月1日當地醫院彩超示:右卵巢見1.2 cm×1.0 cm稍高回聲區;2017年10月10日當地醫院復查彩超示:右附件區見5.3 cm×4.0 cm混合回聲區(畸胎瘤?)。2009年、2018年各順產一胎。2020年4月13日當地醫院彩超示:盆腔巨大包塊10.9 cm×7.1 cm。
入院后檢查:血CEA 6.27 ng/mL(正常值范圍0~3 ng/mL),血CA125、CA199、AFP、HCG值均正常。2020年4月28日彩超示:子宮大小正常,內膜厚1.0 cm,盆腔偏左較大不規則回聲區12.1 cm×11.4 cm×8.0 cm,不排除卵巢癌,盆腔可見1.1 cm×0.5 cm液性暗區。盆腔MRI示(圖1):盆腔一不規則形巨大腫塊(11.4 cm×8.8 cm×11.3 cm),囊壁厚薄欠均,并可見散在線性分隔,脂肪結節及少量的實性成分,一不規則形狀的壁結節增強后可見強化,考慮卵巢來源:1)畸胎瘤;2)上皮來源腫瘤。其余各項常規檢查無異常。
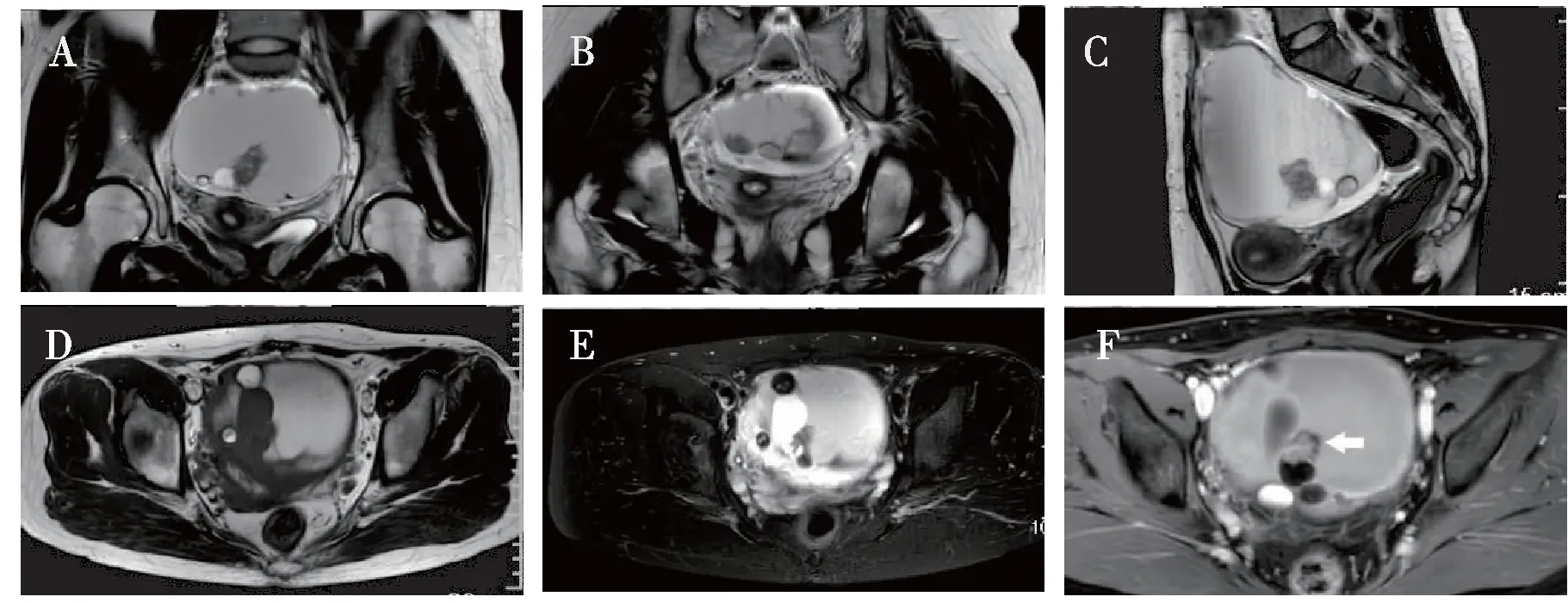
圖1 患者盆腔磁共振影像
處理:考慮患者間斷性少量陰道出血,為排除子宮內膜病變,于2020年5月1日行診斷性刮宮術,術后病檢示:子宮內膜腺體呈增殖性改變,間質較致密,另見小塊游離宮頸組織呈慢性炎癥伴鱗狀上皮增生及濕疣樣變。2020年5月7日行剖腹探查術,術中見右側卵巢腫瘤增大直徑約11 cm,表面光滑,呈多房改變,右側輸卵管外觀無明顯異常,左側卵巢缺如,左側輸卵管長約5 cm,遠端及傘端不可見,盆腹腔、大網膜、腸管、闌尾未見明顯異常,無腹水,因患者較年輕,先行右側卵巢腫瘤剝除術,剖視標本:右側卵巢腫瘤部分囊腔見褐色囊液,部分見油脂樣組織,另見菜花樣組織,質糟脆,色黃白,實性。將腹腔沖洗液及標本送檢。術中快速冰凍示:右側卵巢腫瘤鏡下見成熟性囊性畸胎瘤成分及惡性上皮性腫瘤成分,分類待常規及免疫組化。因患者無生育要求,遂行腹腔沖洗液細胞學檢查+腹腔探查術+全子宮及右側附件切除術+左側輸卵管切除術+盆腔淋巴結清掃術+部分大網膜切除+腹腔熱灌注,闌尾外觀未見異常,未切除。術后病檢示:腹腔沖洗液、全子宮、雙側輸卵管、大網膜病理均無異常,淋巴結未見癌轉移。右側卵巢腫瘤病理示:鏡下見卵巢成熟性囊性畸胎瘤成分及腺癌成分(備注:腫瘤性上皮表達下消化道免疫表型,局部與不典型上皮相移行,臨床排除消化道原發腺癌轉移或累及卵巢后,可認為卵巢成熟型囊性畸胎瘤惡變-惡性成分為低分化腺癌)。免疫組化:SATB2、Mucin-2、Villin、CDX-2、CK20、P16彌漫(+),PMS2、MSH2、MLH1、MSH6均(+),余P63、P40、PR、ER、Pax-8、MUC4、CK5/6、CK7、WT-1、Vimentin、CA125(-),Ki-67熱點區約50%。黏液染色部分細胞(+)(圖2)。胃鏡及腸鏡檢查無異常,排除胃腸道腫瘤轉移可能性。該病例術后診斷:右側卵巢成熟型畸胎瘤惡變(腺癌)ⅠA期。術后行6周期的TC方案(紫杉醇135~175 mg/m2d1+卡鉑AUC=5 d1,q3w)化療,2020年6月5日復查CEA恢復正常。在撰寫本報告時,患者術后隨訪5月余,未見腫瘤復發,因手術后時間尚短,仍需進一步隨訪觀察。

圖2 卵巢成熟性囊性畸胎瘤成分及腺癌成分常規病理及免疫組化染色
2 討 論
MCT以良性成熟性畸胎瘤為主,很少發生惡變。MCT惡變的發生機制仍不清楚,有研究發現高危型人乳頭狀瘤病毒感染可能是MCT惡變為鱗癌的原因之一[2]。另有研究表明KRAS和野生型BRAF基因突變可引起MCT向腺癌惡性轉化[3]。Bal等[4]發現MCT的惡性轉化可能與長期存在未切除的MCT有關。惡性腫瘤的發生需要長期的過程,本病例患者12歲發現右側卵巢囊腫,20余年未治療,因此提醒我們對于MCT應及時進行治療,以防惡變的發生。
2.1 診斷
2.1.1 臨床表現 術前診斷MCT的惡性轉化是很難的。該病的診斷年齡為13~77歲,平均年齡45歲。MCT引起的惡性腫瘤一般沒有特征性的體征或癥狀,常見癥狀為腹痛、腫塊大于9.9cm、陰道出血、腫瘤增大速度快、體重下降、腫瘤巨大產生的壓迫癥狀如便秘等[5]。MCT惡變為類癌患者中約有1/3因腫瘤細胞分泌血清素(5-羥色胺)、緩激肽、組胺和前列腺素等,可能出現皮膚潮紅、腹瀉、支氣管痙攣和瓣膜性心臟病等類癌綜合征[6]。
2.1.2 實驗室檢查 MCT可以來源于外胚層(皮膚、神經組織)、中胚層(肌肉、脂肪組織)或內胚層(消化組織、支氣管)。各組織都可能發生癌變,因此各腫瘤標志物都可能升高。當MCT惡變為鱗癌時血清SCC-Ag、M-CSF、CA125、CA199和CEA水平可升高[6]。其中SCC-Ag水平升高(>2.5ng/mL)被視為目前MCT鱗癌變術前診斷最有用的標記物[7]。MCT腺癌變患者可有血清CA125、CA199及CEA水平升高[8]。但MCT惡變為類癌或基底細胞癌患者的腫瘤標志物沒有顯著增加[6]。另有報道提出中性粒細胞/淋巴細胞的比率升高(≥5.0)是MCT惡變的術前診斷指標[9]。MCT鱗癌變還可引起高鈣血癥[10]。
2.1.3 影像學檢查 影像學檢查可幫助MCT惡性轉化的診斷。多普勒超聲對腫瘤內血流阻力指數<0.4,搏動指數<0.82時,則提示存在惡性腫瘤的可能性[11]。MRI表現有助于鑒別良惡性腫瘤。鄧雯雯[12]總結了MCT惡變的MRI表現,發現良性MCT多為囊性,實性成分很少且無強化;MCT惡變一般為囊實性腫塊,腫塊多大于10 cm,形態不規則,可見脂肪成分,實性部分多彌散受限,囊壁和分隔厚薄欠均,增強掃描呈條片樣、花環形及結節樣強化;若未觀察到實性成分, 需通過透壁樣生長或直接侵犯鄰近的盆腔器官等惡性征象來進一步明確MCT惡變的診斷。本病例患者根據MRI表現,提示存在惡變的可能。
2.1.4 術中快速切片診斷 術中冰凍切片診斷卵巢腫瘤是一種較準確的組織病理學診斷方法。術中冰凍切片分析對惡性腫瘤的敏感性和陽性預測值分別為80%和100%[13]。術中快速切片診斷用于確定腫瘤的性質,因惡性成分可能只存在于局部,在取樣前仔細的腹腔探查及充分的取樣是必不可少的,術中快速切片診斷結果不同,治療方法也各不相同。但術中快速切片診斷在區分原發性和轉移性卵巢腫瘤方面僅是中等敏感性[14],因此我們還需與轉移性腫瘤相鑒別。若冰凍結果與臨床信息提示不符可以將腫瘤組織二次送檢,進行術中快速切片診斷,明確腫瘤性質。
該病例為33歲育齡期女性,確診前有異常子宮出血、腫塊大、腫瘤標志物升高,影像學懷疑惡變,術中快速切片診斷見成熟性囊性畸胎瘤成分及惡性上皮性腫瘤成分。因此,臨床上具有上述臨床表現,腫瘤標志物異常升高,有影像學特征表現者,應高度懷疑惡性腫瘤,需送術中快速切片診斷以防漏診。
2.2 鑒別診斷
畸胎瘤惡變病理診斷應同時有成熟畸胎瘤成分和惡性轉化成分,還應排除其他惡性病變。要確定畸胎瘤惡變的組織學來源需根據組織學和免疫表型進行鑒別。本案例需與以下2種病變相鑒別。
2.2.1 消化道原發性腺癌的卵巢轉移 MCT引起的下消化道腺癌大多表現為腸分化特征,通常表現出與消化道原發性腺癌相同的免疫組化特征(CK20、Mucin-2和CDX-2陽性,而CK7陰性),因此需根據病理表現及臨床癥狀與消化道原發性腺癌卵巢轉移相鑒別。MCT腺癌變鏡下常觀察到腺癌上皮有大量的杯狀細胞,且有從良性到不典型增生再到惡性腺體相移行的病理變化,提示惡性成分來自畸胎瘤內的良性上皮結構。另外,轉移性腫瘤常累及雙側卵巢。本患者為卵巢腫瘤為單側,無消化道疾病史,無家族消化道腫瘤病史,且術中探查胃腸道各器官未見異常,行胃鏡及腸鏡檢查無異常,可排除消化道腫瘤轉移可能性。
2.2.2 原發性上皮性卵巢癌合并同側成熟型畸胎瘤 區分兩個獨立的腫瘤發生在同一卵巢也很重要,我們可以通過病理及免疫組化等進行鑒別診斷。原發性上皮性卵巢癌的免疫組化染色多表現為CK7陽性表達,CK20和CDX-2陰性。而在我們的病例中呈現相反的結果(CK20和CDX-2陽性,CK7陰性),所以可以排除原發性上皮性卵巢癌合并成熟型畸胎瘤的可能性。
2.3 治療及預后
因MCT惡變罕見,尚無最佳的治療方法,目前以手術治療為主,輔以放化療。Ⅰ期的患者預后相對較好[15]。
2.3.1 手術治療 對于Ⅰ期患者,若無生育要求一般主張全面分期手術,即腹水或腹腔沖洗液細胞學檢查+腹腔探查術+全子宮及雙側附件切除術+選擇性盆腔淋巴結及腹主動脈旁淋巴結切除+大網膜切除,初次手術發現闌尾外觀無異常可不切除[16];對育齡期有生育要求的Ⅰ期患者,在全面手術分期基礎上,ⅠA、ⅠC期行患側附件切除, ⅠB期行雙側附件切除。對>Ⅰ期的患者應行腫瘤細胞減滅術,盡可能地切除病灶及轉移灶。研究發現僅有一半的病例在冰凍組織切片中發現了惡性轉變[17],這增加了再次手術的風險。腫瘤常和周圍組織發生粘連,在手術過程中應盡可能避免腫瘤破裂,以免播散。對于MCT惡性轉化尚未超出包膜時,完全手術切除腫瘤對于長期生存是非常重要的[18]。本病例雖為育齡期患者,但無生育要求,故行全面分期手術,以求更好的預后。
2.3.2 放/化療 卵巢癌的一線化療方案首選鉑+紫杉烷,一般行6個周期治療,該化療方案對卵巢腫瘤有顯著的抑制作用,可以增加患者的長期生存率[5]。有研究應用卡鉑、紫杉醇和貝伐單抗聯合化療成功治療1例ⅢA1期的MCT鱗癌患者,貝伐單抗可考慮用于改善該腫瘤晚期的預后治療[19]。與單純惡性卵巢癌切除手術相比,在細胞減滅術中加入腹腔熱灌注可使中位無復發生存期延長3.5個月,中位總生存期延長11.8個月,且術后并發癥發生率、不良事件的發生率和類型以及與健康相關的生活質量結果沒有顯著差異[20]。婦科惡性腫瘤腹腔熱灌注化療臨床應用專家共識(2019)[21]提出腹腔熱灌注可用于卵巢癌(包括少見類型的卵巢腫瘤)的初治治療及預防惡性腫瘤術后腹膜腔種植轉移。Yu等[8]發現所研究的所有惡性MCT伴腹膜播散均為腸型腺癌(CK20和Mucin-2陽性,CK7陰性),該類腫瘤可能更易在腹腔內播散,這是應用腹腔熱灌注治療的合理依據。有報道顯示接受烷基化藥物作為輔助化療的患者可從中獲益,而放射治療不但不能延長生存率且對卵巢功能產生不可逆損傷[22]。Yoshida等[23]研究發現術后放療或同步放化療對MCT鱗癌變晚期患者的治療是有效的且對其預后有重要影響。本病例患者較年輕,為預防腹膜播散,故行腹腔熱灌注,且術后予紫杉醇+卡鉑化療,隨訪未見復發。
2.3.3 其他治療KRAS突變可能與MCT腺癌變相關,因此Li等[24]提出對抗表皮生長因子受體的靶向治療可能是有效的。Gordon等[25]描述了1例肝內殘留畸胎瘤引起的未分化腺癌患者,在用全反式維甲酸(all-trans retinoic acid,ATRA)治療后獲得完全緩解。ATRA可誘導不同類型惡性腫瘤的體外細胞分化和生長抑制,建議考慮用ATRA治療不能切除的惡性轉化為腺癌的畸胎瘤。但治療方案暫未標準化,還需要進一步的研究來評估這些治療方法對這種罕見腫瘤的有效性。
2.3.4 預后 凌靜嫻等[15]分析了14例MCT惡變術后化療的病例發現,鱗癌變的5年生存率(57%)是腺癌變(14.3%)的4倍,并且預后良好的患者均為臨床Ⅰ期, >Ⅰ期的患者長期生存率較差。Chen等[26]報道腫瘤體積大(>13.8 cm)的患者預后比腫瘤小的患者差。且腫瘤標志物與預后相關,腫瘤標志物陰性的患者長期生存率比陽性患者高很多,如血清SCC-Ag為陽性者2年及5年生存率分別為48.9%、39.1%,陰性者2年及5年生存率分別為83.3%、83.3%;CA125陽性者2年及5年生存率分別為32.0%、18.0%,陰性者2年及5年生存率分別為92.9%、92.9%[26]。另外,年齡≥45歲的患者預后比<45歲的差[27]。因此,預后可能與腫瘤細胞學類型、臨床分期、腫瘤大小、腫瘤標志物及年齡相關。本病例較年輕,腺癌ⅠA期,CEA輕度升高,術后復查CEA恢復至正常范圍內,隨訪5月余,未見腫瘤復發。
綜上所述,MCT惡變很少見,MCT惡變為腺癌更為罕見。因早期缺乏特征性的臨床表現,導致術前很難確診MCT腺癌變。年齡、腫塊大小、腫瘤標志物、影像學可以輔助診斷。確診主要依賴病理檢查及免疫組化。術者在術中應該準確識別異常部位做標記、多取材,以期提高術中快速切片診斷的準確性,減少漏診。診斷MCT惡變為腺癌,若腫瘤性上皮表達消化道免疫表型,還應結合消化道檢查,排除消化道原發腺癌轉移。無生育要求者,全面分期手術是最常見手術方式,化療可以延長生存率,放療仍有爭議。
作者聲明:本文全部作者對于研究和撰寫的論文出現的不端行為承擔相應責任;并承諾論文中涉及的原始圖片、數據資料等已按照有關規定保存,可接受核查。
學術不端:本文在初審、返修及出版前均通過中國知網(CNKI)科技期刊學術不端文獻檢測系統的學術不端檢測。
同行評議:經同行專家雙盲外審,達到刊發要求。
利益沖突:所有作者均聲明不存在利益沖突。
文章版權:本文出版前已與全體作者簽署了論文授權書等協議。

