基于網絡藥理學及分子對接探討雷公藤干預結締組織相關間質性肺病的分子機制
張希濤,葛春蕾,彭井華,賈新華
1山東中醫藥大學,濟南 250014;2山東中醫藥大學附屬醫院,濟南 250011
結締組織相關間質性肺病(connective tissue disease-associated interstitial lung disease,CTD-ILD)是指患者在自身免疫性疾病基礎上并發有肺部間質性病變。結締組織病(CTD)主要病理變化為疏松結締組織發生黏液性水腫、類纖維蛋白變性、小血管壞死和組織損傷,肺內由于含有豐富的膠原、血管等結締組織,并具有免疫調節、代謝、內分泌等功能,常成為CTD累及的重要靶器官[1]。一項2 000例結締組織病患者隨訪20年的研究表明,CTD-ILD的預后比沒有并發間質性肺病(ILD)的CTD患者更差,肺疾病占CTD全部死因的21.5%,其中ILD占其中的46.7%,ILD明顯降低了CTD患者的生存率[2]。現階段,對于CTD-ILD的治療多選用激素+免疫抑制劑的治療方案,但不良反應較多并伴有多種并發癥,且臨床統計的效果具有明顯的差異性,總體來說并不令人滿意[3]。
雷公藤(Tripterygiumwilfordii)為衛矛科雷公藤屬植物,其性寒,味苦,有大毒,歸屬心、肝、胃、腎四經,具有祛風除濕、通絡止痛等功效。現代藥理學研究[4]認為,雷公藤具有有抗炎、調節免疫、鎮痛、抗腫瘤、抗血管生成、保護神經、保護關節軟骨等多種藥理作用。臨床多用于類風濕關節炎、系統性紅斑狼瘡、急慢性腎小球腎炎等自身免疫性疾病的治療。然而,對于其在CTD-ILD中的應用并未引起廣泛重視,尤其是關于其分子機制的研究多局限在單一成分、靶點、通路上,未曾系統性的評估雷公藤在CTD-ILD疾病網絡中所發揮的作用。
為進一步研究雷公藤干預CTD-ILD的作用機制,筆者在課題組前期研究的基礎上[5-7],運用網絡藥理學及分子對接技術等現代生物信息學技術,從雷公藤的物質成分出發,著眼于整體角度分析雷公藤干預CTD-ILD的分子機制,同時為后續研究提供一定的理論基礎。
1 資料與方法
1.1 雷公藤主要活性成分及作用靶點的篩選
通過TCMSP數據庫[8](http://tcmspw.com/tcmsp.php)獲取雷公藤的化學組成成分,根據ADME屬性值篩選出生物活性較高的成分,設置篩選參數為:口服生物利用度(oral bioavailability,OB)>30,類藥性(drug-like,DL)>0.18,氫鍵給體(hydrogen bond donors,Hdon)≤5,氫鍵受體(hydrogen bond acceptors,Hacc)≤10。篩選完成后,在TCMSP數據庫進行靶標預測,并根據已發表的文獻報道補充雷公藤的化學成分[9,10,11],在Swiss Target Prediction平臺(http://www.swisstargetprediction.ch)進行靶點預測。篩選結束后,統一在Uniprot蛋白質數據庫(https://www.uniprot.org)將化合物的靶點蛋白進行規范化處理,得到對應的靶點基因名稱。
1.2 CTD-ILD相關靶點基因篩選
以“Connective Tissue Disease-associated Interstitial Lung Diseases ”作為檢索關鍵詞,通過OMIM數據庫(http://www.omim.org)、GeneCards數據庫(https://www.genecards.org)挖掘與CTD-ILD相關的潛在靶點,進入DrugBank數據庫(https://www.drugbank.ca)尋找已經獲準使用的干預CTD-ILD的西藥作用靶點予以補充[12]。合并3個疾病數據庫靶點,刪除重復值得到CTD-ILD相關靶點。
1.3 雷公藤成分-CTD-ILD靶點(PPI)網絡構建
通過R x64 4.0.0軟件將雷公藤作用靶點與CTD-ILD靶點取交集并繪制韋恩圖。提取交集靶點提交至STRING數據庫(https://string-db.org),構建蛋白互作網絡(PPI)模型[13]。將物種類型設定為“Homo sapiens”,最小互相作用閾值設定為“highest confidence”(> 0.9),隱藏游離蛋白,余均為默認設置。得到PPI網絡后,通過CytoScape3.8.0對PPI網絡進一步分析,提取關鍵的蛋白質功能模塊,并描述其參與的生物進程及功能。
1.4 GO及KEGG富集分析
通過Metascape平臺(http://metascape.org/gp/index.html)對雷公藤干預CTD-ILD的潛在靶點進行GO及KEGG生物富集分析。保存數據結果并運用R語言進行可視化分析。
1.5 雷公藤活性成分-靶點-CTD-ILD信號通路網絡圖的構建
運用CytoScape3.8.0構建“雷公藤活性成分-靶點-CTD-ILD信號通路圖”,并利用CytoScape 3.8.0內置工具分析雷公藤有效成分及靶點的網絡拓撲參數,并根據網絡拓撲學參數篩選出核心靶點及發揮藥效的主要活性成分。
1.6 分子對接驗證
對“成分-靶點-通路”網絡中度值(degree)排名前4的活性成分與靶點進行分子對接,從PDB數據庫(https://www.rcsb.org)下載靶點蛋白的3D結構,并尋找與小分子相似的獨特配體作為原配體(活性口袋位點)。靶點蛋白通過PyMOL移除水分子及原配體,導入AutoDock Tools 1.5.6 進行加氫、計算電荷、合并非極性氫后保存成.pdbqt格式,合并非極性氫后保存成.pdbqt格式。設置Grid Box大小為40×40×40,最后,使用CMD命令字符運行AutoDock Vina進行分子對接[15],用PyMOL對結果進行可視化處理。
2 結果
2.1 雷公藤主要活性成分靶點的獲取
通過TCMSP平臺共獲取雷公藤化學成分144種,經ADME篩選后得到活性成分42種,剔除沒有對應靶點蛋白的13個,剩余活性成分29個,包括雷公藤甲素、雷公藤內酯醇、β-谷甾醇等,文獻補充Tripterinin[10]。為方便后續繪圖及數據處理,予以標記(見表1)。雷公藤各成分對應靶點424個,合并刪除重復值后共得到靶點136個。
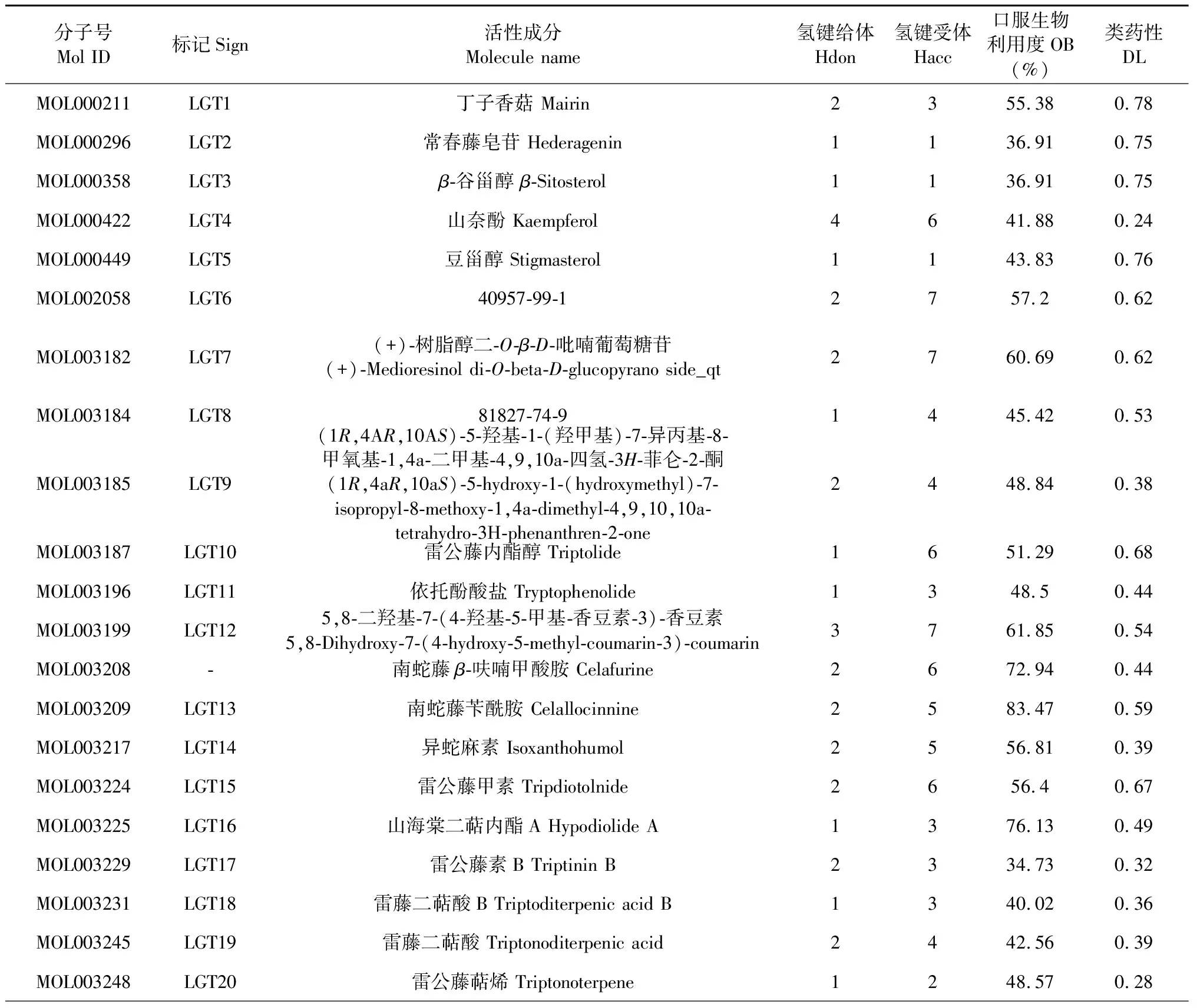
表1 雷公藤主要成分
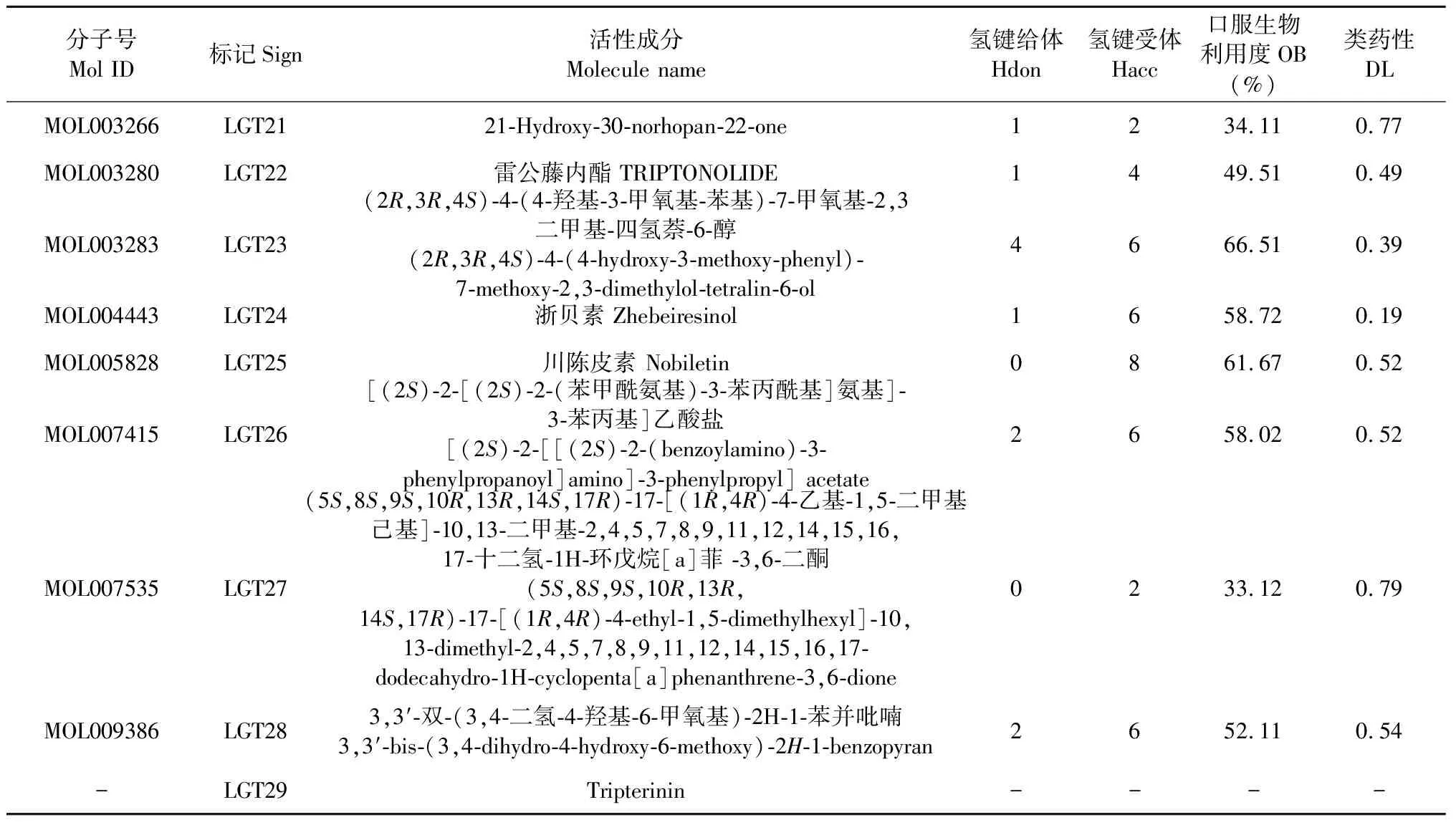
續表1(Continued Tab.1)
2.2 CTD-ILD相關靶點的獲取
在Genecards數據庫中,Score值越高則代表該靶點與疾病聯系越密切。根據文獻[14],當靶點過多時設定Score大于中位數的目標靶點為CTD-ILD相關靶點,通過GeneCards所得靶點的Score最大值為119.41,最小值為0.49,中位數為11.38,故設定Score>11.38的基因靶點為CTD-ILD的相關靶點,篩選后共得到1 032個。從OMIM數據庫中,共獲取520個靶點。DrugBank數據庫檢索中以尼達尼布的作用靶點予以補充,共21個。合并3個數據庫并剔除重復值,最終得到1 496個CTD-ILD相關靶點。
2.3 PPI網絡構建
將雷公藤活性成分靶點與CTD-ILD疾病靶點取交集,通過R語言繪制韋恩圖,得到交集靶點共80個(見圖1)。將交集靶點提交至STRING平臺,構建PPI網絡(見圖2),并通過CytoScape3.8.0中的MCODE插件進行分子復合物預測,提取PPI網絡中具有重要生物學意義的蛋白功能模塊(module,見圖3)。根據P值,選擇PPI網絡中3個評分最佳的MCODE對其生物功能進行描述(見表2)。由結果可見,其功能主要涉及炎癥因子,癌癥通路及參與多種細胞凋亡。
2.4 GO及KEGG分析
應用Metascape平臺對雷公藤干預CTD-ILD相關靶點進行GO,KEGG的富集分析,借助R語言對結果進行可視化處理。由結果可見多個靶點的功能與CTD-ILD的發生密不可分。其中,GO富集分析共得到了3 740個GO條目(P<0.01,FDR<0.01),其中生物過程條目1 559條,涉及炎癥、免疫、代謝、細胞因子介導、生物調節等。分子功能相關條目2 000條,包括抗氧化、激素調節、抗腫瘤、抗炎、分子功能調節、轉錄活性調節等。細胞組成相關條39條,包括細胞外基質、線粒體膜、突觸后膜、膜筏等。
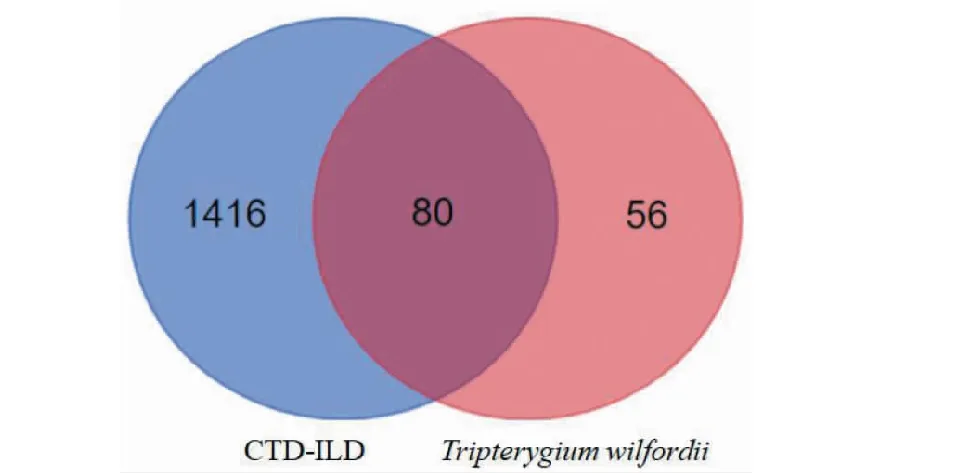
圖1 雷公藤-CTD-ILD靶點韋恩圖Fig.1 The venn diagram of T.wilfordii and CTD-ILD targets
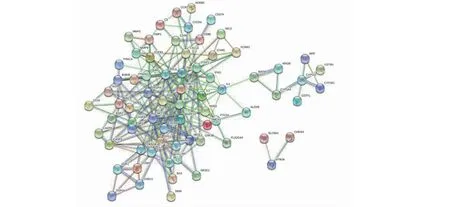
圖2 雷公藤-CTD-ILD潛在靶點PPI網絡Fig.2 Potential target gene PPI(protein interaction)network of T.wilfordii and CTD-ILD
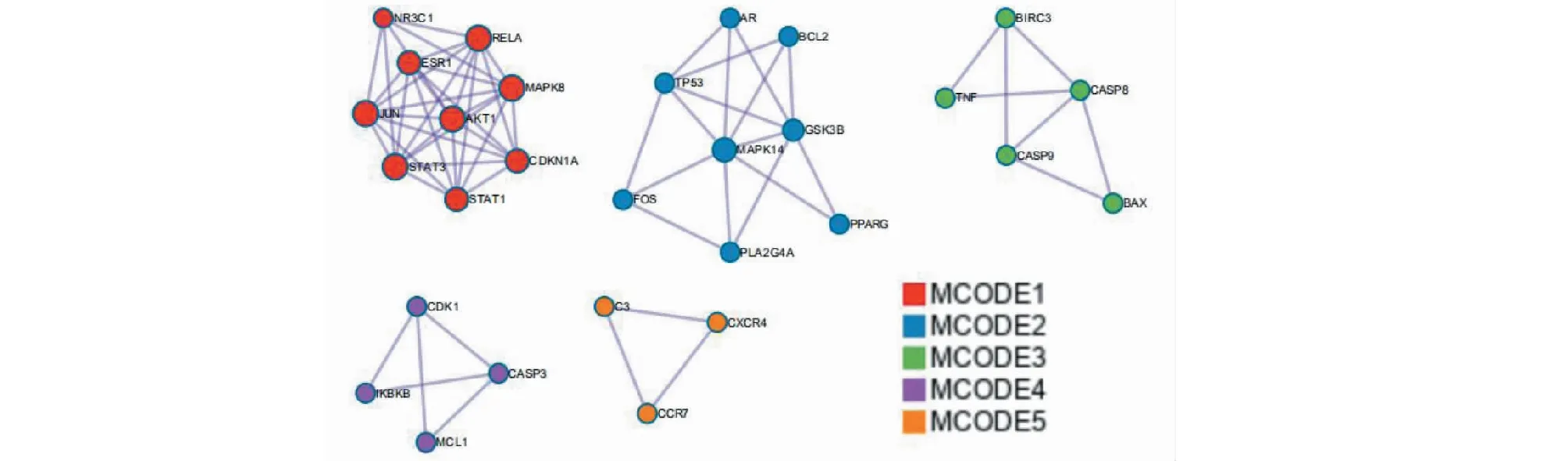
圖3 潛在靶點PPI網絡中的ModuleFig.3 Modules of Potential target gene PPI network
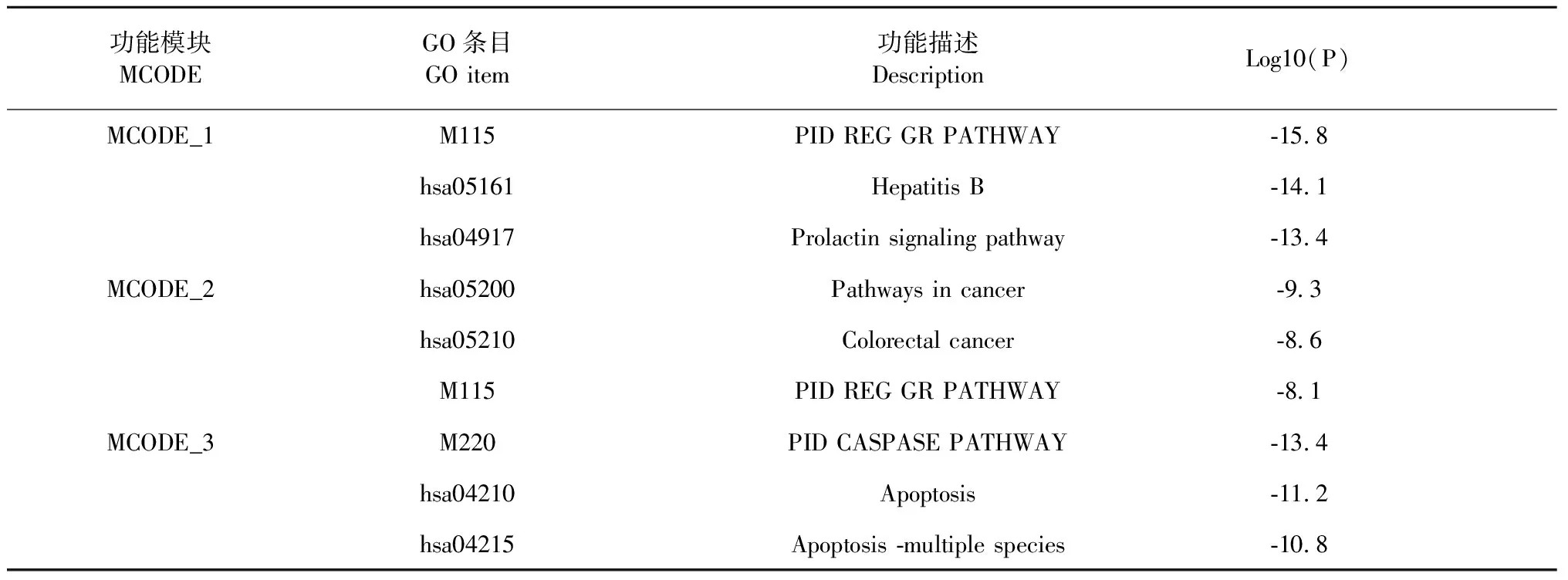
表2 MCODE功能描述
KEGG富集條目共142條(P<0.01,FDR<0.01),包括與炎癥及免疫相關的IL17信號通路(IL-17 signaling pathway)、Th17細胞分化通路(Th17 cell differentiation)、Toll樣受體信號通路(Toll-like receptor signaling pathway)、T細胞受體信號通路(T cell receptor signaling pathway)、TNF信號通路(TNF signaling pathway)等;與氧化應激相關的HIF-1信號通路(HIF-1 signaling pathway)、FoxO信號通路(FoxO signaling pathway)等;癌癥相關通路,如Cancer信號通路(pathways in cancer)、非小細胞肺癌信號通路(non-small cell lung cancer)、結直腸癌信號通路(colorectal cancer)等,以及其他蛋白酶,細胞凋亡相關信號通路。對于GO及KEGG富集結果,根據P值,對前20條相關富集結果進行可視化(見圖4)。
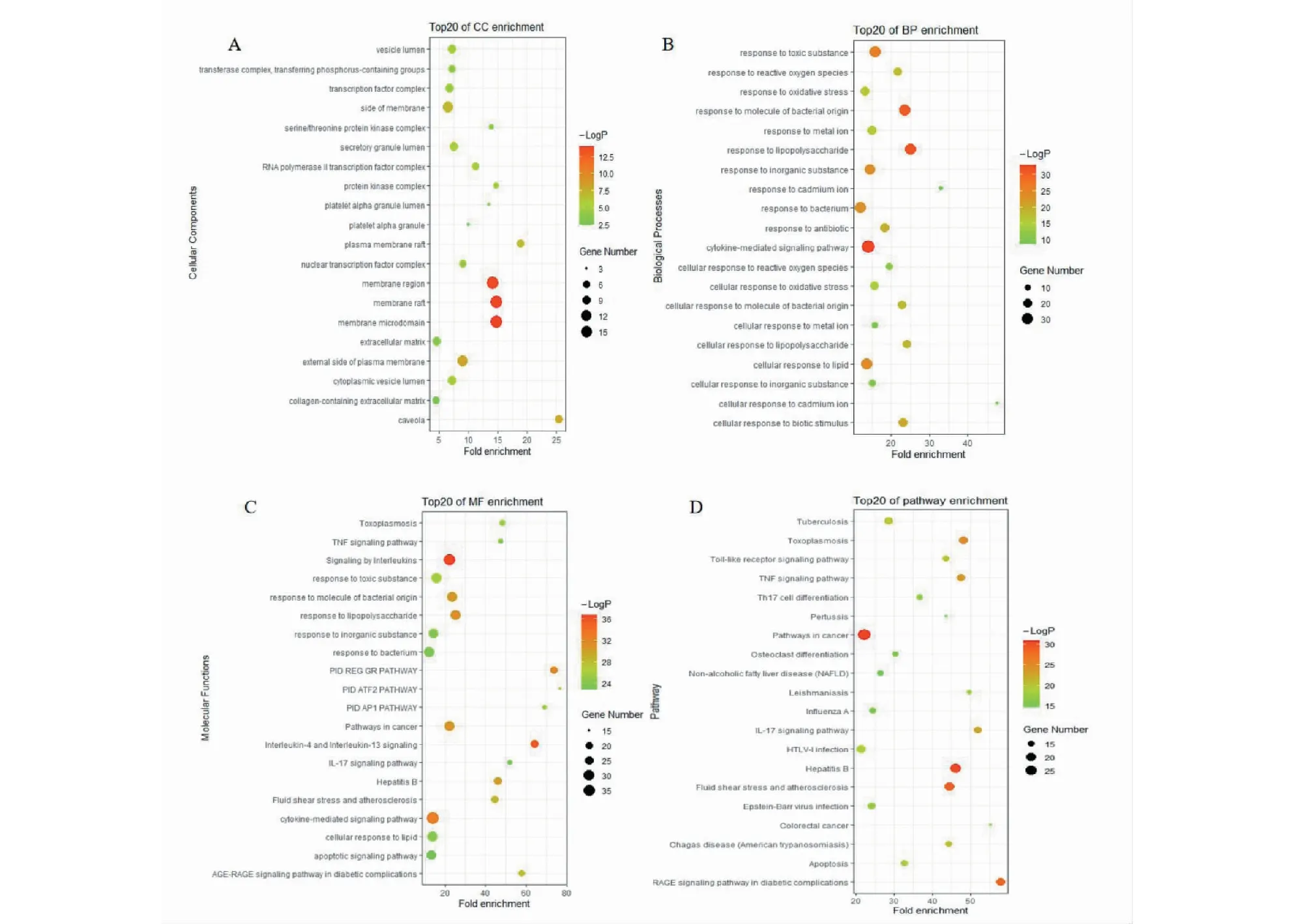
圖4 雷公藤主要成分潛在靶點的富集分析Fig.4 Enrichment analysis of potential targets of main components in T.wilfordii注:A:GO-CC分析;B:GO-BP分析;C:GO-MF分析;D:KEGG分析。Note:A:GO-CC analysis;B:GO-BP analysis;C:GO-MF Analysis;D:KEGG analysis.
2.5 成分-靶點-信號通路網絡的構建
通過CytoScape3.8.0構建“成分-靶點-信號通路”網絡(見圖5)。運用CytoScape3.8.0內置的NetworkAnalyzer分析通路網絡的拓撲學參數,提取核心活性成分及核心靶點。成分-靶點-信號通路網絡分析結果顯示,網絡中共有130個節點,形成了575個關系對。其中,山奈酚連接度(dgree)為34,介度(betweenness centrality)為0.211 545 2,緊密度(closeness centrality)為0.47426471,預測其是干預CTD-ILD中的重要成分,其次為雷公藤內酯醇、川陳皮素、β-谷甾醇等(見表3)。PTGS2連接度26,介度0.153 926 47,緊密度0.507 874 02,預測其是雷公藤干預CTD-ILD的重要靶點,JUN、MAPK8、RELA、SCN5A、TNF等亦為相對重要的靶點(見表4)。
2.6 分子對接結果
對雷公藤核心成分與關鍵靶點進行分子對接,對接結果示(見表5),分子親和力(affinity)< -5 kcal/mol的占93.75%,表示有較好的結合活性,分子親和力< -7 kcal/mol的占62.5%,山奈酚與3V3V的親和力最高,為-8.6 kcal/mol,顯示化合物與靶點之間具有良好的對接活性[16];而其中5次對接結果顯示,部分化合物與靶點受體之間的親和力超過了原配體,分別是:山奈酚與3QXY,山奈酚與5T01,雷公藤內酯醇與3QXY,川陳皮素與5T01,β-谷甾醇與3QXY)(見圖6),這一部分化合物可能通過競爭性抑制原配體與靶點受體的結合而影響其功能,在CTD-ILD中發揮重要作用。
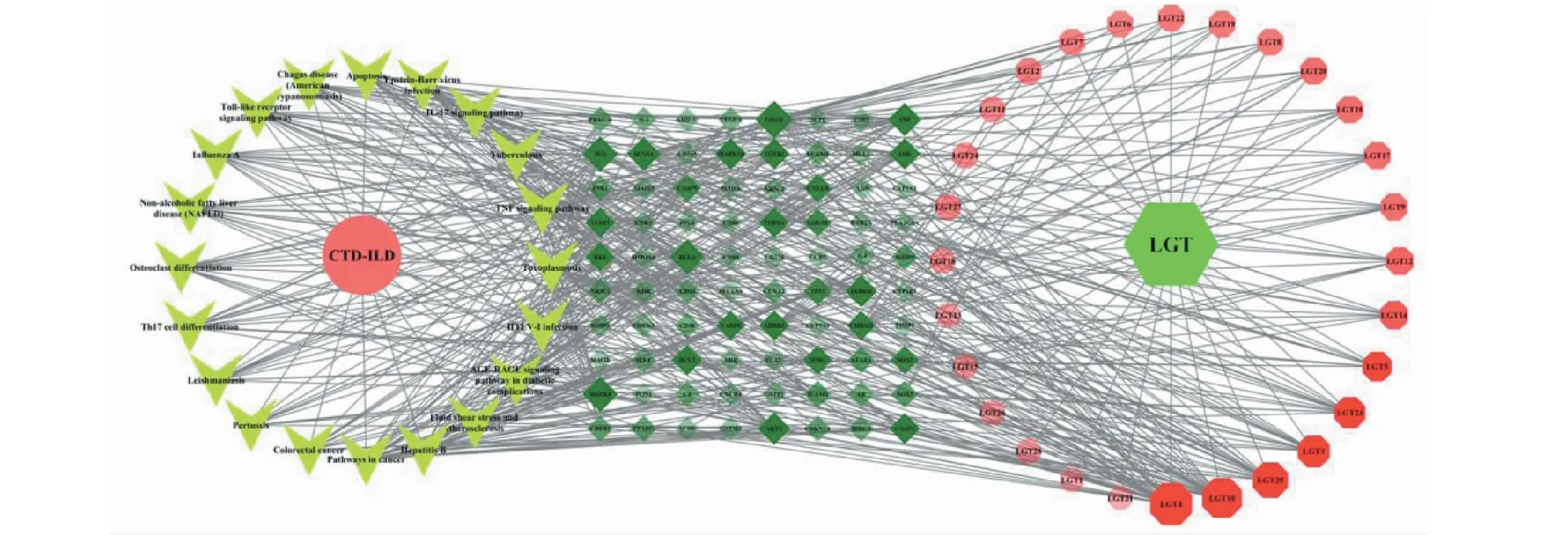
圖5 雷公藤成分-CTD-ILD靶點-信號通路網絡Fig.5 Constituents of T.wilfordii and CTD-ILD target and signal pathway network注:六邊形代表藥物成分;菱形代表靶點;圓形為通路。節點的面積及顏色透明度代表其度值,面積越大、顏色越深說明該節點越重要。Note:Hexagon represents drug composition;Rhomboid represents target;Circle represents pathway.Area and color transparency of nodes represent degree value,larger area and deeper color indicate more important node.

表3 雷公藤核心成分
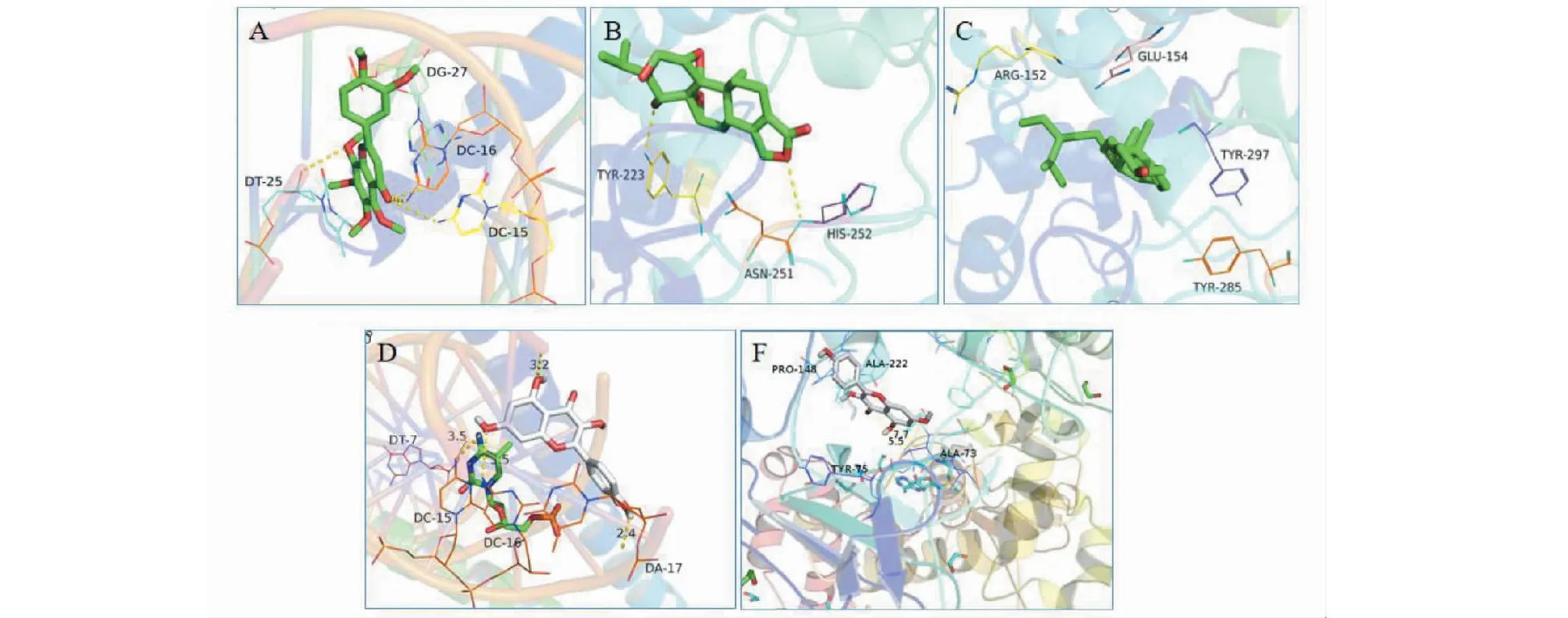
圖6 分子對接模型Fig.6 Molecular docking model注:A:川陳皮素—5T01;B:雷公藤內酯醇—3QXY;C:β-谷甾醇—3QXY;D:山奈酚—5T01;F:山奈酚—3QXY)。Note:A:Nobiletin-5T01;B:Triptolide-3QXY;C:β-Sitosterol-3QXY;D:Kaempferol-5T01;F:Kaempferol-3QXY).
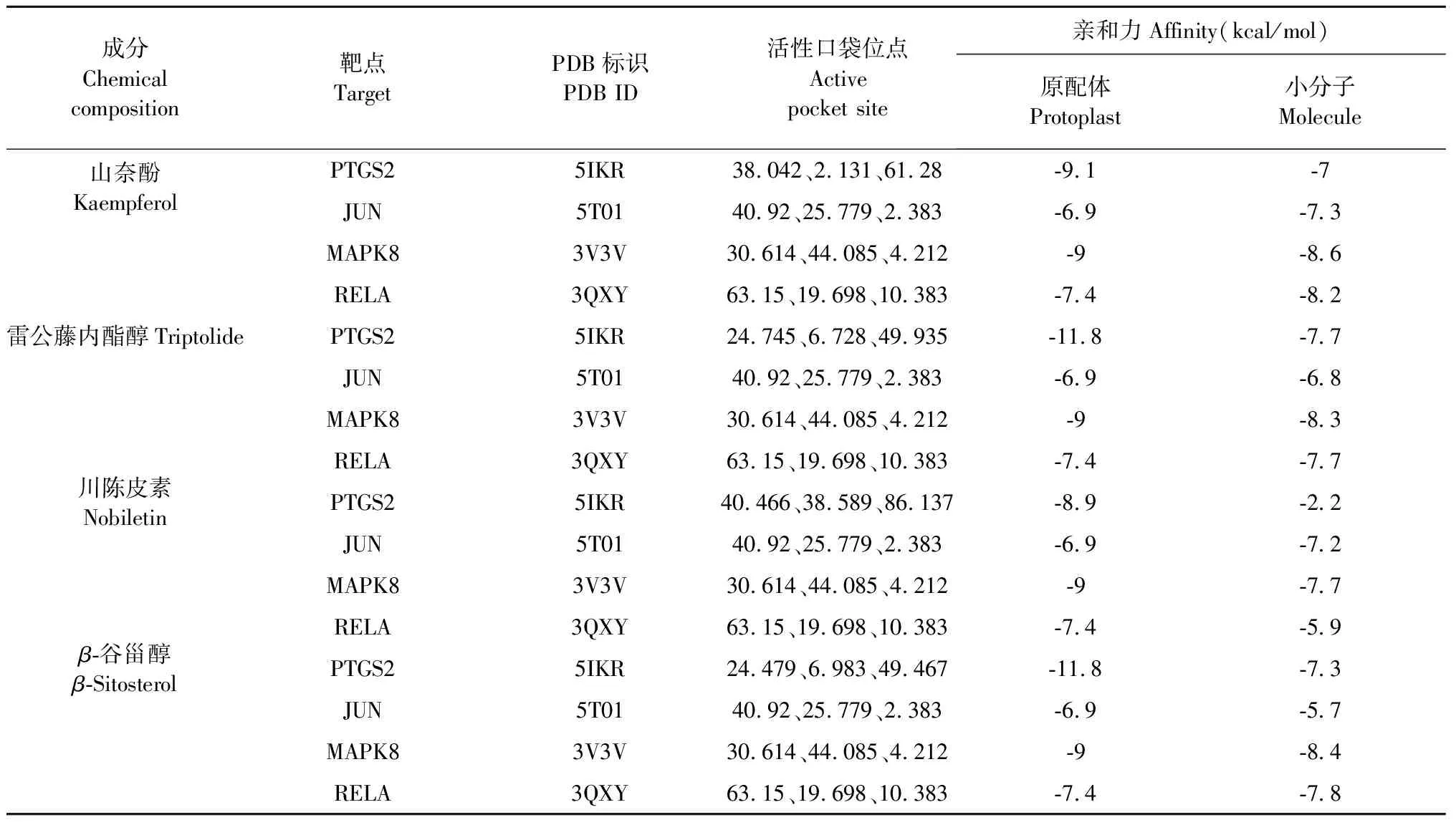
表5 分子對接結果
3 討論
結締組織相關間質性肺病(CTD-ILD)在古代中醫文獻中并未有具體的命名,結合本病的臨床表現及病因病機可將其歸屬為“肺痹”的范疇,《內經》中最早簡述了肺痹的臨床表現及病因,如《素問·痹論篇》曰:“五臟皆有所合,病久而不去者,內舍于其合也,……皮痹不已,復感于邪,內舍于肺;所謂痹者,各以其時重感于風寒濕之氣也;凡痹之客五臟者,肺痹者,煩滿喘而嘔;淫氣喘息,痹聚在肺”,又曰:“其入臟者死,其流連筋骨間者疼久,其留皮膚間者易已”,論述本病病情較重,預后差;目前西醫大多應用糖皮質激素及免疫抑制劑治療,但其不良反應實多并伴有多種并發癥,治療效果不甚理想;隨中醫藥文化蓬勃發展,中醫藥通過運用整體觀念、辨證論治的原則在多種疾病治療中的優勢凸顯,同時中藥主要來源于天然的動植物、礦物及其加工品等,有效成分眾多。多項研究證實,中醫藥在CTD-ILD的治療中具有獨特的優勢。Qu等[7]從中醫整體觀及現代醫學的角度出發,基于“伏毒學說”論治,提出了扶正益氣托毒、化痰通絡解毒兩種治法,此外本課題組還論述了雷公藤在不同類型的結締組織相關間質性肺病中的臨床應用及作用機理[5,6]。基于上述理論研究,本篇基于網絡藥理學及分子對接技術進一步探討雷公藤干預CTD-ILD的分子機制,為雷公藤用于本病治療提供理論依據,并期待能為新藥的研究提供方向。
筆者運用網絡藥理學研究方法篩選出雷公藤有效活性成分29個,預測作用靶點136個,其中與CTD-ILD相關的靶點80個,占總靶點的59%,說明雷公藤對于CTD-ILD的治療具有極高的針對性,可以通過多成分、多靶點聯合發揮治療作用,在CTD-ILD的治療中有一定的研究價值;根據PPI及“成分-靶點-通路”網絡的拓撲屬性分析結果,得到排名前5的關鍵化合物分別為山奈酚、雷公藤內酯醇、川陳皮素、β-谷甾醇、豆甾醇。
山奈酚屬于黃酮類化合物,廣泛存在于各種植物中。現代藥理學研究表明,山奈酚具有抗癌、防癌、抗炎、抗氧化、抗菌等作用。Wang等[17]研究發現,山奈酚在體外可以以非競爭性的方式抑制鈣調磷酸酶(CN)的活性,后者是一種高度保守的絲/蘇氨酸蛋白磷酸酶,其參與細胞因子介導的T細胞活化,在免疫調節過程中發揮重要的作用,同時,山奈酚還能抑制Jurkat細胞中IL-2基因的表達,發揮了免疫抑制的作用。川陳皮素具有抗炎、抗癌、抗突變、抗血栓形成、抗膽堿酯酶等作用,Zheng等[18]研究發現,川陳皮素使細胞線粒體膜電位下降并隨時間延長,Akt、p-Akt蛋白表達下調呈時間依賴性,從而得出川陳皮素可以通過線粒體途徑抑制PI3K/Akt信號通路的激活,而PI3K/Akt信號通路通過刺激成纖維細胞增殖、促進纖維分泌及膠原沉積等在肺纖維化“損傷-修復”這一中心環節中發揮重要作用。雷公藤內酯醇是一種環氧二萜內酯化合物,其在抗氧化,抗類風濕,抗老年性癡呆癥,抗癌等方面發揮重要作用,同時被廣泛認為是雷公藤最主要的抗炎和免疫抑制成分[19]。相關藥理研究認為,雷公藤內酯醇可以通過調控MAPK和VEGF等信號轉導通路下調TNF-α、IL-6等炎癥因子的表達,發揮抗炎作用,Hu等[20]通過網絡藥理學角度闡明雷公藤內酯醇抗風濕作用機制為通過調節MAPK信號轉導通路來抑制炎性細胞因子的產生和調節VEGF信號轉導通路在關節抑制細胞因子的表達,來減少膠原蛋白的產生、抑制滑膜細胞增殖、減弱侵襲能力等。實驗觀察發現[21],豆甾醇和β-谷甾醇均可通過顯著降低非酒精性脂肪肝細胞內MDA含量、提高GSH水平,減輕脂質蓄積造成的肝細胞的過氧化損傷,增強細胞的解毒功能,其具有較強的抗氧化活性,可較好地改善細胞脂質沉積所引起的氧化應激狀態。綜上分析,這些關鍵化合物成分大多具有抗炎、抗癌、抗氧化、免疫抑制等作用,這提示雷公藤可能通過抗炎,抗氧化,免疫抑制等途徑起到治療CTD-ILD的作用。
富集分析的結果顯示,IL17信號通路、TNF信號通路、Cancer信號通路等是雷公藤干預CTD-ILD的重要通路,其他還包括Th17細胞分化通路、Toll樣受體信號通路、T細胞受體信號通路、FoxO信號通路、非小細胞肺癌信號通路、結直腸癌信號通路等,主要涉及炎癥相關、免疫相關、氧化應激及腫瘤等。其中IL17可以促進肺成纖維細胞的增殖及向肌成纖維細胞的轉化,并且能夠促進Ⅰ、Ⅲ膠原蛋白的合成,進而加快肺纖維化的進程[22]。TNF-α參與了肺纖維化的急性炎癥反應,可以促進Ⅱ型肺泡細胞的凋亡,從而抑制肺損傷的修復[23],同時,TNF-α可以誘導成纖維細胞大量聚集,膠原合成增加[24]。研究結果還表明,諸多癌癥相關通路參與了肺纖維化的進程,如Wnt/β-catenin信號通路不僅參與腫瘤發生發展,同時也參與肺纖維化的進展,有證據表明Wnt1可誘導信號蛋白-1(WISP1)是肺泡上皮II型細胞增生的關鍵調節因子,同時也是抗纖維化治療重要靶點[25],并且是治療肺纖維化合并肺癌有希望的靶點之一。
雷公藤干預CTD-ILD治療的主要靶點為PTGS2。其中前列素內環氧化物合成酶(prostaglandin endoperoxide synthase,PTGS),又稱環氧合酶(cyclooxygenase,COX),是花生四烯酸合成前列腺素的關鍵限速酶,分為結構型COX-1與誘導型COX-2。Yang等[26]通過實驗研究發現,COX-2 在博萊霉素肺纖維化組織中有高度表達,主要分布于細支氣管上皮細胞,其能上調PEG2的表達,進而導致Th1/Th2型細胞因子的平衡失調,刺激體內炎癥介質的產生,加速肺纖維化進程。我們的研究還發現,CTD-ILD中多個重要基因與腫瘤密切相關,如PTGS2、JUN、TNF等。無論是從靶點亦或是信號通路角度,腫瘤與CTD-ILD都具有明顯的相關性,與KEGG富集結果相符。最后分子對接的結果也驗證了本次研究結果的可靠性。
依據本次研究結果,雷公藤可以通過多靶點、多通路的聯合干預CTD-ILD的進程,其關鍵化學成分為山奈酚、雷公藤內酯醇、川陳皮素、β-谷甾醇、豆甾醇,關鍵靶點為為PTGS2、JUN、MAPK8、RELA等。鑒于雷公藤與CTD-ILD的相關研究不足,缺乏更多證據支持,后續將在此基礎上進行動物及細胞實驗的驗證,對于CTD-ILD的治療仍需廣大科研工作者進行更多的基礎性及臨床性的深入研究;同時期待本研究預測結果能為研發新藥或新的治療手段提供方向。

