多柔比星脂質體與表柔比星在HER-2陰性乳腺癌術后輔助化療中的比較
周竹超曹玉雪鄔劍華△
(1復旦大學附屬華山醫院普外科,2中西醫結合科 上海200040)
乳腺癌發病率位居女性惡性腫瘤之首,年發病率達30/10萬~40/10萬,并有逐年增高的趨勢。乳腺癌在40~60歲高發,隨著經濟發展,發病有年輕化趨勢,疾病負擔加重。
目前對于乳腺癌術后輔助化療,美國國立綜合癌癥網絡(NCCN)和中國指南均推薦以蒽環類藥物為主的方案。雖然以表柔比星、多柔比星為主的蒽環類藥物改善了乳腺癌患者的預后,但其骨髓抑制、消化道反應、脫發、口腔炎及心臟損害等不良反應較大。特別是心臟損害具有累積性,限制了蒽環類藥物的長期使用。
新一代聚乙二醇多柔比星脂質體(pegylated liposomal doxorubicin,PLD)具有被動靶向性,較表柔比星更易在腫瘤組織中富集,正常組織分布降低。許多臨床研究證實[1-4],聯合PLD方案可提高局部晚期或復發性乳腺癌患者的臨床療效,且以PLD代替傳統多柔比星和表柔比星可能會大大降低藥物對心臟的損害,且惡心、嘔吐等胃腸道反應較少,目前PLD在術后輔助化療中的有效性和不良反應還缺乏大樣本的數據。
HER-2陽性乳腺癌惡性程度高,早期易復發轉移,總體預后較差[5],HER-2陽性乳腺癌患者的臨床治療多聯合應用靶向藥物,目前抗HER-2靶向治療藥物較多,不僅存在與曲妥珠單抗聯用或序貫使用的問題,而且存在原發和繼發耐藥。為了減少HER-2陽性乳腺癌治療的干擾,本研究選取術后輔助化療含蒽環類藥物方案的HER-2陰性乳腺癌患者。本文旨在評價PLD與表柔比星在HER-2陰性乳腺癌術后輔助化療中的治療效果,為臨床應用提供進一步的支持。
資料和方法
一般資料回顧性收集2015年5月—2020年2月在復旦大學附屬華山醫院普外科行乳腺癌手術并完成輔助化療的368例HER-2陰性乳腺癌患者的臨床資料。對于2015年5月—2017年2月結束輔助化療的患者,隨訪術后3年無病生存期(disease-free survival,DFS)、復發率及轉移率。
入組標準:經病理學證實為浸潤性乳腺癌;女性,年齡18~70歲;行乳腺癌改良根治術、保乳根治術或標準根治術;術后接受含PLD或表柔比星的標準方案且完成化療,包括多柔比星脂質體(A)/表柔比星(E)環磷酰胺(C)×4-紫杉醇(P)/多西他賽(T)×4、TA/EC×6和5-氟尿嘧啶(F)A/EC×6方案;臨床資料完整,包括手術日期、病理診斷、化療方案及不良反應、復發和/或遠處轉移證據。排除標準:Ⅳ期乳腺癌患者;合并心(左室射血分數≤50%)、肝、腎等臟器功能障礙者;患有其他惡性腫瘤的患者;HER-2陽性乳腺癌患者。
入組患者均為女性,平均年齡(52.35±10.04)歲;行改良根治術268例,行標準根治術53例,行保乳根治術47例;浸潤性導管癌330例,浸潤性小葉癌8例,其他特殊型浸潤性癌30例。根據美國癌癥聯合會制定的第七版腫瘤TNM分期[6]對術后患者進行疾病分期:Ⅰ期117例,Ⅱ期156例,Ⅲ期95例。238例 行A/EC×4-T×4方 案 化 療,70例 行TA/EC×6方案化療,60例行FA/EC×6方案化療。
2015年5月—2017年3月行乳腺癌手術及術后輔助化療的HER-2陰性乳腺癌患者101例,參考《中國抗癌協會乳腺癌診治指南與規范(2019)版》[7]中乳腺癌術后復發風險的分組,對101例患者進行術后復發風險評估,分為低危、中危和高危。隨訪期間局部或區域復發11例,遠處轉移13例。本研究在復旦大學附屬華山醫院倫理委員會備案。
治療及隨訪方案化療前30 min常規給予托烷司瓊止吐,地塞米松抗過敏,奧美拉唑抑酸護胃等對癥治療。根據患者體表面積,計算化療藥物使用劑量。觀察組使用含PLD(30 mg/m2)的方案,對照組使用含表柔比星(100 mg/m2,TA/EC×6方案中表柔比星80 mg/m2)的方案。其他合并化療藥物使用劑量均參考《中國抗癌協會乳腺癌診治指南與規范(2015版)》[8]。21天為一療程。所有患者均按照標準化療方案完成化療。化療前告知患者可能出現的不良反應及注意事項,化療過程中密切觀察患者不適反應。
所有患者完成化療期間隨訪,即術后首次輔助化療第一天至末次輔助化療最后一天。通過醫院電子病例系統獲取患者手術時間、病理診斷、化療情況及不良反應記錄情況,以及化療期間的檢查結果評估有無復發轉移。其中2015年5月—2017年2月結束輔助化療的患者隨訪術后3年DFS及復發轉移情況。通過住院及門診電子系統結合電話隨訪獲取患者術后治療情況、不良事件、DFS及復發轉移情況。隨訪截止時間為2020年2月29日。
研究終點
遠期療效評價DFS:從手術日至疾病復發或任何原因導致的死亡之間的時間(以先發生的計算)。術后復發率、術后轉移率:出現復發或轉移的例數/各組總例數×100%。
乳腺癌術后復發分為局部復發及區域復發。乳腺癌術后同側胸壁再次出現腫瘤定義為局部復發;患者患側的淋巴引流區,包括鎖骨上/下及內乳淋巴結及腋窩淋巴結區域再次出現腫瘤定義為區域復發。復發診斷主要依據臨床檢查及病理活檢等。乳腺癌術后遠處轉移包括內臟轉移(胸腔、腹腔及盆腔)、骨轉移及中樞神經系統轉移。乳腺癌遠處轉移診斷主要根據臨床影像檢查及病理活檢等。
不良反應評價包括白細胞減少、貧血、血小板減少、惡心嘔吐、脫發、心肌損害、肝功能損害、手足綜合征、過敏反應。記錄使用PLD/表柔比星期間出現的不良反應。如出現多次,記錄最嚴重的一次。化療前和使用PLD/表柔比星后隨訪心超、心電圖了解心肌損害情況。毒性分級:根據WHO急性亞急性化療藥物毒性作用和不良反應評定標準進行評定,分為0級(無)、Ⅰ級(輕度)、Ⅱ級(中度)、Ⅲ級(重度)和Ⅳ級(威脅生命)。
統計學分析采用SPSS 22.0對數據進行統計學分析。定量資料以±s表示,組間比較采用t檢驗;定性資料以n(%)表示,組間比較采用χ2檢驗或者Fisher精確檢驗。兩組患者DFS差異的Kaplan-Meier曲線通過SPSS繪制,差異用對數秩檢驗計算P值。構建多變量Cox風險比例模型校正影響DFS的評價指標,P<0.05為差異有統計學意義。
結 果
基線臨床資料比較PLD組(n=175)和表柔比星組(n=193)比較,患者BMI、腫瘤最大徑、臨床分期、術后輔助化療方案差異無統計學意義(表1)。遠期療效觀察中,兩組患者年齡、BMI、腫瘤最大徑、腫瘤類型、分子分型、腫瘤分期、術后輔助化療方案及術后復發風險差異無統計學意義(表2)。
輔助化療后DFS影響因素的多因素分析為排除混雜因素構建Cox風險比例模型,先分別對腫瘤分期、復發風險、腫瘤最大徑、Ki67(+)、脈管瘤栓、分子分型及年齡進行Log-rank單因素分析,再將P<0.1的變量(復發風險P=0.000,分子分型P=0.000)以及常用的影響腫瘤預后的變量腫瘤分期、腫瘤最大徑、Ki67(+)納入多變量分析,乳腺癌輔助化療后DFS與復發風險、分子分型、腫瘤分期、腫瘤最大徑、Ki67(+)以及使用PLD/表柔比星無關(表3)。
療效比較兩組患者均無死亡。3年隨訪中PLD組45例患者中6例(13.3%)復發轉移(表4);表柔比星治療組56例患中10例(17.8%)復發轉移。PLD治療組3年DFS與表柔比星組相當,差異無統計學意義(P=0.09,圖1)。
化療期間不良反應比較從表5可以看出,PLD組在脫發、惡心嘔吐和心肌損害等方面優于表柔比星組,但PLD組的手足綜合征發生率明顯高于表柔比星組(P<0.05)。另外,比較了兩組化療結束后LEVF%下降的例數,PLD組為12例,表柔比星組為28例,差異有統計學意義(P=0.007)。在貧血、粒細胞缺乏、血小板減少、發熱、肝功能損害方面,兩組差異無統計學意義。在Ⅰ級過敏反應發生方面,兩組差異有統計學意義(P=0.037),說明PLD組過敏反應發生率較表柔比星組較高。
表2 遠期療效觀察中兩組HER-2陰性乳腺癌患者一般資料的比較Tab 2 Comparison of general data between the two groups of HER-2 negative breast cancer patients in the long-term efficacy study[±s or n(%)]
at test.
?
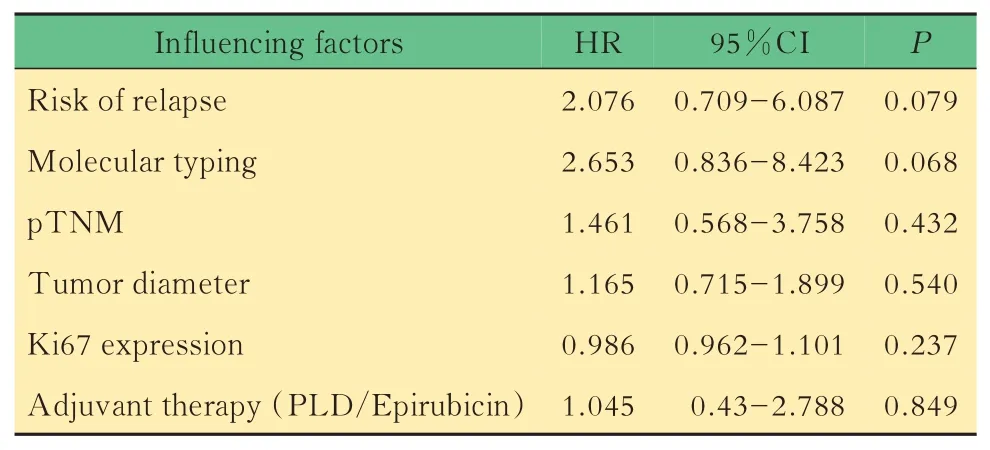
表3 HER-2陰性乳腺癌患者DFS影響因素的多因素Cox回歸分析Tab 3 Multivariate Cox regression analysis on influencing factors of DFS in HER-2 negative breast cancer patients
討 論
傳統蒽環類藥物可抑制RNA和DNA的合成,抗瘤譜比較廣,細胞毒性作用較強。在臨床使用過程中,傳統蒽環類藥物骨髓抑制、消化道反應、脫發、口腔炎、心臟損害等不良反應較大。且其劑量與療效和不良反應呈正比。有研究發現使用低劑量蒽環類藥物就可能引起心臟損害[9]。當多柔比星累積劑量達到50 mg/m2時,心臟出現左心室功能障礙。首次使用蒽環類藥物就有可能出現,逐漸加重,且損害不可逆轉。
PLD為聚乙二醇脂質體包裹阿霉素,加載脂質體后,與傳統劑型相比,具有許多獨特的優點,例如可提高藥物緩釋作用、靶向更集中及生物利用度較高,且能減輕心臟損害和減少骨髓抑制等不良反應的發生[10]。前期研究主要針對PLD在三陰性乳腺癌、HER-2陽性乳腺癌以及新輔助化療、晚期乳腺癌方面的應用。Meta分析表明[2]:與傳統阿霉素治療相比,基于脂質體阿霉素化療的患者無進展生存期有所改善,但差異無統計學意義(P=0.12),而總生存期的差異也無統計學意義(P=0.93)。另一項Meta分析基于11項臨床前研究,比較了PLD和阿霉素在帶瘤小鼠中的功效[11]。動物研究顯示,與傳統阿霉素比較,經PLD治療的小鼠存活率顯著提高(HR=0.39;95%CI:0.27~0.56),但臨床結果分析顯示PLD無任何療效優勢。為什么載體介導的化學療法的藥理學優勢不能轉化為增強的臨床功效,載體介導的藥物全部臨床潛力仍有待實現。

表5 兩組HER-2陰性乳腺癌患者不良反應發生率比較Tab 5 Comparison of the incidence of adverse reactions between the two groups of HER-2 negative breast cancer patients
本研究分為PLD組和表柔比星組,比較兩組在HER-2陰性乳腺癌患者術后輔助化療中的療效和不良反應。兩組一般資料上差異無統計學意義,具有很好的可比性。本研究表明,PLD組在術后DFS、復發及轉移率方面療效與表柔比星組相當。同時本研究表明,PLD組在脫發、惡心嘔吐和心肌損害等不良反應方面優于表柔比星組。這與前期研究結果類似[12-13]。研究表明經脂質體包裹后,粒徑大小約為80~100 nm,無法進入正常的組織(血管內皮細胞間隙≤40 nm),如心臟和胃腸道[14]。傳統蒽環類藥物化療可表現為左心室射血分數下降、充血性心力衰竭、心肌病及心律失常,是發生心臟疾病的最高危險因素,心臟毒性呈進行性加重,且不可逆,目前尚無有效救治手段。初期可能無明顯癥狀,但通常在治療結束5~10年后顯現[15]。一項Meta分析納入1979—2011年的18項 研究49 017例癌癥報告中,22 815例接受過傳統蒽環類藥物治療的患者,隨訪的中位時間為9年,接受傳統蒽環類藥物導致的心臟事件發生率為35.2%[16]。此外,無癥狀的心臟疾病更為普遍,在接受基于傳統蒽環類藥物治療方案的乳腺癌患者中,約50%的患者發生心臟超聲異常[17]。與傳統多柔比星相比,PLD在心臟中的濃度降低了24%[18]。歐洲心臟病學會年會)指出[19]:PLD高累積劑量時心臟毒性發生率依然較低,僅為2%。
本研究表明,PLD組的手足綜合征發生率要高于表柔比星組。PLD組的過敏反應發生率也較表柔比星組有輕度增高。在既往PLD使用報道里有類似情況[20-21]。有研究發現,因PLD為緩釋劑型,清除半衰期長,因此藥物釋放到腫瘤或其他組織速率減慢,且存留時間長[9]。手掌、足底以及反復摩擦部位或有外傷的區域富含毛細血管網,其真皮增厚,血流量增加,導致PLD易于集中在以上部位真皮層引發手足綜合征。其臨床主要癥狀為趾端麻木、疼痛,皮膚腫脹或紅斑,嚴重者發展至脫屑、潰瘍和疼痛。PLD引起的手足綜合征一般在治療6周或更長時間出現,其與使用劑量和使用方法有關。本研究中PLD組出現Ⅲ度以上手足綜合征3例(1.7%),平均累計劑量為61.7 mg/m2,平均緩解時間為12天,1例患者因此而改變化療方案。使用PLD引發的手足綜合征是可以通過早期預防、調整使用劑量、及時藥物治療得到很好的控制,極少數嚴重的患者可能需要暫停PLD。
綜上所述,PLD在HER-2陰性乳腺癌患者術后輔助化療上療效與傳統表柔比星相當,而在脫發、惡心嘔吐和心臟毒性等不良反應上優于表柔比星,安全性較好,臨床應用須注意手足綜合征的發生。進一步研究需要更多前瞻性大樣本數據。
作者貢獻聲明周竹超論文構思和撰寫,數據采集。曹玉雪患者隨訪,數據整理,統計分析。鄔劍華研究設計和修訂。
利益沖突聲明所有作者均聲明不存在利益沖突。

