MgO/Mg(OH)2熱化學儲熱反應的第一性原理研究
王琴,徐會金,韓興超,趙長穎
(上海交通大學中英國際低碳學院,上海200240)
引 言
據BP《世界能源統計年鑒2019》公布的2018年世界能源消費統計,全球一次能源消費近十年增長率均值為1.5%,在2018 年幾乎達到了兩倍(2.9%),全球能源消費量達到138.65 億噸油當量。其中,煤炭消費增長1.62 億噸油當量,增長率1.4%,石油消費量增長140 萬桶/日,增長率1.5%,天然氣消費增長1950 億立方米,增長率5.3%[1-2]。如今,即使在大力發展可再生能源,化石燃料依然是主要的能量來源,可再生能源的占比仍相對較低。由于經濟社會的高速發展,能源需求加大,化石燃料大量燃燒,給生態環境帶來了巨大的壓力,因此,加速推動能源系統低碳轉型仍然十分必要。在能源結構的持續改進過程中,儲能也扮演著越來越重要的角色,它可以解決由于時間、空間或強度上的熱能供給與需求間不匹配所帶來的問題。對比儲熱技術中的顯熱儲熱、潛熱儲熱,熱化學儲熱儲能密度最大[3-4],且其具有儲能密度高、儲熱周期長、常溫下可存儲儲能物質的分解物并實現其遠距離傳輸等優點[5-6]。
在熱化學儲熱反應中,熱量是通過反應焓來存儲的,脫水反應為蓄熱過程,水合為放熱過程。MgO/Mg(OH)2體系是一種很有前途的熱化學蓄熱方法,其反應方程[7]為:
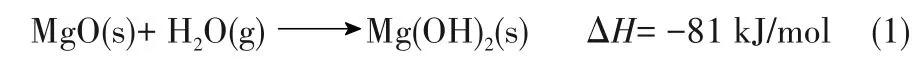
在熱化學儲熱材料中,氧化鎂是最便宜的一種,且安全無毒,其儲熱能力也相當大(約3.3 GJ/m3)。此 外,MgO/Mg(OH)2系 統 反 應 溫 度 在350~400℃之間,條件相對較低,在處理工業余熱方面有很大潛力[8-12]。
目前,國內外對MgO/Mg(OH)2熱化學儲熱體系的應用研究主要集中在反應物體系熱力性質的優化、循環性能測試、儲熱系統的設計及測試、反應器強化傳熱傳質等方面[13]。Nahdi 等[14]利用控制速率熱分析技術測試了MgO/Mg(OH)2水合/分解特性,并進行了一系列典型的材料表征。Kato等[15]將Mg(OH)2和Ni(OH)2混合制成MgxNi1-x(OH)2(x為混合氫氧化物中鎂離子占總金屬離子的摩爾分數)并進行了一些列性能測試,發現混合Ni(OH)2可將反應溫度降低至200~300℃,且可以通過改變材料中混合金屬氧化物的組成來提高操作蓄熱溫度。Mastronardo 等[7]提出了一種新型氫氧化鎂和碳納米管復合材料作為MgO/H2O/Mg(OH)2化學熱泵的蓄熱介質,并采用熱重分析法對合成材料的性能進行了評估,結果表明碳質材料的存在對反應性能有積極影響,使雜化材料比純Mg(OH)2具有更好的蓄熱/產熱能力和更快的產熱速率。Haruki 等[16]制備氫氧化鎂/氧化鎂/膨脹石墨復合材料,測試了不同配比下其導熱性和反應性。目前研究主要采用的是實驗研究和特性表征,對儲熱系統的微觀機理及微觀因素如何影響到宏觀儲熱的過程方面的深入研究還比較缺乏。雖然在分子動力學有部分的研究,但是針對氧化鎂的儲熱機理、摻雜鹽中具體哪種原子對儲熱系統有何種程度的影響的研究仍較少,所以基于第一性原理對這方面的研究是很有必要的。在其他研究領域,已有一些基于第一性原理對某些微觀機理的研究。Ding等[17]對第一性原理在催化機理研究中和吸附過程中的應用進行了歸納總結,發現第一性原理在理論分析中有很大的優勢,在原位模型催化劑表面模擬計算中效率突出。然而現有研究仍較少涉及儲熱系統的微觀機理。Carrasco 等[18]用第一性原理和ab initio 分子動力學模擬的方法研究了堿土氧化物(如CaO、MgO、BaO)對低覆蓋水的吸附,結果表明,MgO(001)表面質子-羥基結構在單步形成和分離過程中存在較大的障礙,而CaO 和BaO(001)表面羥基可以圍繞固定的質子自由旋轉,使其具有更好的水解離特性。Wang 等[19]利用第一性原理方法研究了MgH2中與氫有關的固有缺陷和與F 或Cl 有關的雜質的結構特性和形成能,結果表明,在帶電荷狀態下,氫空位和間隙是有利的,而F和Cl雜質傾向于以中性狀態取代氫原子;F 和Cl 對中性和帶負電荷的H 原子的去除能量均無影響,但對帶正電荷的H 原子去除能量均有顯著影響。劉亮等[20]采用第一性原理計算研究了堿金屬和堿土金屬對CaO(100)理想表面和促進表面的吸附,結果表明,CO2傾向于吸附在O-top位點上,形成最穩定的構型,Na、K、Rb和Cs因其較高的電正性而被認為是九種金屬中合適的促進劑。申潔等[21]采用基于密度泛函理論的第一性原理贗勢平面波方法計算Eu 原子摻雜MgO 晶體的幾何結構、能帶結構、態密度和光學性質,計算結果表明摻雜稀土元素對體系的靜態介電常數、晶體反射率、光吸收系數、折射率和能量損失函數有重要調制作用。可發現,目前研究主要集中于反應物晶體缺陷、晶體構型等方面,對氧化鎂的熱力學性質和最穩定微觀吸附構型研究較少。
針對MgO/Mg(OH)2儲熱系統,本文根據已有的類似微觀研究,基于密度泛函理論的廣義梯度近似,對H2O 在MgO 表面的吸附進行了模擬計算,以此來探究氧化鎂的儲熱機理。此外,也就摻雜鹽對材料改性進行了深入的探索,探究摻雜鹽中的金屬原子在提升儲熱性能方面的影響。通過計算找到最符合實際的微觀吸附構型,在原子分子水平上深入認識了H2O 與MgO 的反應過程。在摻雜鹽性能影響研究中,本文針對最穩定構型進行Li、Na、K 三種金屬原子摻雜,研究了其活化能和熱力學性質,并進行了對比分析,從微觀層面探索金屬原子對儲熱的影響效果,這對后續儲熱系統研究及其開發應用有較好的參考價值。
1 計算方法和模型
1.1 計算方法
本文吸附和吸附構型計算均采用基于密度泛函理論的CASTEP(Cambridge Serial Total Energy Package)程序包進行第一性原理研究[22],摻雜計算采用Dmol3程序包,吸附計算中泛函和極化雙數值軌道基組采用廣義梯度近似(general gradient approximate,GGA)中的PBE 處理交換關聯能。平面波截斷能設置為489.8 eV,布里淵區K 點取樣為6×6×6。自洽場(SCF)收斂于2.0×10-5eV/atom,最大迭代次數500,多極展開到6 極,Density Mixing 方法中charge 和spin 分別為0.2 和0.5,DIIS 外推大小為6。熱力學性能計算中泛函和極化雙數值軌道基組采用局部密度近似(local density approximation,LDA)中的CA-PZE 處理交換關聯能。平面波截斷能設置為990.0 eV,K 點取樣為6×6×6,Pseudo-potentials 設置為Norm-conserving。
在模擬計算之前,需要對分子/晶體結構進行優化,使結構與實際分子/晶體結構相吻合,再進行模擬計算,這樣模擬的結果更符合實際,更具有指導性意義。首先采用這些計算參數對H2O及晶體MgO的結構參數進行優化測試計算,以確定平衡態原子的精確位置: H2O 的O—H 鍵長是0.976 nm,角度為104.727°,優化計算結果如圖1 所示。與文獻[23]中H2O 的O—H 鍵長0.971 nm、角度為104.5°實驗值相比,鍵長偏差為0.51%,角度偏差為0.22%;而MgO的晶格常數計算值為aMgO=4.21120 ?(1 ?=0.1 nm),與文獻[24-27]具有很好的一致性,圖2展示了本研究建立的氧化鎂模型的微觀計算參數與四篇文獻中的實驗數據對比結果,模型與實驗數據偏差較小,有很好的一致性。

圖1 優化后的水分子結構(白色為H,黑色為O)Fig.1 The optimized water substructure(white is H and black is O)
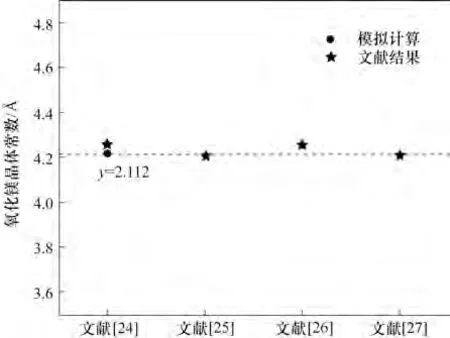
圖2 氧化鎂微觀參數計算模型的驗證Fig.2 Verification of the microscopic parameters of MgO model
1.2 計算模型
1.2.1 氧化鎂結構模型 氧化鎂是典型的立方晶系結構——NaCl 構型,空間點群為Fm-3m(No.225),一個氧化鎂單胞中包含4 個O 原子和4 個Mg 原子,分別占據Wyckoff 坐標(表示晶胞中等價原子的對稱性,包括多重度、位置的對稱性以及該位置的分數坐標)的4a 和4b 位置。圖3(a)為傳統的MgO 晶胞,顯示了晶格的立方對稱性。利用晶格的對稱性,使用只包含2 個原子的原胞[圖3(b)]來進行熱力學性質計算(而晶胞包含了8 個原子),得到的電荷密度、鍵長等與晶體直接計算結果一樣,但是計算量大大減小,計算時間被縮短。

圖3 MgO晶體結構(深色為O,淺色為Mg)Fig.3 Crystal structure of magnesium oxide(dark is O and light is Mg)
1.2.2 吸附模型 理想的氧化鎂表面沒有任何雜質和缺陷,但實際上很少見。實際中考慮最多的表面畸變是表面弛豫和表面重構。為了研究孤立水分子在氧化鎂表面的性質,本文采用表面層相對于理想表面原子晶格運動但表面原胞對稱性不改變的表面弛豫進行研究。首先,建立氧化鎂超晶胞結構:對建立的MgO 晶體結構進行幾何優化,基于Carrasco 等[18]的研究,整個計算過程主要在MgO 的(001)面進行,所以對(001)表面進行切割,如圖4 所示。所有表面的原子層數均為3 層,為保證原子層間不發生相互作用,z 方向周期性排列的slab 之間有1.5 nm 的真空區域,因為超晶胞的對稱性,本文以側視圖和俯視圖展示,相關結構如圖5 所示。隨后對采用周期性的三層結構(Mg12O12)的超晶胞模型進行全弛豫優化,以確定平衡態的原子精確位置。
圖4 氧化鎂立方晶體晶列指數[28]Fig.4 Index of cubic crystal of magnesium oxide[28]
活性組分在MgO 表面的吸附能Eads定義為吸附前后總能量的變化:
Eads= EM/slab-(EM+ Eslab) (2)
式中,EM/slab為活性組分在MgO 表面吸附后的能量;EM和Eslab分別為活性組分自由原子與表面的能量。
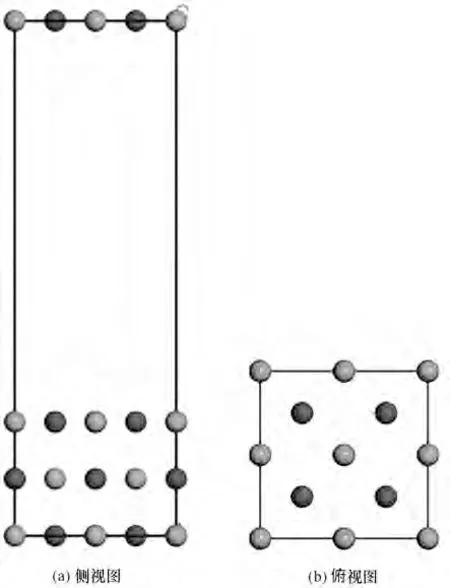
圖5 P(2×2)超晶胞3層平板模型(深色和淺色分別為鎂原子、氧原子)Fig.5 3-Layer supercrystal cell plate model(small dark spheres stand for Mg atoms,while light for O atoms)
根據該定義,吸附能為負值時表明活性組分的負載是放熱過程,吸附能越小,活性組分在氧化鎂表面的吸附作用越強烈,且吸附后體系更加穩定。Eads<0.62 eV(1 eV=96.4853 kJ/mol)時為化學吸附,反之為物理吸附[29]。
2 結果分析
2.1 分子與底物距離對吸附的影響
本研究采用P(2×2)超晶胞3 層平板模型,首先研究不同吸附距離對吸附反應的影響,圖6 為H2O在MgO(001)表面吸附示意圖,d 為分子距離底物(MgO)的距離,其取值分別為1.5、2.0、2.5、3.0 ?。
從表1可以看出,分子距離底物距離不同,吸附能也有所不同。其中距離為1.5 ? 時吸附能偏差最小,其次是距離為2.0 ?情況下,距離為3.0 ?的情況為吸附能偏差最大的距離。這是因為物理吸附和化學吸附共同作用。物理吸附是比較弱的吸附,吸附物和表面之間沒有形成真正的化學鍵,沒有電子共用,電子結構沒有發生大的變化,通常物理吸附分為距離較近的強排斥力和距離稍遠的相互吸引力;化學吸附是強吸附,吸附物和表面之間形成化學鍵有共用電子,它們的電子結構都有大的改變,涉及吸附分子和固體間的電子重排、化學鍵的斷裂或形成。H2O 在MgO(001)表面的吸附能大于0.62 eV,屬于化學吸附。
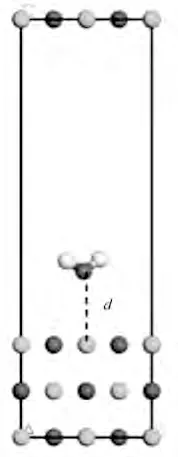
圖6 H2O在MgO(001)表面吸附(白色為氫原子)Fig.6 H2O adsorbed on the surface of MgO(001)(small white spheres stand for H atoms)
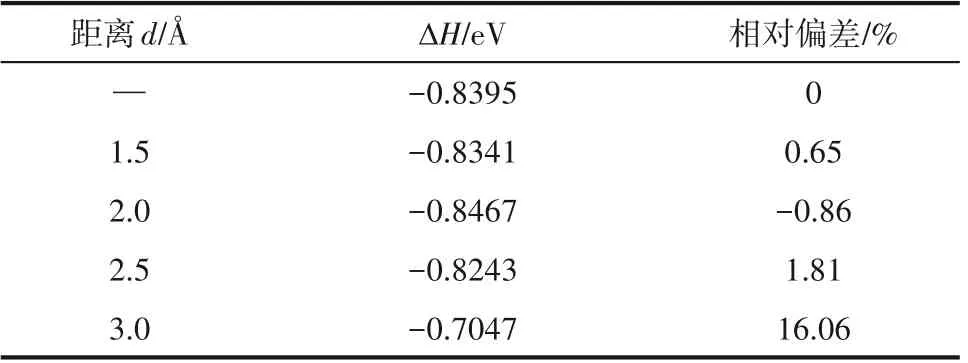
表1 不同吸附距離吸附能對比Table 1 Comparison of adsorption energy for different adsorption distances
費米能級兩側分別有兩個尖峰,尖峰之間的距離為贗能隙(pseudogap)[30],局部某個鍵處的贗能隙的寬度變化反映了此處鍵能的變化,贗能隙寬度增加意味著更強的化學鍵,反之,贗能隙變窄代表此處化學鍵更易斷裂。O 的電子結構是2s22p4[31],Mg的電子結構是2s22p63s2,從四種不同距離的吸附表面態密度圖(圖7)可知,在一定距離內,態密度的軌道峰位置和贗能隙寬度基本沒有變化,但當距離超過這個范圍,軌道峰開始向左移動,贗能隙變小,軌道峰的面積呈減小趨勢。其中,分子距離底物在0.3 nm 以內時,軌道峰幾乎沒有移動,-25~-5 eV 區間的軌道峰面積基本不變,而-5~15 eV 軌道峰面積略有所不同,但差別較小。距離底物大于0.3 nm時,軌道峰整體往左移動,-5~0 eV 區間和0~10 eV區間的軌道峰變高變窄,10~15 eV 對應的s 軌道峰幾乎消失不見。反應態密度的積分為電子數,從圖中的面積對比可以看出,位于最外層的p 軌道靠近費米能級的峰因為吸附距離變大面積變小,s 軌道也與此類似,說明距離拉遠到一定時,電子轉移受到距離限制而減少,即反應更難進行。
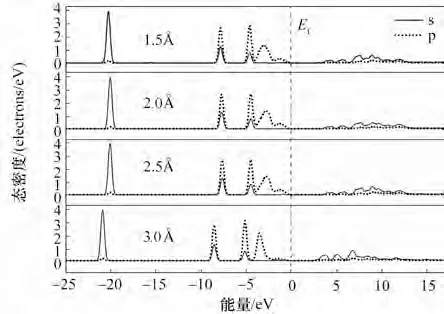
圖7 不同距離吸附的表面吸附態密度分布Fig.7 Density of state at different distances
2.2 不同吸附構型對吸附的影響
對H2O 在MgO(001)表面存在的4 種空間吸附構型(鎂頂位、氧頂位、二重橋位及四重洞位,如圖8所示)進行比較。根據前文計算的結果,H2O 與底物的初始距離均設為最理想的吸附距離,分別對4 種初始吸附構型進行優化,結果如表2所示。
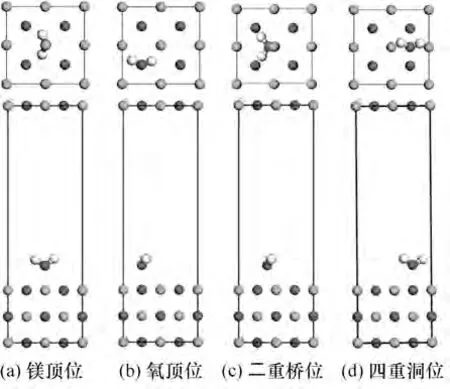
圖8 H2O在MgO(001)表面4種吸附位點Fig.8 Four adsorption configurations of H2O on MgO(001)surface
表2 給出了4 種吸附位點下吸附能(Eads),結果表明,四重洞位的吸附能最低,說明H2O在這個位點的吸附不夠穩定;而二重橋位和鎂頂位的吸附能較大,分別達到了-0.8265 eV 和-0.8341 eV,為化學吸附,而氧頂位和四重洞位的吸附能均小于0.62 eV,為物理吸附。四種吸附構型中,鎂頂位的吸附能最接近實驗值(-0.8395 eV)。從距離上來看,O-Mg 距離處于Ha-Mg和Hb-Mg距離之間,說明H2O 中的氫氧根傾向于向Mg 原子方向移動,與表面的Mg 原子相連接,而另一個氫原子與表面的氧原子結合形成氫氧鍵。Ha-O 和Hb-O 距離差別很小,說明水分子仍然處于比較對稱狀態。其中,對于O-Mg 距離最遠的為氧頂位,對于其他原子距離,也是氧頂位吸附位距離最遠,說明氧頂位更不利于原子結合,即不易于吸附;∠Ha-O-Hb 角度氧頂位最大,四重洞位角度最小,說明水分子角度發生扭轉,盡可能使氫原子貼近鎂原子,更有利于吸附,氧頂位扭轉最大,更貼近鎂原子,更易于吸附。

表2 H2O吸附于MgO(001)表面不同位點的穩定性比較Table 2 Comparison of the stability of the four adsorption configurations
圖9 為H2O 在MgO(001)表面在4 種構型下吸附后的結構圖,由圖可以發現,二重橋位和鎂頂位吸附前后與鎂原子的距離變化較小,而氧頂位和四重洞位的距離變化較大。原因是初始位置時,MgO 中的氧原子與H2O 中的氧原子之間發生互斥,H2O 與氧化鎂發生化學反應。吸附后穩定構型中的水分子都發生了扭轉,扭轉后水分子中的H 原子都轉向了晶體表面,因為在形成化學鍵過程中,水分子中的H原子會發生斷鍵,與晶體中的O原子結合,形成氫氧鍵。
圖10 是H2O 在Mg 頂位吸附在MgO(001)表面的穩定構型,達到平衡時,H2O 中的氧原子和氧化鎂中的鎂原子距離為0.2232 nm,達到平衡后H2O 中的∠Ha-O-Hb 角度發生扭轉,相比于初始構型,達到平衡后的∠Ha-O-Hb 轉變為103.501°,分子在水平方向與豎直方向均發生了54.154°的旋轉。

圖9 H2O在MgO(001)表面4種構型下吸附后結構Fig.9 The structure of H2O adsorbed on MgO(001)surface under four configurations

圖10 鎂頂位時吸附在MgO(001)表面的穩定構型Fig.10 The stable configuration of H2O adsorbed on the surface of MgO(001)at Mg-top
通過電荷布居分析可以定量討論電荷的轉移情況,本研究對以上4 種吸附結構的水分子中O 和H 原子的電荷布居進行分析,結果如表3 所示,表中數據表明,H2O 在MgO(001)表面的吸附是典型的化學吸附。在吸附成鍵過程中,O 原子獲得電子表現為非金屬性,Mg原子失去電子表現為金屬性。不同吸附位置O 和H 原子間的得失電子情況不同,鎂頂位、氧頂位、四重洞位和二重橋位O原子得到電子數分別為0.88、0.97、0.95、0.88,這部分電子是由Mg 原子轉移出來的,說明Mg 原子在相對穩定的鎂頂位和二重橋位處失去電子的能力較強,失去的電子數最多[14]。由此可知,與吸附在氧頂位和四重洞位相比,水分子在MgO(001)晶面的鎂頂位和二重橋位時,存在更強的化學鍵,分子與表面的作用力更強,形成的吸附結構也更穩定。
圖11為四種吸附構型優化后的電子密度圖,其中顏色深淺代表電荷密度的大小。從圖中可以看出,鎂頂位和二重橋位存在電子云重疊,氧頂位和四重洞位沒有電子云重疊,說明鎂頂位和二重橋位水分子和氧化鎂晶體之間作用力較大,形成了化學鍵,而氧頂位和四重洞位作用力較小,未形成化學鍵,這與表2 的吸附能判斷化學吸附/物理吸附結果相符合。此外,鎂頂位的電子密度圖水分子與晶體的鎂和氧均有較大重合區域,而二重橋位重合區域較小,說明鎂頂位發生了大量電子轉移,水分子的H 原子和氧化鎂中的O 原子結合成為—OH,另一部分的—OH 和氧化鎂中的Mg原子連接成鍵,鎂頂位比二重橋位更利于電子轉移,也就是說更容易形成穩定化合物,即對反應更有利,與表2、表3的結果吻合。
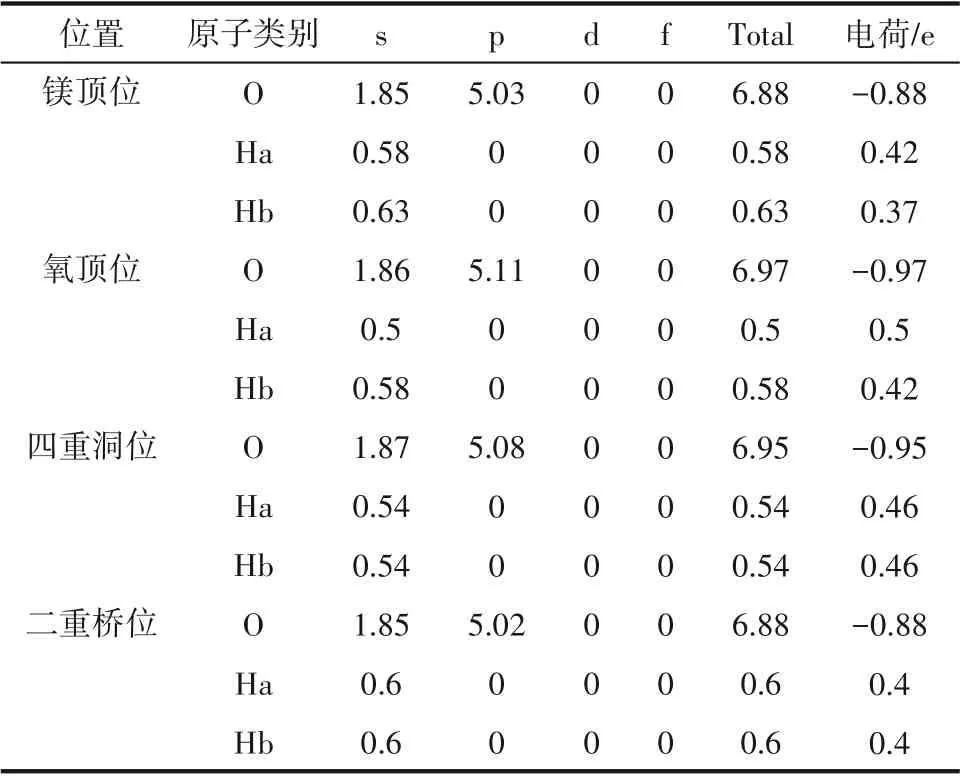
表3 不同吸附位置O原子與H原子的電荷布居數Table 3 The charge population of O and H atoms at different adsorption positions

圖11 四種吸附構型優化后的電子密度圖Fig.11 Electron density map of four adsorption configurations after optimization
2.3 氧化鎂熱力學性能分析
為分析溫度對氧化鎂反應難易程度的影響,本研究對氧化鎂的能量和溫度進行模擬計算,結果如圖12 所示。其中曲線①表示溫度(T)與熵(S)的乘積與溫度之間的關系。熵是體系混亂程度的量度。由圖可知,TS 隨溫度升高而增大,增大趨勢也在增加,即曲線斜率隨溫度升高而增大。原因是溫度升高,氧化鎂晶體內的原子熱運動加劇,熵增,溫度上升越快,運動越劇烈。曲線②為焓(H)與溫度(T)之間的關系。焓是熱力學中表征物質系統能量的一個重要狀態參量,等于內能(U)與壓強和體積的乘積之和。溫度升高,焓值增大,曲線斜率隨溫度升高而緩慢增大,原因是溫度升高,氧化鎂晶體內原子動能加大,內能增大,且系統發生熱膨脹現象,壓強和體積的乘積增大,故而焓值增大。曲線③為Gibbs 自由能(G),等于焓與溫度與熵乘積的差值,即曲線②與曲線①的差值。可以利用Gibbs 自由能值判斷反應發生的自發性,還可以求熱力學平衡常數,以判斷采用升溫還是降溫的方法促進反應進行[32]。等溫、等壓的封閉體系內,不做非體積功的前提下,任何自發反應總是朝著G 減小的方向進行。當溫度升高時,焓升高,熵也增加,熵與溫度的乘積升值遠遠大于焓的升值,溫度越高,其差距越大,自由能的值越低,且恒不大于0,說明能夠反應的趨勢隨溫度升高而增大[33],這對尋找適宜儲熱溫度有很好的指導意義。
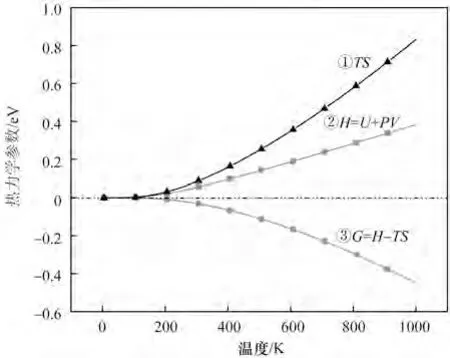
圖12 熱力學參數隨溫度變化的規律Fig.12 The variations of thermodynamic parameters with temperature
德拜溫度是反應分子結合力的一個重要的指標,彈性、硬度、熔點和比熱容等多個物理量都與之相關。對于比熱容,當溫度高于德拜溫度時,固體的比熱容符合Dulong-Petit 定律,Cv=3R(Cv為比定容熱容);溫度低于德拜溫度時,比熱容遵循量子規律,比熱容與溫度的三次方呈正比。物質的熔點越高,其原子結合力越強,德拜溫度越高。

圖13 德拜溫度隨溫度變化規律Fig.13 The variation of Debye temperature with temperature
圖13中,在0~15 K,隨著溫度升高,德拜溫度由0 急劇升高到975.2 K;在15~95.45 K,德拜溫度由975.2 K 降低至796.7 K;在95.45 K 往后,隨著溫度升高,德拜溫度幾乎趨于穩定,不再變化。可根據其計算出比熱容。
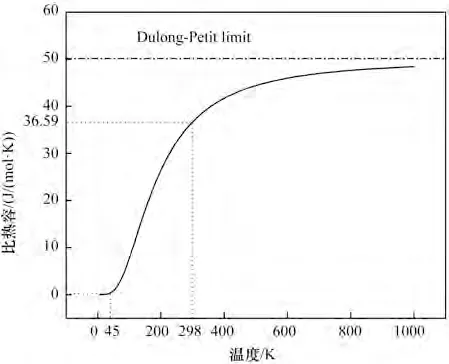
圖14 MgO比熱容隨溫度變化的規律Fig.14 The variation of heat capacity of MgO with temperature
圖14展示了熱容量與溫度之間的關系,在極低溫度時(0~45 K),比熱容接近0;溫度在45~764 K時,比熱容隨著溫度升高而遞增,曲線的斜率由大變小,漸漸呈現飽和趨勢,最終在900 K 左右趨近于常數。由圖13可知,溫度在764 K時,此時溫度低于德拜溫度,比熱容遵循德拜T3定律,與熱力學溫度的三次方呈正比,這是因為溫度較低時,固體的熱容量是由晶格熱振動和電子熱運動共同作用,熱容量增長較快;而溫度較高時,比熱容趨于穩定,這是由于受非諧效應的影響,從而導致比熱容幾乎接近Dulong-Petit 值,這部分主要是由晶格熱振動決定。在常溫下得到的比熱容值為36.59 J/(mol·K),這個值和逯來玉[27]得到的36.53 J/(mol·K)相一致。

圖15 有/無摻雜過渡態能量對比Fig.15 Reaction energy profiles with/without doping
2.4 摻雜對吸附的影響
過渡態是反應過程中舊鍵斷裂、新鍵形成的中間狀態,其能量處于最高狀態,此時能量與反應物的能量差(ΔE)為活化能,活化能越小,即過渡態越低,反應越容易進行。本研究對Li、Na、K 三種原子摻雜于氧化鎂晶體進行過渡態對比,如圖15 所示,圖中超晶胞表層灰色原子(位于超晶胞表層邊緣中心的兩個原子,其相互軸對稱,實際占據超晶胞中鎂原子的1/12)為摻雜原子所在位置,計算結果發現,Li、Na、K 三種原子對反應的過渡態有降低作用。過渡態只能通過基元反應獲得,從微觀角度來看,過渡態的降低代表著儲熱條件的降低,在溫度一定時,儲熱速度可以由過渡態的變化進行推測。在摻雜Li、Na、K 三種原子后,過渡態分別降低了0.1952、0.1104、0.0160 eV,能量勢壘明顯降低,也就是說反應更容易實現,反應可以在更低的溫度下實現,且摻雜的金屬對應的原子活潑性越高,過渡態降低幅度越大,越有利于反應的進行。
針對摻雜的不同原子的熱力學性能進行了研究,如圖16 所示,由圖可知,摻雜以后熵增,K 對熵增的影響最大,Li 和Na 影響程度接近[圖16(a)];摻雜能增加氧化鎂的比熱容值,Li 和K 對比熱容影響較大,且二者接近,Na 對氧化鎂的熱容影響稍遜之[圖16(b)];摻雜能降低反應的自由能,其中摻雜Li和K 的降低程度更大,Na 次之,表明摻雜更有利于反應的進行,這和圖15中的結果相一致[圖16(c)];摻雜對反應的焓值影響較小,即對儲能密度影響較小[圖16(d)]。綜合來看,摻雜K 對儲熱促進效果最好,其次是Li,Na 最差。這是因為摻雜金屬原子對晶體結構的對稱性造成了破壞,使得化學鍵更容易斷裂,反應更容易進行,新的物質更容易生成。
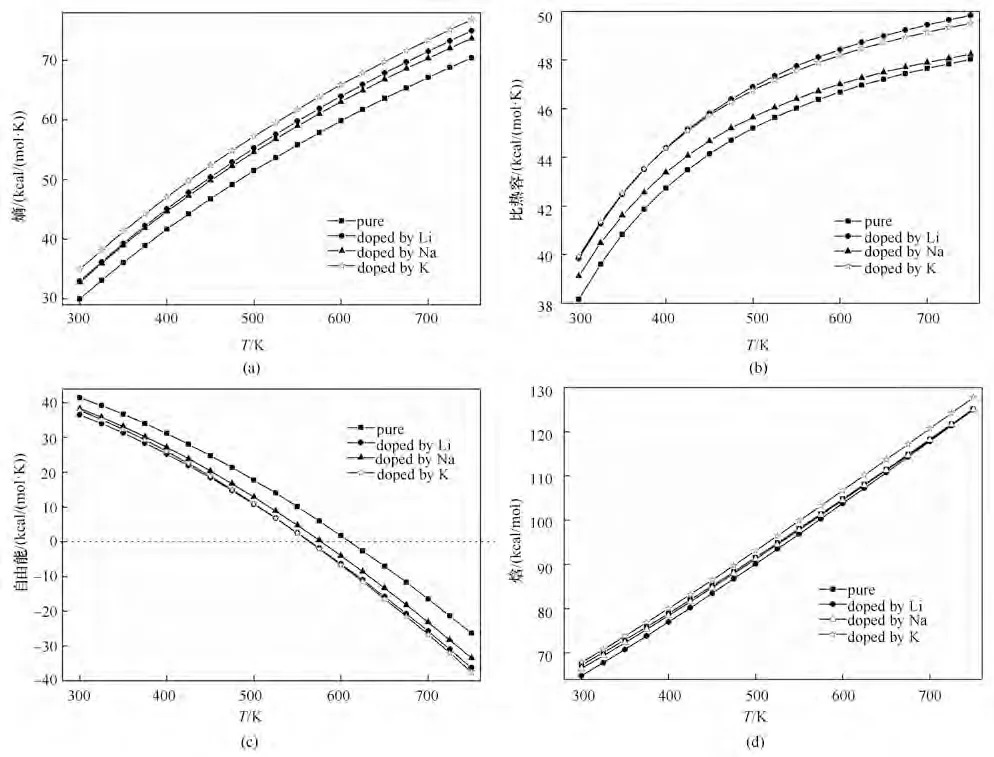
圖16 摻雜不同種原子熱力學性能對比(1 cal=4.1868 J)Fig.16 Comparison of thermodynamic properties of different doping atoms
3 結 論
本文在微觀機理層面建立了相應儲熱材料的分子晶體結構模型,采用第一性原理密度泛函理論,分析了不同吸附距離和吸附構型對吸附穩定性的影響,從微觀方面模擬摻雜了Li、Na、K 三種金屬原子,研究了其對儲熱的影響,主要結論如下。
(1)研究了水分子和底物氧化鎂不同距離對吸附能的影響,發現在物理吸附和化學吸附共同作用下水和氧化鎂的最佳吸附距離為0.15 nm。
(2)分別從吸附能、原子間距離變化、鍵長變化、電子密度云等方面對氧化鎂、水系統四種不同吸附構型進行對比分析。結果表明,氧頂位和四重洞位的構型中存在原子互斥,對成鍵不利,導致吸附能較小;二重橋位構型有利于新鍵生成,吸附效果較好;Mg頂位具有高對稱性,有利于電子轉移,吸附性能最好,最符合實際情況。
(3)對于氧化鎂和水的反應,分別摻雜Li、Na、K三種金屬原子進行研究,發現摻雜金屬原子對晶體結構的對稱性造成了破壞,使得化學鍵更容易斷裂,反應更容易進行,新的物質更容易生成,所以摻雜后熵、比熱容都發生了不同程度的增大,且均能一定程度地降低反應的自由能,反應更容易進行,這與已有研究的實驗結果吻合較好。
本文對探索基于元素摻雜的熱化學儲熱材料改性方法、揭示相關熱化學儲熱微觀系統的反應機理有很好的指導意義。

