復(fù)智散對(duì)阿爾茨海默病轉(zhuǎn)基因鼠腦神經(jīng)細(xì)胞內(nèi)神經(jīng)顆粒素通路的影響
宋冬晶 劉 斌 劉新宇 王 曄 王德生 紀(jì) 勇
(哈爾濱市第二醫(yī)院,黑龍江 哈爾濱 150001)
神經(jīng)顆粒素(Ng)是特異性神經(jīng)元突觸后膜蛋白,是神經(jīng)可塑性及學(xué)習(xí)記憶調(diào)控過(guò)程中的一個(gè)重要蛋白,其基因表達(dá)和蛋白質(zhì)合成主要分布于海馬、前額皮層、紋狀體和杏仁核〔1〕。作為突觸后蛋白激酶(PK)C的作用底物和Ca2+敏感性鈣調(diào)蛋白(CaM)結(jié)合蛋白,Ng主要通過(guò)調(diào)控Ca2+和CaM依賴性酶包括Ca2+- CaM依賴性蛋白激酶(CaMK)Ⅱ等,參與學(xué)習(xí)記憶過(guò)程〔2~6〕。本文通過(guò)觀察復(fù)智散對(duì)轉(zhuǎn)基因阿爾茨海默病(AD)小鼠腦神經(jīng)細(xì)胞內(nèi)Ng通路的影響,探討復(fù)智散治療AD的作用機(jī)制。
1 材料與方法
1.1動(dòng)物及分組 6月齡APP/PS1 雙重轉(zhuǎn)基因小鼠,購(gòu)自南京大學(xué)模式動(dòng)物研究所。正常對(duì)照組為15只相同遺傳背景同月齡的C57BL/6J小鼠。實(shí)驗(yàn)隨機(jī)分為對(duì)照組(蒸餾水23 ml/d)、模型組(蒸餾水23 ml/d)、低劑量組(1.25 g/kg)、中劑量組(2.5 g/kg)、高劑量組(5.0 g/kg)、安理申組(0.54 mg·kg-1·d-1),各組15只。連續(xù)灌胃21 d。
1.2藥物 復(fù)智散(FZS),哈醫(yī)大一院王德生教授研發(fā),由人參、節(jié)菖、蒲黃芩等八味中草藥組方而成。水浸泡40 min,煎煮1 h,過(guò)濾出藥汁。加水煎煮40 min后再次過(guò)濾,將兩次濾過(guò)的藥汁混合,配制成FZS濃度為0.25 g生藥/ml的提取液,于4℃保存。安理申(鹽酸多奈哌齊),5 mg/片,購(gòu)自衛(wèi)材藥業(yè)。
1.3Western印跡檢測(cè)蛋白表達(dá)量 腦組織剪至約150 mg,加300 μl蛋白質(zhì)抽提液,勻漿。最高速度漩渦振蕩5 s。12 000 r/min,4℃離心5 min。迅速把上清液轉(zhuǎn)移至另外一個(gè)預(yù)冷的離心管,-20℃保存。加樣到96孔板,標(biāo)準(zhǔn)品稀釋液調(diào)整最終量到20 μl;A570 nm波長(zhǎng)下檢測(cè)OD配平各組蛋白;1∶4的比例加入SDS-PAGE5倍上樣緩沖液,水煮,直至蛋白質(zhì)變性電泳分析。曝光顯影。
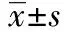
2 結(jié) 果
2.1行為學(xué)實(shí)驗(yàn)結(jié)果 模型組潛伏期明顯長(zhǎng)于對(duì)照組(P<0.01);各用藥組潛伏期均有不同程度改善,中劑量組和安理申組的潛伏期明顯短于模型組(P<0.01),中劑量組與安理申組比較無(wú)顯著性差異(P>0.05)。模型組小鼠電擊時(shí)間明顯長(zhǎng)于對(duì)照組(P<0.01);各用藥組的電擊時(shí)間均短于模型組,其中中劑量組、安理申組最明顯(P<0.01),而中劑量組與安理申組電擊時(shí)間比較無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。見(jiàn)表1。

表1 各組小鼠行為學(xué)實(shí)驗(yàn)結(jié)果比較
2.2小鼠海馬Ng信號(hào)通路表達(dá)水平變化 模型組鼠Ng蛋白表達(dá)量較對(duì)照組顯著降低(P<0.01)。與模型組比較,安理申組、高劑量組、中劑量組、低劑量組Ng 蛋白均有不同程度增高,其中安理申組、中劑量組變化最明顯,與模型組相比差異有統(tǒng)計(jì)學(xué)意義(P<0.05 或P<0.01),中劑量組優(yōu)于安理申組。
對(duì)照組Aβ、APP、BACE 和PS-1蛋白表達(dá)量較低;模型組轉(zhuǎn)基因小鼠腦細(xì)胞內(nèi)APP蛋白表達(dá)量較對(duì)照組APP蛋白表達(dá)量明顯增多,其中Aβ、BACE 和PS-1蛋白表達(dá)增加更顯著(P<0.05或P<0.01)。與模型組比較,安理申組、高劑量組、中劑量組、低劑量組APP的蛋白表達(dá)量均有不同程度降低,其中安理申組、中劑量組變化最明顯(P<0.05或P<0.01)。APP、BACE和PS-1蛋白表達(dá)量安理申組與中劑量組無(wú)顯著差異。復(fù)智散中劑量組Aβ蛋白表達(dá)明顯低于安理申組(P<0.05)。
3 討 論
生理狀態(tài)下,Ng與CaM結(jié)合形成復(fù)合體,當(dāng)神經(jīng)沖動(dòng)引起NMDAR活化,與受體偶聯(lián)的Ca2+通道開(kāi)放,細(xì)胞內(nèi)Ca2+濃度升高,Ng與CaM復(fù)合體解離,游離Ng被PKC磷酸化,與CaM親和力降低,細(xì)胞內(nèi)Ca2+與CaM復(fù)合體濃度增加,激活Ca2+和CaM依賴性酶,如CaM依賴性NO合酶、CaMKⅡ及CaM依賴性腺苷酸環(huán)化酶AC1、AC8等,這些酶均參與LTP的誘導(dǎo)和維持,因此Ng是調(diào)控學(xué)習(xí)和記憶過(guò)程的重要蛋白。進(jìn)一步研究發(fā)現(xiàn),Ng基因敲除的小鼠海馬LTP明顯受損,空間學(xué)習(xí)能力受損,提示了Ng在學(xué)習(xí)記憶過(guò)程中的重要作用〔7~9〕。
實(shí)驗(yàn)證實(shí),Ng主要是通過(guò)促進(jìn)依賴于Ca2+的信號(hào)轉(zhuǎn)導(dǎo)途徑提高海馬LTP和學(xué)習(xí)記憶能力〔10〕,即神經(jīng)元內(nèi)Ng濃度越高,Ng-CaM復(fù)合體的形成越多,Ng可被視為神經(jīng)元內(nèi)CaM的儲(chǔ)庫(kù)。因而當(dāng)Ca2+流入細(xì)胞內(nèi),將有更多的CaM與Ca2+結(jié)合,有利于激活Ca2+與Ca2+-CaM依賴的信號(hào)級(jí)聯(lián)反應(yīng),包括PKC、CaMKⅡ。最近,有研究進(jìn)一步證實(shí)Ng作為記憶形成機(jī)制的上游調(diào)控子,通過(guò)調(diào)控游離的Ca2+和CaM,在PKC介導(dǎo)的信號(hào)轉(zhuǎn)導(dǎo)途徑中起關(guān)鍵作用。
模型組鼠海馬NMDAR的關(guān)鍵亞基NR1表達(dá)水平降低,這可能是認(rèn)知功能下降的原因之一。AD鼠海馬和前額皮層Ng蛋白表達(dá)水平下降。同時(shí),Ng信號(hào)轉(zhuǎn)導(dǎo)途徑中的兩個(gè)關(guān)鍵酶PKC和CaMK水平也明顯下降。提示AD可能通過(guò)影響中樞重要腦區(qū)中以Ng為上游調(diào)控子的信號(hào)轉(zhuǎn)導(dǎo)通路損害機(jī)體的學(xué)習(xí)記憶功能;FZS可通過(guò)提高Ng通路蛋白表達(dá)而改善AD鼠的認(rèn)知功能。
4 參考文獻(xiàn)
1謝 蕾,王志萍,曾因明. 神經(jīng)顆粒素與學(xué)習(xí)記憶關(guān)系的研究進(jìn)展〔J〕.當(dāng)代醫(yī)學(xué)(學(xué)術(shù)版),2008;(3):120-2.
2Watson JB, Sutcliffe JG, Fisher RS. Localization of the protein kinase C phosphorylation/ calmodulin-binding substrate RC3 in dendritic spines of neostriatal neurons〔J〕. Proc Nat Acad Sci U S A, 1992;89(18):8581-5.
3Houben MP, Lankhorst AJ, van Dalen JJ,etal. Pre- and postsynaptic localization of RC3/neurogranin in the adult rat spinal cord: an immunohistochemical study〔J〕.J Neurosci Res,2000;59(6):750-9.
4Pak JH, Huang FL, Li J,etal. Involvement of neurogranin in the modulation of calcium/ calmodulin-dependent protein kinase Ⅱ, synaptic plasticity, and spatial learning: a study with knockout mice〔J〕. Proc Nat Acad Sci U S A,2000;97(21):11232-7.
5Miyakawa T, Yared E, Pak JH,etal. Neurogranin null mutant mice display performance deficits on spatial learning tasks with anxiety related components〔J〕. Hippocampus,2001;11(6):763-75.
6Wu J, Li J, Huang KP,etal. Attenuation of protein kinase C and cAMP- dependent protein kinase signal transduction in the neurogranin knockout mouse〔J〕. J Biol Chem,2002;277(22):19498-505.
7Ressler KJ, Paschall G, Zhou XL,etal. Regulation of synaptic plasticity genes during consolidation of fear conditioning〔J〕. J Neurosci,2002;22(18):7892-902.
8van Dam EJ, Ruiter B, Kamal A,etal. N-methyl-D-aspar-tate-induced long-term depression is associated with a decrease in postsy-naptic protein kinase C substrate phosphorylation in rat hippocampalslices〔J〕. Neurosci Lett,2002;(3):129-32.
9Krucker T, Siggins GR, McNamara RK,etal. Targeted disruption of RC3 reveals a calmodulin-based mechanism for regulating meta-plasticity in the hippocampus〔J〕. J Neurosci,2002;22(13):5525-35.
10Gerendasy DD, Sutcliffe JG. RC3/ neurogranin, a postsynaptic calpacitin for setting the response threshold to calcium influxes〔J〕. Mol Neurobiol;1997(15):131-63.

