PKA-PINK1/Parkin信號通路在氧糖剝奪/復氧復糖后大鼠皮質星形膠質細胞凋亡和焦亡中的作用
于 紅,馬美娜,周真真,郭慶奪,于紅美
(河北省滄州市中心醫院麻醉科,河北 滄州 061000)
中樞神經系統主要由神經元、星形膠質細胞核小膠質細胞等構成,而星形膠質細胞在維持神經元代謝及谷氨酸平衡中扮演著重要角色,一旦缺血再灌注損傷發生后,由于能量代謝及氧供需失衡,可誘發星形膠質細胞和神經元的死亡[1-3]。蛋白激酶A(protein kinase A,PKA)在調控星形膠質細胞線粒體氧化應激中發揮著重要作用,抑制PKA過度激活能夠減輕氧化應激造成的細胞凋亡和焦亡[4]。既往研究表明,PTEN誘導性激酶蛋白1(PTEN induced putative kinase 1,PINK1) E3泛素連接酶(E3 ubiquitin ligases,Parkin)途徑是特異性調控線粒體自噬的信號通路[5-6],抑制PKA表達上調可減少PINK1募集細胞質內的Parkin,減輕線粒體過度損傷和自噬[7]。本研究擬通過建立體外大鼠原代星形膠質細胞氧糖剝奪-復糖復氧模型,以揭示PKA-PINK1/Parkin信號通路在神經系統缺血再灌注損傷中發揮的作用。
1 材料與方法
1.1實驗動物及分組 24 h內的SD新生大鼠,共168只,北京維通利華實驗動物技術有限公司負責提供(SYXK(京)2012-0036)。分離腦組織后,行原代大鼠皮質星形膠質細胞培養,并將所分離培養的原代大鼠星形膠質細胞分為4組,每組42只,分別為對照組(C組)、氧糖剝奪組(oxygen-glucose deprivation,OGD/R組),H89+氧糖剝奪(H89+OGD/R, HO組),H89對照組(H組)。其中,凋亡率、焦亡率、生存率、鈣離子濃度測定、ROS測定、PKA測定、蛋白免疫印跡實驗(Parkin和Pink1表達測定)各需要6只大鼠。
1.2原代大鼠皮質星形膠質細胞培養 出生24 h內的SD大鼠,在無菌平衡鹽溶液(D-Hank液)中將大鼠的腦皮質充分剝離,并將皮質剪碎后放置在15 mL的無菌離心管內,取與細胞容積等量的胰酶(0.125%,HyClone,美國)加入離心管內,使其終濃度為0.062 5%,5% CO2培養箱內消化10 min,并在消化至5 min時輕搖1次。消化結束后,向離心管內加入等容量接種液(DMEM-F12,20%FBS,10%HS)(Hyelone公司,美國),以終止消化反應。1 000×g離心5 min后棄去上清液,再次向離心管內加入2~3 mL接種液,吸管吹打2~3下后200目濾網過濾,細胞懸液收集至新的無菌離心管內,倒置顯微鏡(Olympus公司,日本)下用計算原代細胞密度,并使用接種液將細胞密度調至1×105/mL。37 ℃、CO2濃度為5%的培養箱內進行原代細胞培養,2~3 d半量換液1次,待培養至第7天時,FBS濃度降低至10%。培養至第21天的原代大鼠皮質星形膠質細胞通過星形膠質細胞特異表達蛋白GFAP免疫熒光染色,進行星形膠質細胞鑒定,其陽性表達率超過95%可繼續用于實驗。
1.3氧糖剝奪模型的建立 實施氧糖剝奪處理前1 h,向HO和H組培養基內加入PKA特異性抑制劑H89(10 μmol/L,批號:L1643,Merck公司,德國)。OGD/R和HO組細胞氧糖剝奪的實施方法為PBS洗滌原代大鼠星形膠質細胞3次后,更換為無糖培養基BBS(HyClone,美國),先向無糖培養基中持續以2 L/min的速度通入100% N230 min,再將培養基放入低氧培養箱(Thermo,美國)內。向低氧培養箱中持續輸入95% N2和5% CO2,處理6 h后,將培養基的培養液更換為含有10%FBS的接種液的正常培養基。OGD/R組和HO組培養基在正常的培養環境中繼續培養24 h,C組和H組使用PBS洗滌細胞3次,置于含有5% CO2的正常培養箱中培養。
1.4凋亡率、焦亡率和存活率的測定 每組各取6孔,分別采用Annexin V-FITC/PI和cleaved caspase-1/PI雙染色法測定皮質星形膠質細胞凋亡和焦亡程度。每孔加入0.125%胰酶2 mL消化并中和后,4 ℃下150×g離心10 min,棄上清重懸細胞并計數,調整細胞濃度至1.5×105個/mL,將收集的細胞重懸于 200 μL 緩沖液中;加入 5 μL Annexin V-FITC或cleaved caspase-1試劑(碧云天生物制劑有限公司,中國),避光室溫孵育15~20 min; 加入10 μL PI(50 mg/L),補加緩沖液 200 μL,采用FACS420型流式細胞儀(Becton Dickinson公司,美國)檢測,Annexin V-FITC(+)/PI(-)占總細胞的百分比即為星形膠質細胞凋亡率,cleaved caspase-1 (+)/PI(+)占總細胞的百分比即為星形膠質細胞焦亡率。四甲基偶氮唑法(methyl thiazolyl tetrazolium,MTT)法用于測定星形膠質細胞的存活率。向每孔培養基內加入MTT溶液(濃度為5 g/L,碧云天生物制劑有限公司,中國)20 μL,5% CO2的正常培養箱中培養繼續孵育4 h。將培養基棄去,向每孔細胞加入150 μL DMSO溶液,充分震蕩10 min后,在490 nm波長處使用酶標儀測定各孔的吸光度(A值),以同批次C組作為對比,計算星形膠質細胞存活率[8]。
1.5游離鈣離子濃度的測定 每組取6孔,棄去上清培養液后,使用無鈣PBS(pH=7.0)洗滌2次,向每孔細胞內加入10 μmol/L Fluo-3/AM(Biotium公司,美國) 200 μL,5% CO2的37 ℃正常培養箱中孵育30 min后取出,使用DMEM培養基漂洗3遍。FV300激光共聚焦顯微鏡(Olympus公司,日本)下觀察熒光強度,激發波長485 nm,檢測波長520 nm,采集圖像,采用LSM510 25 SP2軟件(Zeiss公司,德國)進行分析,以熒光指數反應[Ca2+]i。
1.6ROS水平的測定 每組取6孔,二氯熒光黃雙乙酸鹽(2′, 7′-dichlorodihydrofluorescein diacetate,DCFH-DA)法測定ROS含量。同上述凋亡率和焦亡率測定方法,向收集的細胞內加入終濃度為10 μmol/L DCFH-DA(Sigma公司,美國)溶液,充分振蕩混勻后,37 ℃的5% CO2正常細胞培養箱內避光孵育20 min,每隔5 min吹打數次,孵育結束后在4 ℃下150×g離心5 min,D-Hanks平衡液重懸細胞,FACS420型流式細胞儀在488 nm激發波長、525 nm發射波長下測定熒光強度值,反映ROS含量。
1.7PKA活性檢測 每組取6孔,采用酶聯免疫吸附法(enzyme-linked immunosorbent assay,ELISA)檢測星形膠質細胞質內PKA活性。大鼠原代星形膠質細胞經0.125%胰酶消化10 min后,終止反應,細胞質提取試劑盒(Thermo公司,美國)提取星形膠質細胞的細胞質蛋白。按照每1 mL細胞懸液加入1 mL CER Ⅰ(含有其中1 mmol/L蛋白酶抑制劑)試劑,在研磨器中研磨10次,振蕩15 s,靜置1 min后加入CER Ⅱ試劑,振蕩5 s,靜置1 min后,4 ℃下16 000×g離心5 min,取上清液行二喹啉甲酸(bicinchoninic acid,BCA)法測定樣品濃度。PKA活性檢測依據試劑盒說明書操作(Genmed公司,美國),在96孔酶標板上做好相應標記:標準樣品和待測樣品,分別加入50 μL Genmed底物液、已準備好的標準液和待測樣品、50 μL Genmed反應液,室溫下孵育20 min,加入50 μL Genmed酶解液室溫下孵育30 min,加入50 μL Genmed終止液,以空白對照孔為零,450 nm波長測定吸光度值,根據標準品吸光度值繪制標準曲線,并計算樣品PKA活性。
1.8蛋白免疫印記檢測 每組取6孔,使用細胞裂解液(radio-immunoprecipitation assay,RIPA)(索萊寶有限公司,中國)將細胞裂解,超聲擊碎細胞,BCA法測定細胞內總蛋白濃度。在100 ℃下孵育5 min使蛋白變性,加入loading buffer后,每孔30 μg蛋白樣品,8%十二烷基硫酸鈉-聚丙烯酰胺凝膠(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)中電壓恒定進行電泳,電流恒定濕轉至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),5%脫脂奶粉室溫封閉1 h后,TBST洗膜,加入兔抗鼠PINK1(1∶500,批號:ab216144,abcam公司,英國)和Parkin(1∶500,ab233434,Abcam,英國)多克隆抗體37 ℃ 1 h孵育,TBST洗膜3次,每次10 min,山羊抗兔二抗(1∶1 000,武漢博士的生物制劑有限公司,中國)25 ℃ 1 h孵育,TBST洗膜3次,每次10 min,ECL發光,以GADPH作為內參照[9],以目的條帶和內參條帶灰度值的比值反映表達水平。
1.9統計學方法 應用SPSS 11.5統計軟件處理數據。計量資料采用單因素方差分析和SNK-q檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1凋亡率和焦亡率實驗結果 與C組比較,OGD/R組和HO組皮質星形膠質細胞的凋亡率升高,焦亡率升高,差異有統計學意義(P<0.05);與OGD/R組比較,HO組皮質星形膠質細胞的凋亡率下降,焦亡率下降,差異有統計學意義(P<0.05);C組與H組凋亡率和焦亡率差異無統計學意義(P>0.05)。見表1。
2.2存活率實驗結果 與C組比較,OGD/R組和HO組皮質星形膠質細胞的存活率下降,差異有統計學意義(P<0.05);與OGD/R組比較,HO組皮質星形膠質細胞的存活率升高,差異有統計學意義(P<0.05);C組與H組存活率差異無統計學意義(P>0.05)。見表1。
2.3細胞內游離鈣離子濃度實驗結果 與C組比較,OGD/R組和HO組皮質星形膠質細胞的細胞內游離鈣離子升高,差異有統計學意義(P<0.05);與OGD/R組比較,HO組皮質星形膠質細胞的細胞內游離鈣離子下降,差異有統計學意義(P<0.05);C組與H組細胞內游離鈣離子濃度差異無統計學意義(P>0.05)。見表1和圖1。
2.4ROS含量實驗結果 與C組比較,OGD/R組和HO組皮質星形膠質細胞的ROS含量升高,差異有統計學意義(P<0.05);與OGD/R組比較,HO組皮質星形膠質細胞的ROS含量下降,差異有統計學意義(P<0.05);C組與H組ROS含量差異無統計學意義(P>0.05)。見表1。
2.5PKA活性實驗結果 與C組比較,OGD/R組和HO組皮質星形膠質細胞的PKA活性升高,差異有統計學意義(P<0.05);與OGD/R組比較,HO組皮質星形膠質細胞的PKA活性下降,差異有統計學意義(P<0.05);C組與H組PKA活性差異無統計學意義(P>0.05)。見表1。
2.6Western blot實驗結果 與C組比較,OGD/R組和HO組皮質星形膠質細胞的PINK1和Parkin表達升高,差異有統計學意義(P<0.05);與OGD/R組比較,HO組皮質星形膠質細胞的PINK1和Parkin表達下降,差異有統計學意義(P<0.05);C組與H組的PINK1和Parkin表達差異無統計學意義(P>0.05)。見表1和圖2。
表1 4組大鼠星形膠質細胞凋亡率、焦亡率、存活率、Fluo-3/AM熒光指數、ROS、PKA活性、PINK1和Parkin表達的比較Table 1 Comparison of apoptosis,pyroptosis,viability,Fluo-3/AM fluorescence index,ROS,PKA activity,and expressions of PINK1 and Parkin in cultured rat astrocyte in the four groups
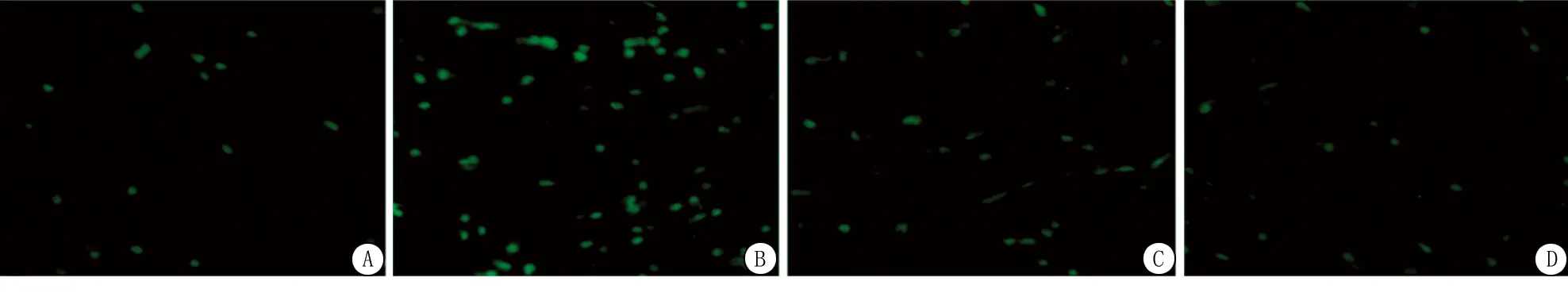
圖1 4組大鼠星形膠質細胞鈣離子熒光染色
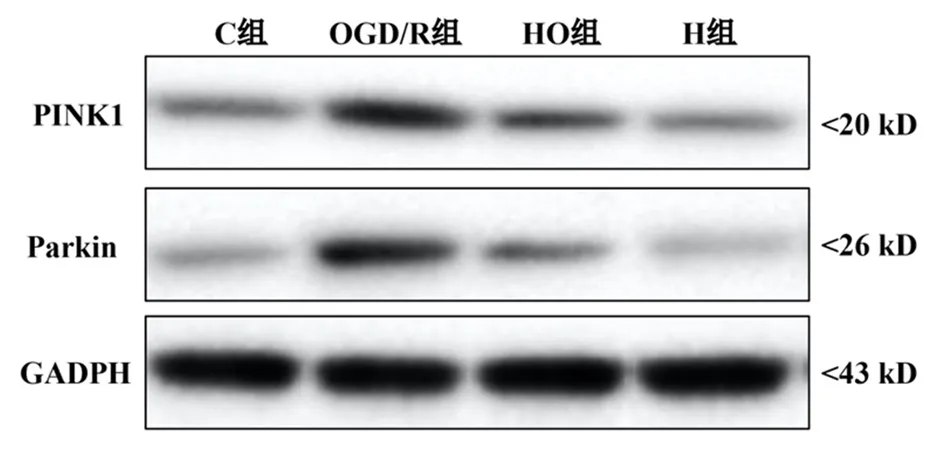
圖2 4組大鼠星形膠質細胞PINK1和Parkin表達
3 討 論
原代培養的大鼠皮質星形膠質細胞是常用的離體研究神經膠質細胞功能的良好模型[10]。氧糖剝奪/復糖復氧是模擬在體缺血再灌注損傷模型中重要體外模型,與單純的缺氧復氧模型比較,更接近于在體的病理生理狀態[11]。Annexin V通過與細胞膜表面的磷脂酰絲氨酸結合,提示細胞處于早期凋亡階段;PI的陰性與陽性可表示細胞處于凋亡早期或晚期[12]。作為一種已發現的細胞死亡形式,其特征為caspase-1激活后裂解為cleaved caspase-1,形成焦亡小體,啟動焦亡程序,cleaved caspase-1/PI聯合染色常被用于檢測細胞的焦亡程度[13]。本研究表明,大鼠原代星形膠質細胞在氧糖剝奪6 h并復糖復氧24 h后,Annexin V-FITC(+)/PI(-)和cleaved caspase-1(+)/PI(+)細胞明顯增加,存活率下降,表明該體外缺血再灌注損傷模型可導致細胞凋亡和焦亡增加,存活率下降。
當機體受到缺血后,線粒體能量缺失;而再灌注發生后可導致線粒體過度氧化應激,ROS過度生成,鈣離子超載[14]。既往研究表明,線粒體受損后可導致PINK1快速募集Parkin,形成PINK1/Parkin復合體,引發線粒體外膜包裹,最終誘導細胞色素C釋放至細胞質,導致凋亡[15]。ROS的過度生成及鈣離子超載后,可激活caspase-1裂解,形成焦亡小體,導致細胞焦亡[16]。本研究結果顯示,大鼠原代星形膠質細胞在氧糖剝奪/復糖復氧后,ROS含量增加,細胞內鈣離子濃度增加,同時PINK1和Parkin表達水平增加,提示星形膠質細胞的凋亡和焦亡可能與缺血再灌注損傷后,線粒體氧化應激過度導致PINK1/Parkin通路的激活后過度表達相關。
H89透過細胞膜后與PKA結合,影響其下游的底物和亞基結合,從而抑制PKA活性[17];缺血再灌注損傷可導致神經元細胞質內PKA活性增加,抑制PKA過度激活可減少神經元凋亡,其機制可能與PKA減少PINK1/Parkin信號通路激活相關[18]。既往研究表明,降低PKA活化,可減少PINK1/Parkin信號通路的泛素化,減輕帕金森病的惡化進程[19];而增加PKA磷酸化激活,可上調PINK1/Parkin誘發的線粒體自噬,誘發細胞進入凋亡周期[20]。結合參考文獻[21]及預實驗結果,本研究采用10 μmol/L H89作用于氧糖剝奪/復糖復氧后的大鼠皮質星形細胞,顯示H89能夠顯著抑制PKA活性,同時降低氧糖剝奪/復糖復氧導致的星形膠質細胞凋亡、焦亡和PINK1、Parkin的表達,增加細胞存活率,同時減少ROS生成,抑制細胞內鈣離子超載。以上結果表明抑制PKA過度活化可減輕氧糖剝奪/復糖復氧導致的星形膠質細胞線粒體損傷,抑制細胞凋亡和焦亡。
綜上所述,抑制PKA過度活化能夠減輕氧糖剝奪/復氧復糖后大鼠星形膠質細胞凋亡和焦亡,其機制與抑制PINK1/Parkin信號通路激活相關。

