等離子體處理對(duì)亞麻籽膠結(jié)構(gòu)和功能特性的影響
禹 曉,聶成鎮(zhèn),秦曉鵬,陳彬云,黃沙沙,相啟森,鄧乾春
(1. 鄭州輕工業(yè)大學(xué)食品與生物工程學(xué)院,河南省冷鏈?zhǔn)称焚|(zhì)量安全控制重點(diǎn)實(shí)驗(yàn)室,食品生產(chǎn)與安全河南省協(xié)同創(chuàng)新中心,鄭州 450001;2. 中國農(nóng)業(yè)科學(xué)院油料作物研究所,油料脂質(zhì)化學(xué)與營養(yǎng)湖北省重點(diǎn)實(shí)驗(yàn)室,農(nóng)業(yè)農(nóng)村部油料加工重點(diǎn)實(shí)驗(yàn)室,武漢 430062)
0 引 言
亞麻籽膠是位于亞麻籽外種皮黏液細(xì)胞層的一種陰離子雜多糖,占亞麻籽總質(zhì)量的8%~10%。作為一種親水性膠體,亞麻籽膠具有較好的增稠、乳化、弱凝膠特性[1]。作為一種可溶性膳食纖維,亞麻籽膠還具有降血糖、降膽固醇、控制體重、調(diào)節(jié)腸道菌群等[2]。基于這一功能特性和健康促進(jìn)效應(yīng),亞麻籽膠將在健康食品產(chǎn)業(yè)中具有廣闊的應(yīng)用前景。
亞麻籽膠主要由高分子量的中性多糖(75%;1 200 kDa)和兩個(gè)低分子量的酸性多糖(25%;650 kDa,17 kDa)組成。其中,中性多糖的單糖單元主要為木糖、L-阿拉伯糖和半乳糖,而酸性多糖的單糖單元主要為L-鼠李糖、D-半乳糖醛酸、L-半乳糖、L-巖藻糖。亞麻籽膠單糖組成和分子量極大地受亞麻籽品種、提取方法等影響[3-4]。在增稠、乳化和凝膠等多種功能特性中,現(xiàn)有研究更多地聚焦在亞麻籽膠的乳化活性上。亞麻籽膠能夠與亞麻籽蛋白、乳清分離蛋白、牛血清白蛋白、米糠蛋白等基于靜電交互作用,通過雜聚、層層自組裝和直接混合等技術(shù)構(gòu)建敏感性活性組分的載運(yùn)體系,但需過度依賴體系中的pH值、離子強(qiáng)度等[5-9]。亞麻籽膠具有一定的穩(wěn)定乳液的潛力,主要依賴于共存的亞麻籽蛋白,尤其是與酸性多糖組分以非共價(jià)鍵形式結(jié)合的低分子量2S貯藏蛋白Conlinin(15~18 kDa)[10]。因此,尋求一種適宜的物理改性技術(shù)進(jìn)一步提高亞麻籽膠的功能特性尤其是乳化活性(依賴或不依賴共存的亞麻籽蛋白),或同時(shí)強(qiáng)化與蛋白之間靜電交互作用,將更有利于亞麻籽膠用于n-3多不飽和脂肪酸(n-3PUFAs)等活性組分載運(yùn)體系的構(gòu)建。
低溫等離子體技術(shù)作為一種非熱新型食品加工技術(shù),正逐步應(yīng)用于植物或動(dòng)物源蛋白質(zhì)的適度改性研究[11]。筆者前期研究表明,適度空氣壓低溫等離子體處理因能夠改變亞麻籽蛋白空間構(gòu)象和酚類化合物釋放,進(jìn)而提高亞麻籽蛋白乳化活性和抗氧化活性[12]。近幾年,低溫等離子體技術(shù)也逐步應(yīng)用于多糖類食品大分子的改性研究。已有研究表明,采用介質(zhì)阻擋放電等離子體技術(shù)處理黃原膠固體粉末,能夠增加黃原膠的低剪切黏度,并進(jìn)一步改善其乳化活性,并不影響黃原膠多糖的基本骨架結(jié)構(gòu)[13]。另一項(xiàng)研究表明,脈沖放電等離子體能夠誘導(dǎo)0.5%乙酸溶液中殼聚糖降解,并改變殼聚糖結(jié)晶結(jié)構(gòu)[14]。亞麻籽膠還具有一定的抗氧化潛力,并隨著提取溫度增加體外抗氧化活性增強(qiáng),這主要?dú)w因于與亞麻籽膠共存的酚類化合物[15]。基于現(xiàn)有的研究證據(jù),我們推測等離子體預(yù)處理可能同時(shí)作用于亞麻籽膠,以及共存的少量亞麻籽蛋白及酚類化合物,而改變亞麻籽膠的功能特性,尤其是熱特性、抗氧化活性、穩(wěn)定乳液的潛力等。基于此,本研究擬探討不同離子體處理時(shí)間對(duì)亞麻籽結(jié)構(gòu)和功能特性的影響規(guī)律,以期為亞麻籽膠的物理改性和拓寬其在健康食品中的應(yīng)用提供一定的依據(jù)。
1 材料與方法
1.1 材料與試劑
亞麻籽,甘肅省農(nóng)科院作物研究所;1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-Picrylhydrazyl, DPPH)、三吡啶基三嗪(Tripyridyltriazine, TPTZ),上海碧云天生物技術(shù)有限公司;福林酚、沒食子酸,索萊寶生物科技有限公司;水溶性維生素E(Trolox),美國Sigma公司;無水乙醇、甲醇等均為國產(chǎn)分析純。
1.2 儀器與設(shè)備
TS-PL200等離子表面處理機(jī),深圳市東信高科技自動(dòng)化設(shè)備有限公司;冷凍干燥機(jī)、XHF-D高速分散器,寧波新芝生物科技股份有限公司;P901酸度計(jì)測定儀,上海佑科儀器儀表有限公司;Multiskan GO全波長酶標(biāo)儀,美國Thermo公司;Vertex70傅里葉變換紅外光譜儀,德國布魯克公司;Discovery流變儀,美國TA儀器公司;自動(dòng)界面張力儀K100,德國Kruss儀器有限公司;同步熱分析儀STA449F3,德國耐馳公司;穩(wěn)定性分析儀Turbiscan,法國Formulaction公司;Nano-ZS90激光粒度儀 英國馬爾文儀器公司;Regulus 8100電鏡,日本日立(Hitachi)公司;Quorum PP3010T冷凍傳輸裝置,英國Quorum公司;離子色譜儀ICS5000,賽默飛世爾科技(中國)有限公司;高效液相色譜儀LC-10A,日本島津公司。
1.3 試驗(yàn)方法
1.3.1 亞麻籽膠的提取
參考Hu等[16]方法,將亞麻籽與去離子水按1∶6 g/mL置于玻璃燒杯中,使用機(jī)械攪拌在水浴加熱70 ℃條件下提取4 h,離心(6 000 r/min、20 min)獲得上清液,按體積比1∶1加入無水乙醇沉淀亞麻籽膠,離心(6 000 r/min、20 min)收集下層沉淀,經(jīng)-80 ℃預(yù)凍后,置于冷凍干燥機(jī)(溫度,-60 ℃;真空度為1 Pa;時(shí)間,24 h)使其完全干燥、經(jīng)研磨粉碎后獲得亞麻籽膠粉末。
1.3.2 等離子體處理亞麻籽膠溶液
取6 g亞麻籽膠粉末樣品,加入適量體積去離子水,配制質(zhì)量濃度為5 mg/mL的亞麻籽膠溶液,磁力攪拌至充分溶解,4 ℃冰箱過夜使其充分水合。將150 mL亞麻籽膠溶液置于等離子體發(fā)生器噴嘴下方分別處理0、5、15、30、60、90和120 s(為避免處理過程溶液溫度升高,每隔30 s間歇30 s,冰水混合物輔助降溫)。參考筆者前期研究[12],本研究設(shè)置等離子體噴嘴與溶液表面之間的距離為20 mm,放電電壓為5 kV,放電功率為750 W,頻率為40 kHz,工作氣體為壓縮空氣,等離子體射流出口流量為30 L/min。
1.3.3 pH值和Zeta電位值測定
利用酸度計(jì)室溫下直接測定亞麻籽膠溶液的pH值。經(jīng)去離子水稀釋10倍后,室溫下用激光粒度儀測定亞麻籽膠溶液的Zeta電位值。
1.3.4 微觀形態(tài)觀察
取3μL等離子體處理的亞麻籽膠溶液,滴在載玻片上,輕輕蓋上蓋玻片,每個(gè)樣品隨機(jī)取樣3次,在40倍顯微鏡下對(duì)亞麻籽膠在水溶液中的微觀形態(tài)進(jìn)行觀察。
1.3.5 持水性分析
參考Mirhosseini等[17]方法并稍作修改。具體為:稱取0.1 g亞麻籽膠溶于5 mL去離子水中,漩渦5 min,4 000 r/min離心10 min,取出上清液并稱量。亞麻籽膠的持水性用下式計(jì)算:
持水性(%)=(m2-m1)/m1×100 (1)其中m2為吸附亞麻籽膠的去離子水的質(zhì)量,g;m1為稱取亞麻籽膠質(zhì)量,0.1 g。
1.3.6 傅里葉變換紅外光譜分析
將等離子體處理的亞麻籽膠溶液經(jīng)冷凍干燥(溫度,-60 ℃;真空度為1 Pa;時(shí)間,24 h)后,取適量粉末樣品與溴化鉀按質(zhì)量比1∶100在瑪瑙研缽里充分研磨混合均勻后壓片,利用傅里葉變換紅外光譜儀在4 000~400 cm-1區(qū)內(nèi)進(jìn)行掃描分析,分辨率為4 cm-1。
1.3.7 單糖組成和分子量測定
利用離子色譜儀測定亞麻籽膠單糖組成。取4 mg冷凍干燥的亞麻籽膠粉末樣品于安瓿瓶中,加入2 mol/L三氟乙酸1 mL,在120 ℃下水解3 h,冷卻至室溫。準(zhǔn)確吸取200μL酸水解液轉(zhuǎn)移至1.5 mL EP管中,經(jīng)氮?dú)獯蹈珊笤偌尤? mL去離子水渦旋混勻,12 000 r/min離心5 min,取上清液進(jìn)行離子色譜分析。具體為:色譜柱,Dionex CarbopacTMPA20 (150 mm×3 mm);流動(dòng)相,A:H2O、B:250 mmol/L NaOH、C: 50 mmol/L NaOH &500 mmol/L NaOAC;流速,0.3 mL/min;進(jìn)樣量,5μL;柱溫,30 ℃;檢測器,電化學(xué)檢測器。
利用高效液相色譜儀測定亞麻籽膠分子量分布情況。精確稱取冷凍干燥的粉末樣品和標(biāo)準(zhǔn)品,配制成5 mg/mL溶液,充分溶解后在12 000 r/min條件下離心10 min,取上清液經(jīng)0.22μm微孔濾膜過濾后進(jìn)樣分析。具體測試條件為:色譜柱,BRT105-104-102串聯(lián)凝膠柱(8 mm×300 mm);流動(dòng)相,0.05 mol/L NaCl溶液;流速,0.6 mL/min;柱溫,40 ℃;進(jìn)樣量,20μL;檢測器,示差檢測器RI-502。
1.3.8 熱特性分析
利用同步熱分析儀對(duì)等離子體處理并經(jīng)冷凍干燥的亞麻籽膠進(jìn)行熱穩(wěn)定性分析。測試條件為:掃描溫度,30~620 ℃;升溫速率,10 ℃/min;氮?dú)猓∟2)流速,20 mL/min。
1.3.9 表觀黏度分析
利用動(dòng)態(tài)剪切流變儀測定亞麻籽膠溶液表觀黏度。測試條件為:夾具直徑,40 mm;夾縫間隙,0.5 mm;測試溫度,25 ℃;剪切速率,1~100 s-1。
1.3.10 界面張力的測定
利用自動(dòng)界面張力儀鉑金平板法測量亞麻籽膠溶液和油相之間的界面張力。參考O'Sullivan等[18]方法,稍加修改。將裝有14 g亞麻籽膠溶液的玻璃皿放入儀器中,調(diào)整鉑金板浸入液面3 mm深度,緩慢加入40 g亞麻籽油,使其在
亞麻籽膠溶液與油相之間形成界面。測試條件為:測定溫度,25 ℃;測定頻率,1次/60 s;測定時(shí)間,3 600 s。
1.3.11 總酚酸、黃酮和體外抗氧化活性分析
酚類化合物提取:準(zhǔn)確稱取0.05 g冷凍干燥的亞麻籽膠的粉末于10 mL離心管中,加入5 mL80%(體積分?jǐn)?shù))甲醇水溶液,超聲輔助提取15 min,再渦旋提取5 min,離心(5 000 r/min,15 min)取上層清液,備用。參考Deng等[19]和趙萌萌等[20]方法,對(duì)提取液中總酚、黃酮和體外抗氧化活性進(jìn)行分析測定,具體為:
總酚和黃酮含量:采用福林酚比色法測定提取液中的總酚含量,結(jié)果以沒食子酸計(jì),單位為mg/100 g;采用硝酸鋁法測定黃酮含量,結(jié)果以蘆丁計(jì),單位為μg/100 g。
體外抗氧化活性:采用DPPH法和鐵離子還原/抗氧化能力(Ferric ion Reducing Antioxidant Power, FRAP)法評(píng)價(jià)提取液的體外抗氧化活性。DPPH法:準(zhǔn)確稱取3 mg DPPH,加入120 mL質(zhì)量分?jǐn)?shù)為80%甲醇水溶液,超聲促溶5 min后漩渦充分搖勻,避光保存。在避光條件下,分別加入150μL提取液和500μL DPPH溶液于比色管中,避光反應(yīng)30 min,在517 nm波長處測吸光度值,結(jié)果以Trolox計(jì)μg/100 g表示。FRAP法:將200μL提取液加入到700μL TPTZ工作液中,37 ℃避光水浴30 min,在593 nm波長處測吸光度值,結(jié)果以FeSO4·7H2O計(jì),單位為μg/100 g。
1.3.12 亞麻籽膠穩(wěn)定乳液的能力分析
考慮到超高壓均質(zhì)或微射流等方法對(duì)亞麻籽膠及其共存的少量亞麻籽蛋白和酚類化合物分子結(jié)構(gòu)等可能的影響,本研究僅采用高速剪切分散法制備亞麻籽油粗乳液,以評(píng)價(jià)等離子體處理對(duì)亞麻籽膠穩(wěn)定乳液能力的影響。具體為,將等離子體處理的亞麻籽膠溶液與亞麻籽油以9∶1(質(zhì)量比)置于100 mL離心管中,用高速分散器以10 000 r/min均質(zhì)2 min,獲得亞麻籽油粗乳液。利用冷場掃描電鏡觀察亞麻籽油粗乳液的微觀形態(tài),比較分析不同時(shí)間等離子體處理亞麻籽膠多糖的乳化活性。具體測試條件為:升華溫度,-80 ℃;升華時(shí)間,8 min;噴金,5 mA,90 s。參考Wang等[21]方法,利用多重光散射儀測定亞麻籽油粗乳液的物理穩(wěn)定性。具體測試條件為:上樣量,18 mL;掃描頻率,1次/25 s;掃描時(shí)間,30 min。
1.3.13 數(shù)據(jù)統(tǒng)計(jì)分析
所有試驗(yàn)重復(fù)3次,結(jié)果均以平均值±標(biāo)準(zhǔn)差表示(n=3)。利用SPSS軟件進(jìn)行統(tǒng)計(jì),對(duì)不同等離子體處理時(shí)間的樣本進(jìn)行單因素方差分析,采用Tukey進(jìn)行兩兩比較,P<0.05認(rèn)為數(shù)據(jù)差異顯著具有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果與分析
2.1 等離子體處理對(duì)亞麻籽膠溶液pH值、Zeta電位、微觀形態(tài)和持水性的影響
圖1a和圖1b為不同等離子體處理時(shí)間對(duì)亞麻籽膠溶液pH值和Zeta電位的影響。由圖1a可知,隨著等離子體處理時(shí)間的延長,亞麻籽膠溶液的pH值逐漸降低,從處理前的5.17降至處理120 s時(shí)的3.00(P<0.05)。這可能是由于等離子體處理過程產(chǎn)生的亞硝酸根(NO2-)、硝酸根(NO3-)、過氧亞硝基陰離子(ONOO-)等含氮物質(zhì)導(dǎo)致水溶液的酸化[22]。亞麻籽膠,作為陰離子雜多糖,其初始Zeta電位為(-30.43±2.41)mV,短時(shí)間等離子體處理(0~5 s)對(duì)亞麻籽膠溶液Zeta電位值無顯著影響(P>0.05);持續(xù)延長等離子體暴露時(shí)間,Zeta電位值逐漸增加,達(dá)到(-15.87±0.45)mV,這主要因?yàn)榈入x子體誘導(dǎo)溶液酸化過程中不斷中和了亞麻籽膠分子表面的負(fù)電荷。因此,長時(shí)間等離子體處理可能不利于亞麻籽膠與蛋白類乳化劑基于靜電交互作用生成復(fù)合凝聚體系,作為活性物質(zhì)的載運(yùn)體系[12]。
圖1c和圖1d為不同等離子體處理時(shí)間對(duì)亞麻籽膠溶液微觀形態(tài)和持水性的影響。由圖1c可知,水溶液中亞麻籽膠呈分布均勻的微小顆粒形態(tài),且存在的較大多糖顆粒。隨著等離子體處理時(shí)間延長(0~60 s),溶液中亞麻籽膠顆粒明顯變小;當(dāng)處理時(shí)間延長至90 s時(shí),已幾乎不存在較大顆粒;當(dāng)處理時(shí)間持續(xù)延長至120 s時(shí),亞麻籽膠顆粒幾乎不可見,這與亞麻籽膠平均粒徑的變化趨勢基本一致。亞麻籽膠具有強(qiáng)吸水性和弱凝膠特性,在吸水凝膠中大多數(shù)水以自由水形式存在。適度等離子體處理則促進(jìn)亞麻籽膠溶解,即水合作用,形成弱凝膠結(jié)構(gòu)。但過長時(shí)間等離子體處理則可能誘導(dǎo)亞麻籽膠不同程度的解聚效應(yīng),進(jìn)一步暴露吸水基團(tuán),增加吸水性。但同時(shí),長時(shí)間等離子體誘導(dǎo)的解聚效應(yīng)會(huì)削弱亞麻籽膠的弱凝膠結(jié)構(gòu),降低持水性(如圖1d所示)。
2.2 等離子體處理對(duì)亞麻籽膠單糖組成、分子量分布和分子結(jié)構(gòu)的影響
表1和圖2分別反映了等離子體處理對(duì)亞麻籽膠單糖組成、分子量分布和分子結(jié)構(gòu)的影響。由表1可知,亞麻籽膠主要是由木糖(29.90%)、鼠李糖(15.70%)、半乳糖醛酸(14.30%)、半乳糖(13.80%)、阿拉伯糖(12.60%)、葡萄糖(8.40%)和巖藻糖(5.40%)組成,這與Kaushik等[4]報(bào)道的亞麻籽膠單糖組成具有一定差異性,主要?dú)w因于品種和提取方法對(duì)亞麻籽膠組成的影響[3]。由圖2a可知,亞麻籽膠主要由高分子量的中性多糖(組分1:3.08×106g/mol)、較低分子量酸性多糖(組分2:1.41×103g/mol),以及小分子量組分3(2.91×102g/mol)構(gòu)成。短時(shí)間等離子體處理(0~15 s)對(duì)亞麻籽膠的中性和酸性多糖組分無明顯影響;但進(jìn)一步延長等離子體處理時(shí)間(30~90 s),高分子量組分1峰值開始向右遷移,同時(shí)小分子量組分3含量增加,可能誘導(dǎo)了側(cè)鏈末端部分單糖剪切;當(dāng)?shù)入x子體處理時(shí)間從90 s延長至120 s時(shí),組分1分子量分布范圍變窄,可能由于剪切效應(yīng)的逐步變強(qiáng)進(jìn)一步誘導(dǎo)組分1整體解聚效應(yīng),而對(duì)組分2和3無明顯影響。類似在較高電壓下等離子體處理誘導(dǎo)的肌原纖維蛋白適度降解,長時(shí)間等離子體處理可能對(duì)亞麻籽膠的多糖鏈產(chǎn)生剪切效應(yīng),進(jìn)而誘導(dǎo)解聚效應(yīng)[23]。
由圖2b可知,亞麻籽膠在3 408.0 cm-1附近吸收峰為O-H伸縮振動(dòng),2 925.6 cm-1附近吸收峰為C-H伸縮振動(dòng),1 410 cm-1附近吸收峰為C-H變角振動(dòng)特征峰,與C-H伸縮振動(dòng)構(gòu)成了糖環(huán)的特征吸收;1 041.5 cm-1處強(qiáng)吸收峰為O-H的變角振動(dòng),也是糖環(huán)的特征吸收峰;在1 608.5 cm-1附近具有強(qiáng)吸收峰,可能是羧基的伸縮振動(dòng)。上述亞麻籽膠特征吸收峰與Safdar等[24]研究結(jié)果基本一致。等離子體處理對(duì)亞麻籽膠在4 000~400 cm-1特征吸收峰無明顯影響,表明該處理對(duì)亞麻籽膠的官能團(tuán),也即多糖基本骨架結(jié)構(gòu)無破壞效應(yīng)。
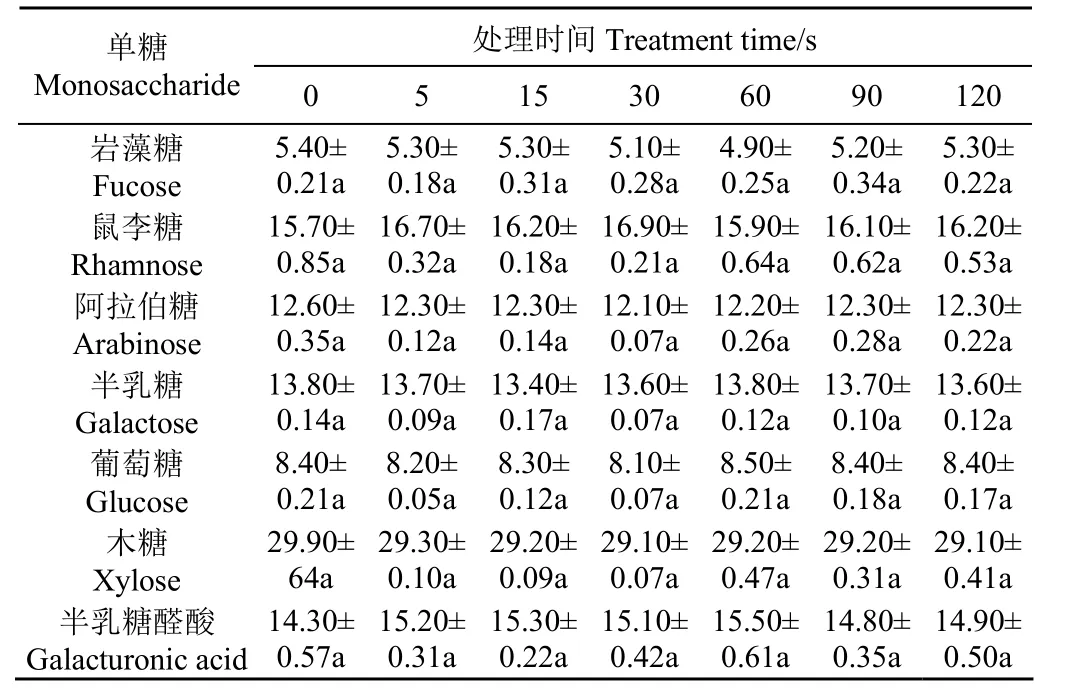
表1 等離子體處理對(duì)亞麻籽膠單糖組成的影響Table 1 Effects of plasma treatment on monosaccharides composition of flaxseed gum%
2.3 等離子體處理對(duì)亞麻籽膠熱特性的影響
圖3是等離子體處理對(duì)亞麻籽膠熱重分析(Thermogravimetric, TG)和微商熱重分析(Differential Thermogravimetric, DTG)曲線的影響。亞麻籽膠的熱降解分為4個(gè)階段:第一個(gè)階段是失水階段(30~120 ℃),質(zhì)量分?jǐn)?shù)降低約15個(gè)百分點(diǎn),主要是隨著溫度的升高,亞麻籽膠中水分變?yōu)闅鈶B(tài)被保護(hù)氣帶走;第二階段是降解準(zhǔn)備階段(120~240 ℃),在該階段亞麻籽膠質(zhì)量分?jǐn)?shù)基本保持不變;第三階段是降解階段(240~400 ℃),在該階段隨溫度的升高,亞麻籽膠質(zhì)量分?jǐn)?shù)快速降低,可能由于亞麻籽膠發(fā)生熱降解,生成的揮發(fā)性物質(zhì)隨保護(hù)氣逸出;第四階段為炭化階段(400~620 ℃),上一階段的一些殘留物仍在緩慢分解,質(zhì)量損失速率較為緩慢,主要發(fā)生了物質(zhì)的炭化和聚合,生成的少量氣體被保護(hù)氣帶走[25]。
由圖3a可知,等離子體處理對(duì)亞麻籽膠在300 ℃以下的熱穩(wěn)定性無明顯影響;但在熱降解后期,等離子體處理能夠增加亞麻籽膠的質(zhì)量損失率,即降低了亞麻籽膠在高溫下發(fā)生炭化反應(yīng)的溫度。由圖3b可知,亞麻籽膠在初始極短時(shí)間失重速率為40%,90 ℃時(shí)失重速率為20%;在120~200 ℃失重速率幾乎為0;240 ℃之后失重速率開始加劇,290 ℃時(shí)失重速率達(dá)到最大(>80%),且等離子體處理15 s的樣品失重速率達(dá)到90%以上;在400 ℃失重速率降低至10%,之后隨著溫度的升高,失重速率不斷降低,在600 ℃時(shí)小于3%。隨等離子體處理時(shí)間的延長,失重速率不斷降低(120 s,0.7%)并保持穩(wěn)定,表明等離子體處理降低了樣品失重所需要的溫度,同時(shí)加劇了樣品的失重程度。
總之,一方面,等離子體誘導(dǎo)的亞麻籽膠部分解聚可能會(huì)降低亞麻籽膠的熱裂解特性;另一方面,與亞麻籽膠共存的少量亞麻籽蛋白空間構(gòu)象的改變和氧化修飾、游離酚酸釋放和氧化耗竭、木酚素大分子解聚等均會(huì)影響亞麻籽膠的熱特性,從而使等離子體對(duì)亞麻籽膠熱裂解特性的影響更加復(fù)雜化[26]。
2.4 等離子體處理對(duì)亞麻籽膠溶液表觀黏度和界面吸附特性的影響
圖4為等離子體處理對(duì)亞麻籽膠溶液的表觀黏度和界面吸附特性的影響。由圖4a可知,隨著剪切速率的增大,亞麻籽膠溶液的表觀黏度顯著降低,尤其是在低剪切速率范圍內(nèi)(0.1~10 s-1),表現(xiàn)出剪切變稀型非牛頓流體特性[27]。短時(shí)間等離子體處理(0~15 s)使亞麻籽膠溶液的低剪切速率下的表觀黏度略有降低;繼續(xù)延長等離子體處理時(shí)間(30~120 s),亞麻籽膠低剪切速率下的表觀黏度呈明顯降低的趨勢(P<0.05),這可能歸因于等離子體處理過程中亞麻籽膠平均粒徑和分子質(zhì)量的逐漸降低。
由圖4b可知,亞麻籽膠表現(xiàn)出較好的快速(0~60 s)吸附到油-水界面的能力。隨著時(shí)間的延長(60~3 600 s),亞麻籽膠的吸附能力逐步趨于穩(wěn)定。短時(shí)間等離子體處理(0~30 s)對(duì)亞麻籽膠油-水界面短時(shí)吸附特性無明顯影響,但一定程度上降低了亞麻籽膠在油-水界面的總吸附量;繼續(xù)延長等離子體處理時(shí)間至60~120 s時(shí),亞麻籽膠溶液油-水界面短時(shí)吸附能力和速率均明顯降低。界面張力的增加對(duì)以亞麻籽膠作為乳化劑構(gòu)建的乳液穩(wěn)定性是一個(gè)不利因素,但不是決定性因素。適度的界面壓力增加的同時(shí),決定乳液穩(wěn)定性的界面膜強(qiáng)度會(huì)隨之增加,故乳液穩(wěn)定性也可能增強(qiáng)[28]。
2.5 等離子體處理對(duì)亞麻籽膠總酚、黃酮和體外抗氧化活性的影響
圖5是等離子體處理對(duì)亞麻籽膠中總酚、黃酮和體外抗氧化活性的影響。由圖5a可知,未處理亞麻籽膠中總酚含量為409.81 mg/100 g,黃酮含量為10.38μg/100 g。已有研究表明,亞麻籽膠中酚類化合物含量,包括咖啡酸、對(duì)香豆酸、表兒茶素、鞣花酸、肉桂酸、香草酸等,依賴于亞麻籽膠的提取溫度,提取溫度越高酚類化合物和亞麻籽膠的共提取程度越強(qiáng),但這一遷移特性具有酚酸種類特異性[15]。事實(shí)上,與亞麻籽膠共存的酚類化合物,主要與亞麻籽蛋白的非共價(jià)鍵具有交互作用[10]。短時(shí)間等離子體處理(0~5 s)后,亞麻籽膠中總酚含量明顯降低(P<0.05);當(dāng)延長處理時(shí)間至15 s時(shí),總酚含量又回升至初始水平;進(jìn)一步延長處理時(shí)間至120 s時(shí),總酚含量呈緩慢下降后略有升高的趨勢。等離子體處理(0~60 s)使亞麻籽膠中黃酮含量呈現(xiàn)先顯著增加(P<0.05)后明顯降低的趨勢,基本與未處理亞麻籽膠中黃酮含量相等。進(jìn)一步延長處理時(shí)間(90~120 s),黃酮含量升至最高,為14.13μg/100 g(P<0.05)。
由圖5b可知,未處理亞麻籽膠的DPPH自由基清除能力為2 355.74μg/100 g。等離子體處理15 s后,DPPH自由基清除能力呈現(xiàn)先顯著降低(P<0.05)后明顯增加的趨勢,與初始DPPH自由基清除能力相當(dāng);當(dāng)?shù)入x子體處理時(shí)間延長至120 s時(shí),DPPH自由基清除能力明顯降低(P<0.05)后又升高至初始水平,為2 350.45μg/100 g。未處理亞麻籽膠FRAP鐵還原能力最高,為1 079.01μg/100 g。等離子體處理15 s時(shí),F(xiàn)RAP鐵離子還原能力呈現(xiàn)顯著性降低(P<0.05)后明顯增加的趨勢;等離子體處理30~120 s時(shí),F(xiàn)RAP鐵離子還原能力呈持續(xù)降低后又顯著增加的趨勢,且明顯低于初始FRAP值。總之,等離子體處理過程中亞麻籽膠體外抗氧化活性與總酚和黃酮變化基本一致。
短時(shí)間等離子體處理導(dǎo)致亞麻籽膠中總酚、黃酮含量以及體外抗氧化活性的降低,可能與活性氧或活性氮族化合物誘導(dǎo)的酚酸氧化有關(guān);持續(xù)等離子體處理在適度誘導(dǎo)共存的亞麻籽蛋白空間構(gòu)象改變的同時(shí),則可能更有利于酚類化合物的溶出釋放,并逐步參與到溶出釋放與氧化耗竭動(dòng)態(tài)平衡,以及與體外抗氧化之間的聯(lián)動(dòng)反應(yīng)中。進(jìn)一步延長等離子體處理時(shí)間導(dǎo)致的亞麻籽膠中總酚、黃酮含量和體外抗氧化活性的明顯增加,則可能與亞麻木酚素大分子解聚過程中自由基清除能力提升有關(guān)[12]。
2.6 等離子體處理對(duì)亞麻籽膠穩(wěn)定亞麻籽油乳液能力的影響
圖6a是冷場掃描電鏡下觀察的亞麻籽膠穩(wěn)定的亞麻籽油粗乳液的微觀形態(tài)。由圖6a可知,未處理亞麻籽膠穩(wěn)定亞麻籽油乳液,一方面直接參與乳滴界面膜的形成,另一方面還能夠基于黏稠性調(diào)控乳滴的空間分布;經(jīng)短時(shí)間等離子體處理(0~15 s)處理后,亞麻籽膠穩(wěn)定的亞麻籽油乳液的粒徑逐漸減小,分布趨于均勻,且脂滴之間的“線性粘連”得到明顯改善。進(jìn)一步延長等離子體處理時(shí)間(30~120 s),亞麻籽膠參與乳滴界面膜形成的比例不斷增大,乳滴粒徑分布趨于不均一,呈兩極化。由于依賴黏稠特性維持乳滴穩(wěn)定的能力喪失,乳滴開始出現(xiàn)架橋絮凝,形成串珠狀,表現(xiàn)出失穩(wěn)效應(yīng)。穩(wěn)定性指數(shù)(Turbiscan Stability Index, TSI)是表征被測試乳液所有失穩(wěn)過程的總和,TSI值與乳液穩(wěn)定性呈反比[29]。由圖6b可知,測試過程中隨著乳液放置時(shí)間的延長,亞麻籽膠構(gòu)建的乳液TSI值逐步增加,趨于不穩(wěn)定。短時(shí)間等離子體處理(0~5 s)對(duì)亞麻籽膠構(gòu)建的乳液穩(wěn)定性無明顯影響;當(dāng)?shù)入x子體處理亞麻籽膠時(shí)間延長至15 s時(shí),乳液TSI值最低,表明乳液穩(wěn)定性最好;進(jìn)一步延長處理時(shí)間(30~120 s),乳液TSI值則顯著增加(P<0.05),趨于不穩(wěn)定,這與通過冷場電鏡觀察的結(jié)果基本一致。
長期以來,研究學(xué)者主要認(rèn)為,作為親水性膠體,亞麻籽膠穩(wěn)定亞麻籽油的潛力很大程度上依賴于分子間氫鍵締合介導(dǎo)的弱凝膠特性,從而限制了脂滴在水相中的運(yùn)動(dòng)。筆者通過冷場電鏡對(duì)脂滴的原位觀察發(fā)現(xiàn),亞麻籽膠還直接參與了脂滴界面膜的形成,表現(xiàn)出了乳化活性。適宜而非較長時(shí)間的等離子體處理則能夠使亞麻籽膠基于弱凝膠特性和乳化活性穩(wěn)定乳液的潛力達(dá)到最大化。事實(shí)上,亞麻籽膠表現(xiàn)出的乳化活性很大程度上依賴于共存的亞麻籽蛋白,尤其是與亞麻籽膠具有非共價(jià)交互作用的Conlinin,從而形成天然復(fù)合凝聚物[5]。基于筆者前期研究,短時(shí)間等離子體處理可能改變了與亞麻籽膠共存的亞麻籽蛋白的空間構(gòu)象,增加了親水親油平衡能力,從而改善了亞麻籽膠穩(wěn)定乳液的潛力[12]。整體而言,等離子體處理誘導(dǎo)的亞麻籽膠的降聚效應(yīng),使亞麻籽膠無法基于空間網(wǎng)狀結(jié)構(gòu)穩(wěn)定乳液[30]。
3 結(jié) 論
以質(zhì)量濃度為5 mg/mL亞麻籽膠溶液為對(duì)象,探究不同等離子體處理時(shí)間對(duì)亞麻籽膠理化、分子結(jié)構(gòu)、功能特性的影響規(guī)律,得出如下結(jié)論:
1)等離子體處理降低亞麻籽膠溶液的pH值、Zeta電位絕對(duì)值和分子量,這主要?dú)w因于等離子體誘導(dǎo)的亞麻籽膠的部分解聚效應(yīng)。
2)基于亞麻籽膠熱重分析的結(jié)果顯示,等離子體處理能夠影響高溫下(>300 ℃)亞麻籽膠的炭化和聚合反應(yīng)。
3)等離子體處理后亞麻籽膠的體外抗氧化活性呈現(xiàn)先降低隨后增加,緩慢降低后又顯著增加(P<0.05)的趨勢,可能歸因于等離子體處理過程中共存的游離酚酸釋放和消減、木酚素大分子解聚等。
4)短時(shí)間等離子體處理(15 s)在不明顯改變亞麻籽膠體外抗氧化活性前提下,具有顯著改善亞麻籽膠穩(wěn)定亞麻籽油乳液的潛力,這可能與亞麻籽膠持水性增加、參與界面膜的形成并維持乳液中脂滴的空間分布等有關(guān)。
綜上所述,等離子體作為一種新型綠色食品加工技術(shù),能夠應(yīng)用于亞麻籽膠的適度改性研究,以提高其在健康食品領(lǐng)域中的應(yīng)用前景。

