Napsin A、 TTF-1 及 CK7 在惡性胸水中對肺腺癌的診斷價值
鐘 玲
廣州醫科大學附屬第二醫院病理科 (廣州 510260)
惡性胸水 (malignant pleural effusion, MPE) 是原發于胸膜的惡性腫瘤或其他部位的惡性腫瘤轉移至胸膜導致的胸腔積液, 平均生存期為 4 ~7月[1]。 在日常工作中對惡性胸水進行細胞蠟塊包埋切片, 可獲得與腫瘤組織形態相近的形態, 加以免疫組化的檢測可以對肺原發性惡性胸水和繼發的惡性胸水進行分類。 細胞蠟塊聯合免疫組化檢測特別是Napsin A、 TTF-1 標記能獲得更精準的診斷[2-3], 同時CK7 做為肺腺癌分化的客觀評價指標[4]。 本文回顧性分析189 例惡性胸水細胞蠟塊切片及免疫組化結果, 探討免疫組化標記Napsin A、TTF-1 和CK7 和腫瘤標記物CEA 在肺腺癌胸水中的診斷價值。 在惡性胸水的研究中首次將胸水細胞蠟塊免疫組化及胸水腫瘤標記物綜合起來分析,期望對晚期肺腺癌患者準確的病理診斷提供更充分的依據。
1 材料與方法
1.1 材料
收集廣州醫科大學附屬第二醫院病理科2017 年1 月—2019 年 11 月所有行 Napsin A、 TTF-1 及 CK7免疫組化檢測的惡性胸水的細胞蠟塊的患者資料。
1.2 制作細胞蠟塊
取30 mL 胸水 (血性標本時可加入3%醋酸乙醇10 mL 進行溶血處理) 放入50 mL 離心管中,離心機2 000 r/min, 離心5 min, 棄上清, 如果沉淀物不夠時可加入少量蛋清或反復離心, 收集沉淀物之后, 直接加10 mL 95%酒精充分搖勻, 離心機2 000 r/min, 離心10 min, 棄上清, 取底部沉淀物, 用拷貝紙包埋放進10%中性福爾馬林固定,與常規小組織進行脫水處理。 常規包埋、 3 ~4 μm切片, HE 染色。
1.3 免疫細胞化學方法
觀察常規HE 切片進行, 將有可疑異型成分的蠟塊選取出來進行免疫組化染色, 根據鏡下形態及相關病史選擇不同的抗體 (均包含Napsin A、TTF-1、 CK7), 采用 EnVision 兩步法。 抗體及試劑均購自福州邁新公司。
1.4 免疫組化結果判讀標準
以10% 及以上的目標細胞出現定位 (胞核、胞膜或胞漿) 清晰的棕褐色或黃色顆粒為陽性表達, <10% 或完全不著色為陰性表達。
1.5 統計分析
計數資料用n(%) 表示; 連續變量采用中位數 (四分位間距) 表示。 計數資料的比較采用χ2檢驗; 兩組間比較采用Mann-whitney U 非參數檢驗, 受試者工作特征曲線 (AUC 曲線) 分析并確定血清和胸水CEA 的最佳診斷臨界值并計算曲線下面積 (AUC),P<0.05 為差異有統計學意義,使用SPSS 17.0 統計軟件進行統計。
2 結 果
2.1 細胞蠟塊HE 切片
細胞蠟塊切片中背景干凈, 對比較明顯, 細胞形態與常規組織學中形態相似, 避免了細胞學涂片的細胞重疊、 退變等不利于觀察的因素。 大部切片中可見較多巨噬細胞和間皮細胞, 腫瘤細胞異型性明顯, 容易辨認。
2.2 惡性胸水的細胞學類型及組織來源
在189 例惡性胸水標本中, 其中155 例為肺腺癌細胞, 部分病例細胞聚集成三維立體球狀結構, 部分病例可見乳頭狀或腺腔樣結構, 細胞核漿比明顯升高, 可見核分裂。 1 例為肺小細胞癌細胞, 癌細胞胞漿少, 近乎裸核, 異型性明顯。1 例為惡性黑色素瘤細胞, 瘤細胞胞漿內可見明顯的黑色素顆粒, 細胞核核仁明顯, 表現明顯的失粘附性。 見表1。
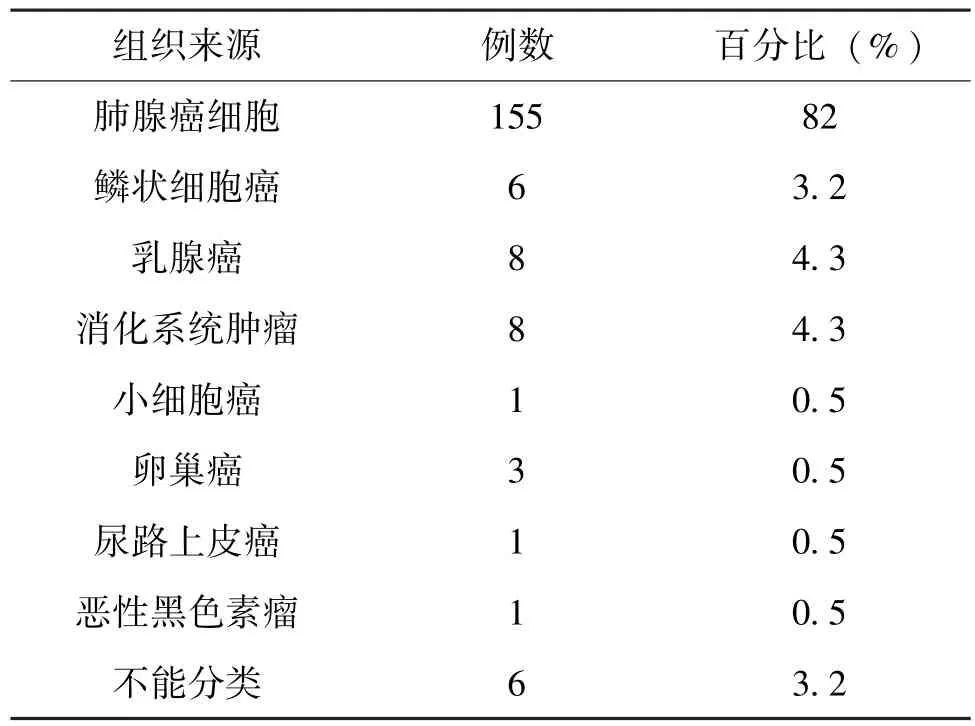
表1 189 例惡性胸水中組織來源
2.3 惡性胸水的免疫組化表達情況
除了 CK7、 TTF-1 及 Napsin A 外, 基于形態學及病史考慮, 再增加部分抗體, 有乳腺癌病史患者細胞學出現ER、 PR、 Mammaglobin 陽性時診斷為轉移性乳腺癌。 既往有下肢惡性黑色素瘤病史時, 結合 S-100、 HMB45、 Melan A 彌漫陽性時診斷為轉移性惡性黑色素瘤細胞。 有部分病例細胞異型性明顯, 血及胸水中的CEA 表達均有不同程度的升高, 免疫組化CEA、 CK 均有表達, 且臨床無明確病史且影像學檢查也未見實質性占位, 這種情況考慮為惡性胸水, 但是來源不明。
免疫組化結果分析 Napsin A 蛋白陽性顆粒定位于胞漿, 在肺腺癌及其他腫瘤所致的惡性胸水標本中的陽性表達率分別為83.9%及16.1% (差異有統計學意義,P<0.001)。 TTF-1 蛋白陽性顆粒定位于胞核, 在肺腺癌及其他腫瘤所致的惡性胸水標本中的陽性表達率分別為93.5%及6.5%(差異有統計學意義,P<0.001)。 CK7 蛋白陽性顆粒定位于胞漿及胞膜, 在肺腺癌及其他腫瘤所致的惡性胸水標本中的陽性表達率分別為98.1%、1.9% (差異有統計學意義,P<0.001)。 所有病例Napsin A、 TTF-1 和 CK7 表達情況見表 2。
2.4 為了進一步研究胸水CEA、 血清CEA、 免疫組化標記Napsin A、 TTF-1 和CK7 在肺腺癌源性胸水的診斷價值, 我們將所有患者分為肺腺癌組和非肺腺癌組, 患者的一般情況和胸水CEA 和血清CEA 水平及免疫組化標記Napsin A、 TTF-1 和CK7表達情況見表3。 結果表明, 兩組患者的年齡無統計學差異 (P>0.05), 但肺腺癌組患者男性比例更高, 差異有統計學意義 (P=0.019); 相對于非肺腺癌組, 肺腺癌組患者的血清CEA 和胸水CEA 水平升高, 其差異有統計學意義 (P均<0.05); 與非肺腺癌組相比較, 肺腺癌組患者的Napsin A、 TTF-1和CK7 表達升高 (P均<0.05)。
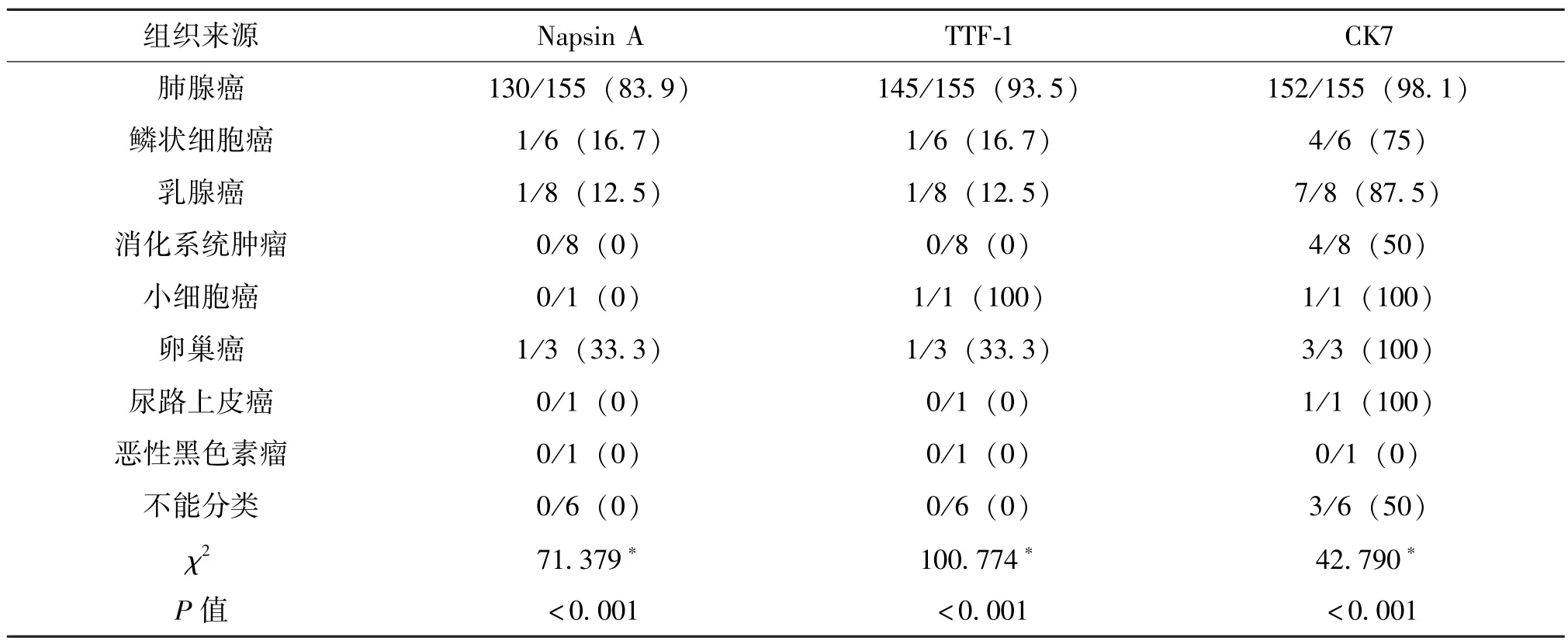
表2 189 例惡性胸水中Napsin A、 TTF-1、 CK7 的表達情況 %

表3 胸水肺腺癌與非肺腺癌比較
2.5 在肺腺癌和其它惡性腫瘤所致惡性積液的鑒別診斷中, Napsin A 診斷肺腺癌的敏感度為83.9%, 特異度為93.9%; TTF-1 診斷肺腺癌的敏感度為93.5%, 特異度為90.9%; CK7 診斷肺腺癌的敏感度為98.1%, 特異度為42.4%。
2.6 采用ROC 曲線繪制血清CEA 和胸水CEA 診斷肺腺癌的曲線下面積見圖1。 測得血清CEA 的ROC 曲線面積為0.627,P=0.022, 其診斷肺腺癌的參考值: 7.16 ng/mL, 其診斷肺腺癌的敏感度為69.7%, 特異度為58.5%; 胸水 CEA 的 ROC 曲線面積為0.699,P=0 <0.001, 其診斷肺腺癌的參考值: 90.04 ng/mP, 其診斷肺腺癌的敏感度為69.0%, 特異度為66.7%。
3 討 論
正常胸腔內有少許漿液, 有潤滑作用, 但是在病理狀態下漿液可明顯增多。 以往, 胸水增多的病因以結核多見, 但是隨著惡性腫瘤的增加,惡性胸水不斷增多。 細胞蠟塊的普及對提高惡性胸水的診斷有很大的幫助。 胸水細胞蠟塊具有可重復性、 觀察性高及特異度強等優點, 目前在國外許多國家已成為細胞學常規診斷技術[5]。 細胞蠟塊結合免疫組化抗體的應用能提高惡性胸水的檢出率并進一步判斷其組織來源[6-7]。

圖1 血清CEA 和胸水CEA 診斷肺腺癌的ROC 曲線
本研究共入選了189 例惡性胸水標本, 結合HE 切片觀察、 患者病史及免疫組化 Napsin A、TTF-1 及CK7 等結果綜合分析, 我們進一步評估Napsin A、 TTF-1 及CK7 對肺腺癌與其它惡性腫瘤的鑒別能力, 我們將患者分為肺腺癌組和非肺腺癌組, 結果表明, 在本組155 例肺腺癌所致的胸水中Napsin A 敏感度為83.9%, 特異度為93.9%。Napsin A 是一種顯著表達于肺和腎臟的天門冬氨酸蛋白酶, 是肺腺癌的一種標記物[8]。 Napsin A 在肺腺癌中的表達與組織學類型和分化程度具有相關性[9], 在原位腺癌、 微浸潤腺癌及貼壁型肺癌中100%表達, 但是在浸潤性粘液腺癌中陽性率不到50%, 因此當一個浸潤性粘液腺癌所致的胸水中Napsin A 可能是陰性表達, 這時與TTF-1、 CK7進行組合診斷更具有診斷價值, 也能避免一部分表達Napsin A 的腫瘤如乳頭狀透明細胞腎細胞癌[10]及卵巢透明細胞癌[11]的誤診。 本研究中出現了1 例卵巢透明細胞癌轉移至胸水, 出現了Napsin A 及CK7 陽性、 TTF-1 陰性表達情況, 結合病史可以避免診斷為肺腺癌細胞的可能。
TTF-1 又稱為甲狀腺轉錄因子, 主要分布在成人的內胚層分化甲狀腺濾泡細胞呼吸道II 型肺泡上皮等, 屬于II 型肺泡的特異度標志物, 可用于肺腺癌診斷。 在排除甲狀腺癌后的 TTF-1 的表達水平可作為肺癌的一項特異度標志物, 將TTF-1 和其他抗體聯合檢測, 可對肺腺癌等進行確診。文獻報道TTF-1 在肺腺癌所致的胸水敏感度在79.2% ~92.6% 之間[12-13]。 本研究的 TTF-1 敏感度為93.5%, 略高于文獻, 可能與本研究中非肺源性腫瘤例數較少有關。 本研究顯示TTF-1 在肺腺癌所致的胸水特異度為90.9%, 與文獻報道[14]的71.1% ~90%相符, 表明在鑒別惡性胸水來源時TTF-1 是個較好的指標。 在本組155 例肺腺癌所致的胸水中Napsin A 敏感度及特異度均較TTF-1 低。 這與Turner 等[15]報道在肺腺癌中表達相符。
CK7 屬于角蛋白的一種亞型, 一般情況下,主要表達于肺、 乳腺、 卵巢等上皮處, 在2014 版專家共識[9]中表明CK7 在肺腺癌中100%表達, 敏感度極高; 但是特異度較低。 本研究中表明CK7診斷肺腺癌的敏感度為98.1%, 特異度為42.4%,與共識是接近的[9]。 癌細胞在胸水中處于浸泡狀態, 存在一定程度的CK7 抗原丟失, 因此胸水細胞標本CK7 的表達較低。 CK7 在57.7%的非腺癌中陽性表達, 因此, 在肺腺癌鑒別診斷中, 不宜單獨使用, 應該聯合其他特異度較高的抗體。
然而三者均具有較高的敏感度, Napsin A 和TTF-1 的特異度高達90%以上, 而CK7 的特異度較低, 因而根據指南將三者聯合應用, 能在最大程度上診斷出肺腺癌。
目前已有學者將腫瘤標記物CEA 用于肺腺癌的臨床診斷中, 有研究表明CEA 是肺癌的一個很好標記物, 且胸水檢測優于血清, 在肺腺癌顯著升高[16]。本研究對比了血清和胸水CEA 對肺腺癌組及非肺源性惡性胸水組織的鑒別診斷能力。 結果表明, 無論是胸水CEA 還是胸水CEA 在肺腺癌和其它惡性腫瘤的鑒別中均有統計學意義, 使用AUC 曲線測得血清CEA 的其診斷肺腺癌的參考值: 7.16 ng/mL; 胸水CEA 肺腺癌的參考值: 90.04 ng/mL, 與文獻[17]中的 (69.98 ±10.65) ng/mL 相近。
綜上所述, Napsin A、 TTF-1 及 CK7 在惡性胸水中具有重要價值, 三者的聯合應用能極大提高肺腺癌與其它惡性腫瘤來源胸水的鑒別能力, 同時胸水及血清的CEA 值可以做為一個鑒別診斷的參考依據。

