反應時間對鎂鋁水滑石制備及其吸附性能的影響
胡 盛,張明浩,胡衛兵
(湖北民族大學化學與環境工程學院,生物資源保護與利用湖北省重點實驗室,恩施 445000)
0 引 言
鹽酸四環素(tetracycline hydrochloride)是一種廣譜抗生素,其在生物體內吸收不完全被排出體外,且殘留在土壤環境中的鹽酸四環素因結構中含有萘酚環而不易被生物降解[1-2]。由于鹽酸四環素療效確切,在很多國家被廣泛使用。而近年來在醫藥、畜牧等方面的不恰當使用已導致鹽酸四環素大量進入土壤環境,對土壤產生毒性,對生態環境造成威脅[3]。由于吸附法過程簡單、經濟、高效、價廉等特點,成為處理鹽酸四環素廢水的有效途徑,常用的吸附材料主要有石墨[1]、沸石[3]、高分子球[4]、二氧化鈦[5]等。
水滑石是由帶正電荷的金屬氫氧化物層和帶負電荷的層間陰離子構成的層狀雙羥基金屬氫氧化物(layered double hydroxides,LDHs),是一類結構可調的特殊陰離子型層狀化合物[6],由于其組成可控、層板結構可調變、層間陰離子可交換和比表面積大等特點,具有很強的吸附能力,被廣泛用作催化、阻燃、吸附材料[7-9],但目前的研究報道主要聚焦在催化劑[7]和磷化合物[10]吸附,用于抗生素藥物的吸附報道較少。材料的組成、微觀結構決定了材料的宏觀物理化學性能,共沉淀法工藝簡單、反應易控制、設備要求低、易工業化生產,因此成為合成水滑石的常用方法[11]。制備過程中反應時間對水滑石晶體的形成、組成、微觀結構有重要影響,因此研究制備過程中反應時間對水滑石物相、微觀結構及其吸附性能對土壤污染治理和修復具有重要的現實意義。
本文在前期研究基礎上[12-13],以價格低廉的硫酸鎂和硫酸鋁為原料,尿素作沉淀劑,采用共沉淀法制備對鹽酸四環素具有較好吸附效果的鎂鋁水滑石,并通過XRD、SEM、FT-IR對沉淀產物進行結構表征,重點探討反應時間對鎂鋁水滑石物相組成、微觀結構和吸附性能的影響,初步建立水滑石對鹽酸四環素的吸附動力學和熱力學。
1 實 驗
1.1 主要原料
無水硫酸鎂,分析純,天津市福晨化學試劑廠;十八水合硫酸鋁,分析純,國藥集團化學試劑有限公司;尿素,分析純,西隴科學有限公司;鹽酸四環素,達美國藥典級,阿拉丁試劑公司;自制蒸餾水。
1.2 鎂鋁水滑石的制備過程
按nMg2+∶nAl3+=3 ∶1稱取MgSO4和Al2(SO4)3溶于50 mL蒸餾水,尿素用量與硫酸根的摩爾比(nCO(NH2)2∶nSO2-4)為4 ∶1,在反應溫度為383 K時,分別電動攪拌8 h、10 h、12 h、14 h,抽濾,蒸餾水洗滌后轉入烘箱,在353 K干燥,研磨即得不同反應時間的反應產物。
1.3 樣品的表征及性能測試
采用德國Bruker公司生產的D8 Advance型X射線粉末衍射儀對反應產物進行測試,測試條件:靶材Cu,管電壓40 V,管電流40 mA,掃描范圍為10°~80°,采用連續掃描,掃描速度為10(°)/min。
通過美國Thermo Nicolet公司產Avatar370型傅里葉變換紅外光譜儀,測試不同反應時間對反應產物官能團的變化,產物經過KBr壓片,測試的波數范圍為400~4 000 cm-1。
利用日本電子株式會社生產的JSM-6510LV型掃描電子顯微鏡,觀察不同反應時間反應產物微觀結構的演化,噴金處理,工作電壓為20 kV。
采用吸附率評價吸附性能,具體的測試方法參考文獻[13]。
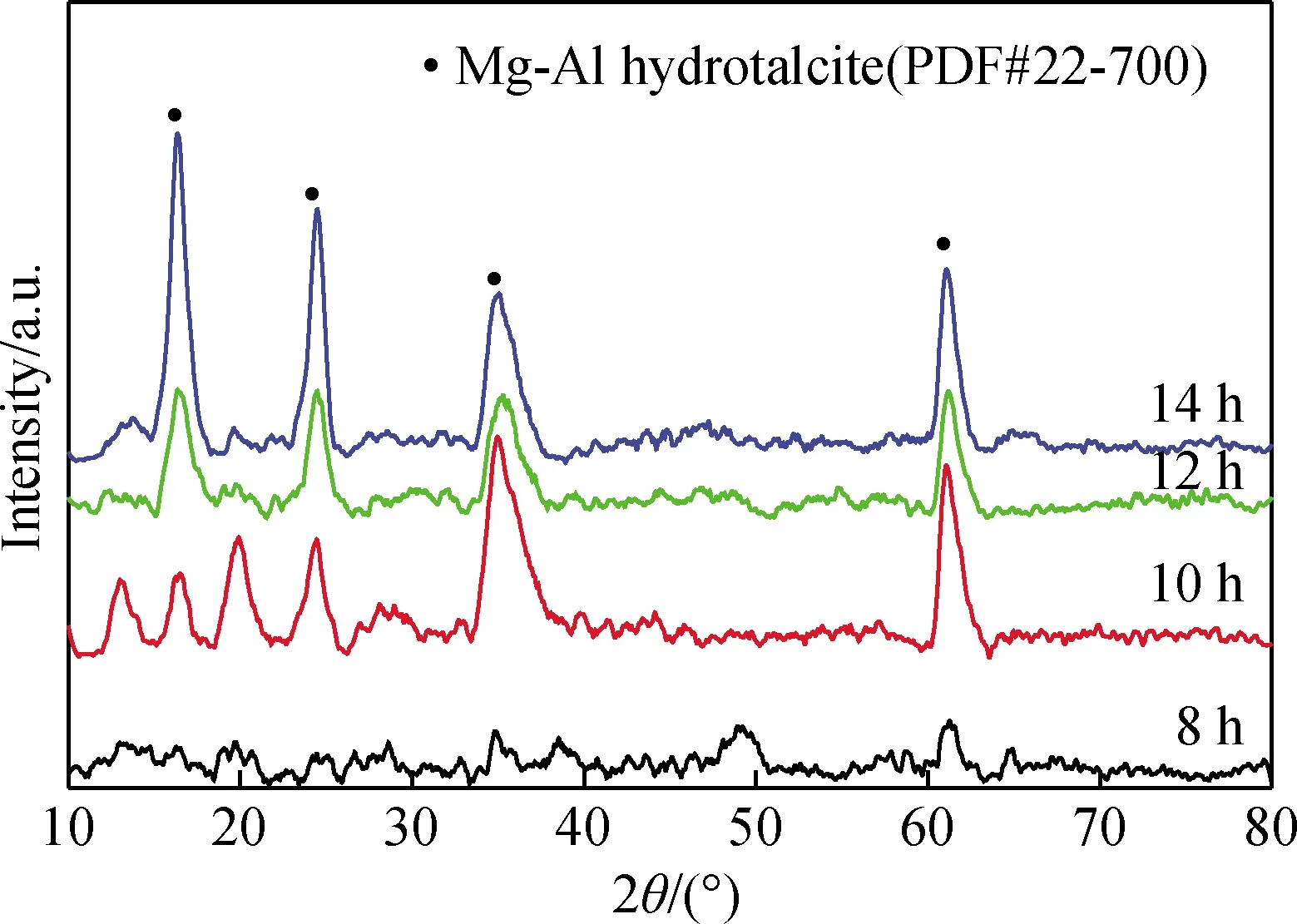
圖1 不同反應時間對產物XRD譜的影響Fig.1 Effect of reaction time on XRD patterns of products
2 結果與討論
2.1 反應時間對產物物相的影響
圖1為不同反應時間對產物物相組成的影響。從圖1可以看出,當反應時間為8 h得到的產物未出現鎂鋁水滑石(下文簡稱水滑石)特征衍射峰;反應時間超過8 h得到各產物在2θ為16°、24°、35°和61°附近均出現強烈衍射峰,分別對應硫酸根型鎂鋁水滑石的(003)、(006)、(009)、(110)晶面衍射峰,表明反應產物的主要物相為鎂鋁水滑石。但反應時間為10 h,反應產物具有明顯的雜質相,隨著反應時間的延長,產物的雜質相逐漸消失,水滑石的特征峰進一步增強且更加尖銳,這些結果表明,反應時間超過8 h才能形成水滑石產物,且在此基礎上延長反應時間,衍射峰的相對強度略有增加,峰型變得尖而窄,有利于水滑石的生長。
2.2 反應時間對產物FT-IR的影響
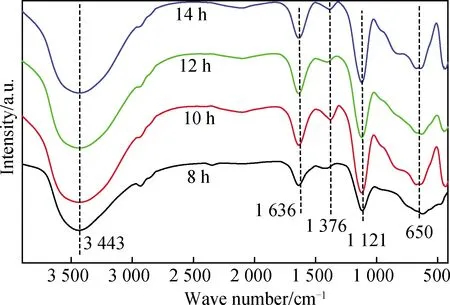
圖2 不同反應時間對產物FT-IR譜的影響Fig.2 Effect of reaction time on FT-IR spectra of products
圖2為反應時間對產物FT-IR譜的影響。由圖2知:不同反應時間的產物在3 443 cm-1處出現強烈的-OH伸縮振動峰;在1 636 cm-1附近為水分子的彎曲振動峰;在1 376 cm-1左右為尿素產生的CO2-3吸收峰;在1 121 cm-1和650 cm-1處的兩個吸收峰為SO2-4吸收峰[12]。同時發現:當反應時間為8 h時,產物在630 cm-1處的SO2-4吸收峰出現右移[13];當反應時間超過8 h后,反應產物在436 cm-1左右新出現了Mg-O和Al-O的特征峰[14]。表明反應時間為8 h時,有部分反應發生,但還未形成水滑石,超過8 h后,合成了水滑石,與XRD分析基本一致。
2.3 反應時間對產物微觀形貌的影響
圖3為反應時間對產物微觀形貌的影響。從圖3可以看出:反應時間為8 h的產物結構不明顯,有部分粉末化,表明反應不完全;當反應時間延長超過8 h,反應產物逐漸出現較規則的結構,且隨著反應時間的增加,水滑石的粒徑越來越大。

圖3 反應時間對產物微觀形貌的影響Fig.3 Effect of reaction time on SEM images of products
2.4 反應時間對產物吸附性能的影響
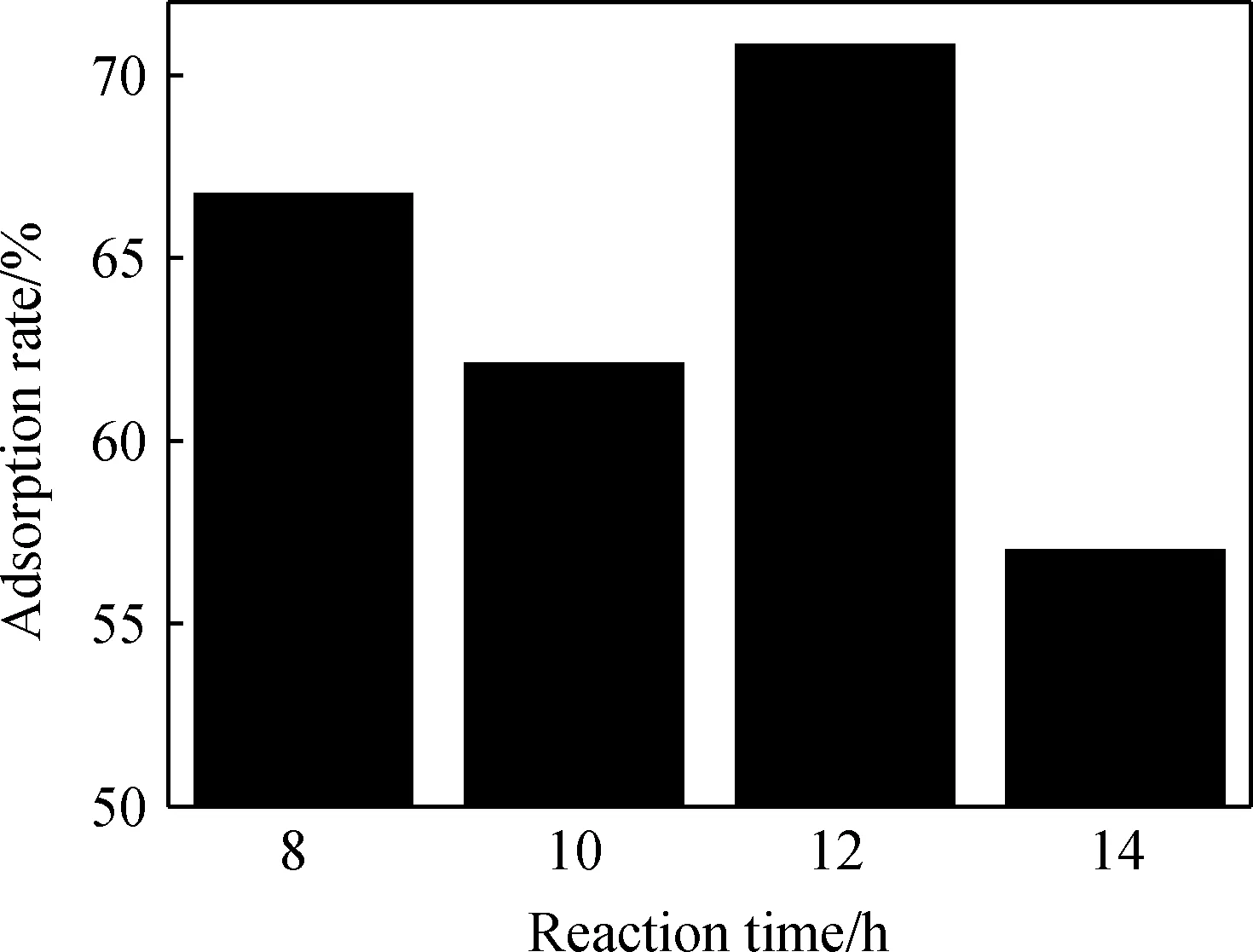
圖4 不同反應時間對產物吸附鹽酸四環素的影響Fig.4 Effect of reaction time on adsorption capacity of tetracycline hydrochloride of products
圖4為反應時間對產物吸附鹽酸四環素的影響。從圖4可以看出,當反應時間為8 h比反應時間為10 h和14 h生成產物的吸附性能好。結合XRD(圖1)和SEM(圖3)的分析,反應時間為8 h時,未形成水滑石,主要靠固體粉末的大比表面積來吸附鹽酸四環素,水滑石吸附主要取決于層間調控[13],當反應時間為12 h時,水滑石具有較好的結構調變、陰離子交換和大比表面積,此時對鹽酸四環素有最大吸附率,為70.82%。當反應時間增加到14 h時,隨著反應時間的延長,晶體結構漸趨于完成,粒徑增加,使得水滑石對鹽酸四環素的吸附性能下降。
為進一步證實水滑石吸附與層間調控密切相關,對反應時間為12 h制備的水滑石吸附鹽酸四環素前后的物相變化和紅外光譜進行了測試,其結果如圖5~6所示。從圖5可以看出,水滑石的晶型沒有被破壞。但水滑石的(003)、(006)晶面衍射峰吸附后衍射強度相對增強,均說明吸附的鹽酸四環素已進入水滑石層間[15]。
從圖6可以發現,水滑石吸附前后在3 440 cm-1、1 636 cm-1、1 376 cm-1、1 121 cm-1、650 cm-1、436 cm-1處吸收峰依然存在;水滑石吸附鹽酸四環素后在1 360 cm-1附近產生一個新的吸收峰,為鹽酸四環素上-CH3特征吸收峰,說明鹽酸四環素已被水滑石層間吸附。
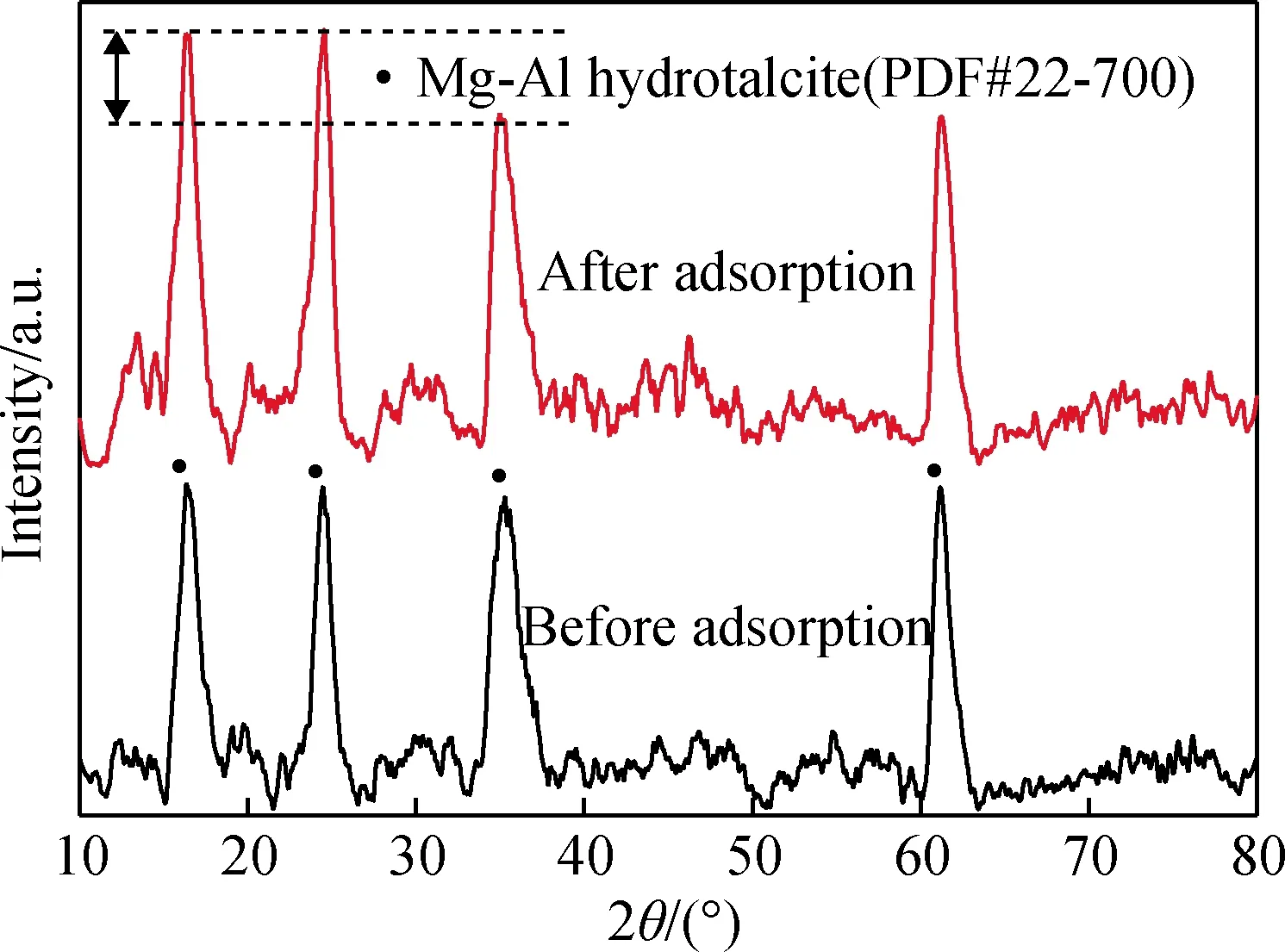
圖5 鎂鋁水滑石吸附鹽酸四環素前后的XRD譜Fig.5 XRD patterns of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
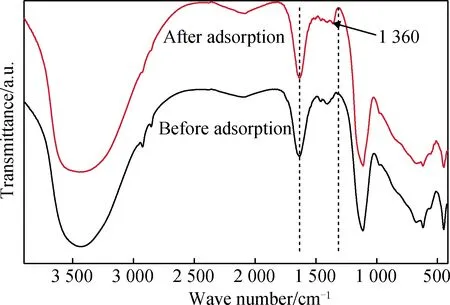
圖6 鎂鋁水滑石吸附鹽酸四環素前后的FT-IR譜Fig.6 FT-IR spectra of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
2.5 水滑石對鹽酸四環素的吸附動力學
在反應時間為12 h的條件下制備了水滑石,進一步研究水滑石對鹽酸四環素的吸附過程。分別用準一級動力學方程和準二級動力學方程(見式(1)~(2)),構建不同溫度下水滑石對鹽酸四環素的qt-t關系,并利用Origin軟件對其數據進行擬合,如圖7所示,擬合后的相關參數見表1。
ln(qe-qt)=lnqe-K1·t/2.303
(1)
t/qt=1/(K2·q2e)+t/qe
(2)
式中:qe為平衡吸附量,mg/g;qt為t時刻的吸附量,mg/g;K1、K2為常數。
從圖7可以看出,隨著溫度的升高,水滑石對鹽酸四環素的吸附等溫線越高,表明水滑石對鹽酸四環素的吸附是吸熱反應,升溫有利于吸附的進行。從表1動力學擬合相關系數可知,準一級動力學方程的擬合系數R2值更接近于1,表明水滑石對鹽酸四環素的吸附過程更符合準一級動力學方程,并且發現K1隨著溫度的升高而增大,再次說明升溫有利于吸附反應的進行。

圖7 鎂鋁水滑石對鹽酸四環素吸附速率擬合曲線Fig.7 Adsorption rate fitting curves of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
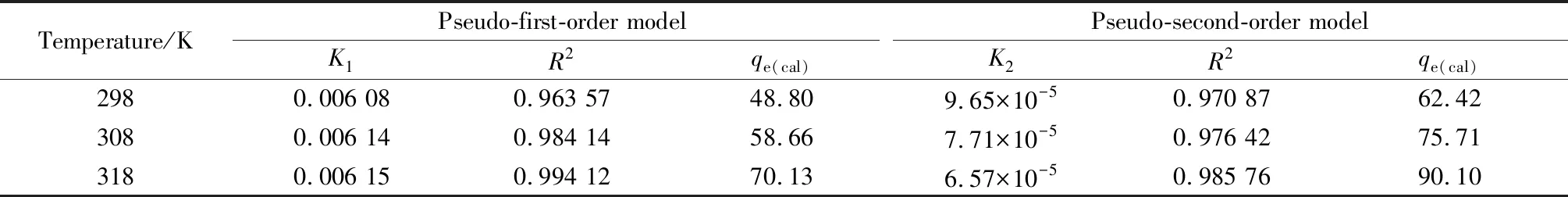
表1 水滑石對鹽酸四環素吸附動力學擬合相關系數Table 1 Adsorption kinetic fitting correlation coefficient of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
2.6 水滑石對鹽酸四環素的吸附熱力學
利用Langmuir等溫式和Freundlich等溫式(見式(3)~(4)),來評價水滑石對鹽酸四環素的吸附行為[16],如圖8所示,分別作不同溫度的水滑石的Langmuir等溫吸附線(即qe-Ce的關系曲線)和Freundlich等溫吸附線(即lnqe-lnCe的關系曲線)。
Ce/qe=1/(KL·qm)+Ce/qm
(3)
lnqe=lnKf+1/nlnCe
(4)
式中:qe為平衡吸附量,mg/g;Ce為溶液的平衡濃度,μg/mL;qm為理論最大吸附量,mg/g;KL、Kf、n為常數。
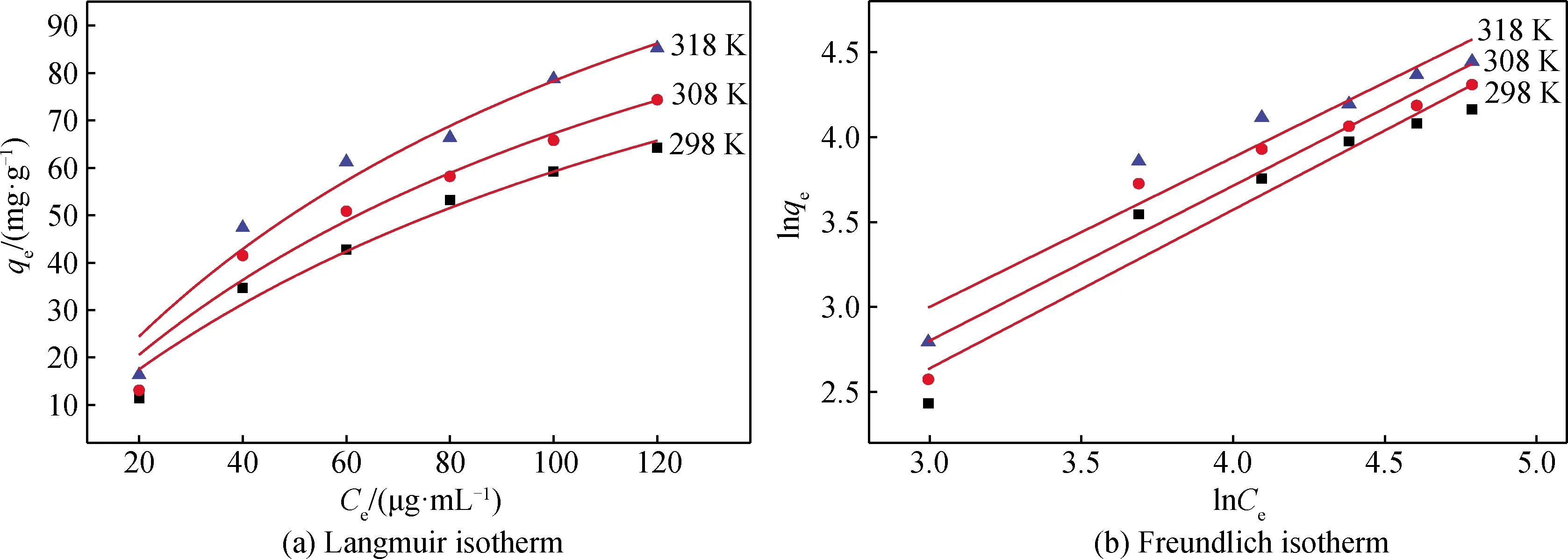
圖8 鎂鋁水滑石對鹽酸四環素吸附等溫線Fig.8 Adsorption isotherm of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
通過Origin軟件進行數據擬合,水滑石對鹽酸四環素在不同溫度下的吸附常數和相關系數見表2。從表2分析可知, Langmuir等溫式更適合描述水滑石對鹽酸四環素的吸附行為。
吸附熱力學參數有吸附自由能變(ΔGO)、吸附熵變(ΔSO)和吸附焓變(ΔHO),其相互關聯式有:
ΔGO=-R·TlnKL
(5)
ΔGO=ΔHO-T·ΔSO
(6)
lnKL=ΔSO/R-ΔHO/(R·T)
(7)
式中:ΔGO為吸附自由能變,kJ/mol;ΔHO為吸附焓變,kJ/mol;ΔSO為吸附熵變,kJ/(mol·K);R為氣體摩爾常數,R=8.314 J/(mol·K);T為熱力學溫度,K。
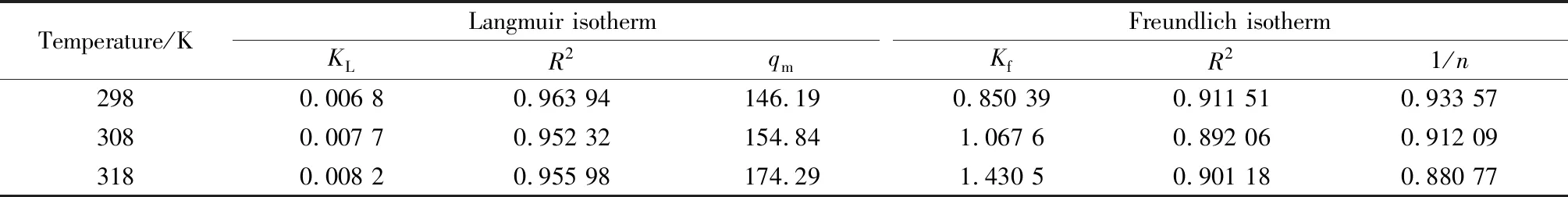
表2 鎂鋁水滑石對鹽酸四環素吸附常數及相關系數Table 2 Adsorption constants and correlation coefficients of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
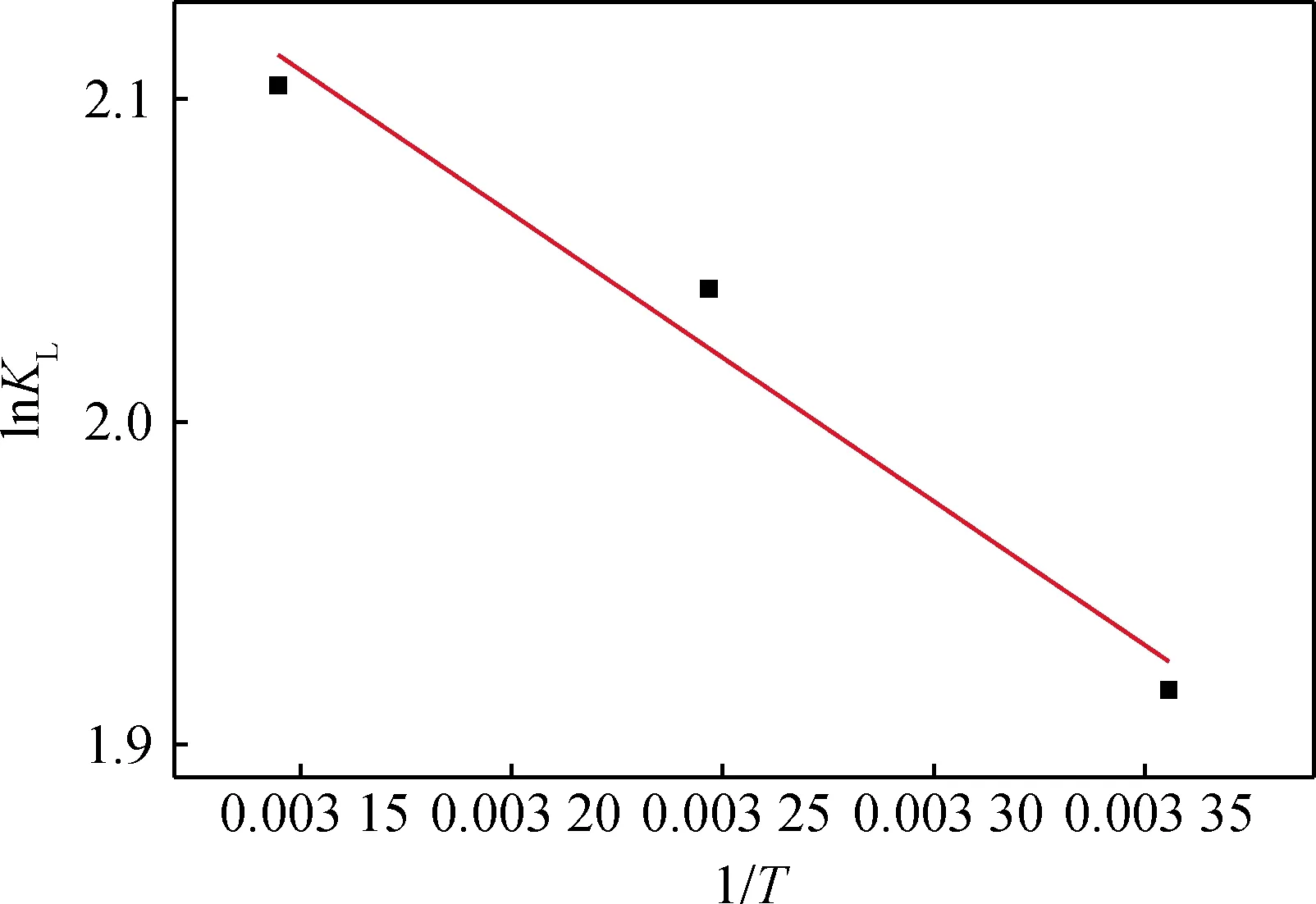
圖9 lnKL與T-1 的關系Fig.9 Relationship of lnKL and T-1
lnKL與1/T的關系見圖9,通過Origin軟件進行線性擬合,擬合曲線的R2為0.943 85,通過上述相互關聯式計算ΔGO、ΔSO和ΔHO,見表3。
一般情況下,范德華力引起的ΔHO為4~10 kJ/mol,氫鍵引起的ΔHO為2~40 kJ/mol,配位基交換的ΔHO為40 kJ/mol,偶極間作用力引起的ΔHO為2~29 kJ/mol,化學鍵作用力引起的ΔHO大于60 kJ/mol。水滑石對鹽酸四環素的ΔHO為7.40 kJ/mol,ΔSO為40.82 J/(mol·K),說明吸附過程以物理吸附為主,既有水滑石與鹽酸四環素的分子間氫鍵作用,也有水滑石層間調控后電子云改變[17]對鹽酸四環素的靜電吸附,且以靜電吸附為吸附主要作用力。從表3可知,ΔGO<0,說明水滑石對鹽酸四環素的吸附是自發過程,同時發現ΔHO>0,再次表明反應是吸熱反應,與試驗結果中溫度升高有利于吸附反應的分析一致。

表3 鎂鋁水滑石對鹽酸四環素吸附熱力學參數Table 3 Adsorption thermodynamic parameters of tetracycline hydrochloride adsorbed by Mg-Al hydrotalcite
3 結 論
(1)采用共沉淀法成功制備了硫酸根型鎂鋁水滑石。當反應時間為12 h時制備的水滑石對鹽酸四環素吸附效果較好,吸附率達70.82%。
(2)水滑石對鹽酸四環素的吸附過程更適合準一級動力學模型,物理吸附以靜電吸附為主,其吸附行為符合Langmuir等溫式,其ΔHO為7.40 kJ·mol-1,ΔGO小于0,ΔSO為40.82 J/(mol·K),該吸附是吸熱、自發過程。

