鐵基二元金屬氧化物超級電容器電極的研究
李 超,那 偉,張 磊*
(1.天津大學化工學院,天津 300350; 2.上海航天電源技術有限責任公司,上海 201112)
隨著工業化進程的不斷加快,化石燃料的消耗不斷攀升導致霧霾、全球變暖、能源枯竭等問題[1]。鑒于此,研究人員一直在積極尋找新型可再生能源,但是太陽能、風能、潮汐能等新型能源受天氣和季節影響有較大的局限性[2]。為了獲得持續穩定的能源供給,能源存儲和轉化裝置的開發備受關注。超級電容器,又名電化學電容器,具有充放電速度快、比功率大、循環壽命長、低溫性能優異等特點[3]。超級電容器的性能很大程度上取決于電極材料,因此設計和開發先進電極材料迫在眉睫。按電極材料的儲能機理分類,超級電容器可分為雙電層型和贗電容型,雙電層電容器依靠近表面的離子吸脫附,不發生體相擴散;贗電容器一般涉及法拉第過程,電極材料和電解液間發生氧化還原反應[4]。
近年來越來越多的電池型材料應用于超級電容器電極以期獲得更高的比能量[5]。很多研究報道將RuO2、Co3O4和NiCo2O4等金屬氧化物用于超級電容器電極,但是稀有金屬價格高、自然儲量有限、廢液往往有毒,因此自然界儲量較高的鐵元素受到了越來越多的關注。鐵基氧化物可以在多個價態間(Fe0/Fe2+/Fe3+)發生氧化還原反應,且具有成本低、環境友好的特點[6]。此外,鐵基氧化物不僅可以做正極材料,還可以做負極材料,具有較寬的負電位窗口。二元金屬氧化物是指含有兩種金屬元素組成的氧化物,也稱為雙金屬氧化物,當其中一種金屬元素是鐵元素時則構成鐵基二元金屬氧化物。和單金屬氧化物如Fe2O3、Fe3O4相比,鐵基二元金屬氧化物能夠結合2種金屬離子的氧化還原貢獻,具有更高的導電性,提供更豐富的電化學活性,從而獲得更高的電容性能。下面將從微觀結構調控、復合電極制備、一體式電極構建等方面詳細綜述鐵基二元金屬氧化物電極材料的研究進展。
1 鐵基二元金屬氧化物微觀結構調控
對于具有一定化學成分和晶體結構的材料,其微觀結構在較大程度上影響材料的比表面積和界面效應,因此設計有利于離子擴散、電子傳導的特定形貌材料可以大幅度提升電化學儲能特性[7]。反應體系的動力學參數是常見的形貌調控手段,例如反應時間、溫度和pH值等,添加表面活性劑、調整配位劑種類及改變反應溶劑等也是調控的常用方法。
1.1 形貌優化
Lin等[8]利用化學刻蝕技術對鐵基氧化物的形貌進行優化,使用液態肼刻蝕LiFe5O8塊體得到花球狀LiFe5O8,在刻蝕45 min后材料的比表面相比未刻蝕前增大112倍,比電容為278 F·g-1,利用同樣的刻蝕方法也可以制備得到珊瑚狀ZnFe2O4電極材料[9],圖1展示了反應前后的形貌對比。除刻蝕法外,還可以通過二次水熱或降低反應液濃度的方式增加表面粗糙度,從而大幅度提高材料的比表面積,從而提高材料的比電容。

圖1 刻蝕前后SEM對比圖[9]Fig.1 SEM images before and after etching[9]
此外,較多研究使用SDS、PVP、PVA、CTAB等表面活性劑作為軟模板劑,它們能夠吸附在顆粒表面,其產生的靜電排斥能夠削弱新顆粒的團聚效應,獲得片層自組裝結構,亦或通過配位效應導致各向異性的生長。分別添加上述4種表面活性劑可以在泡沫鎳上生長不同結構的CoFe2O4片層[10]。Fan等[11]通過改變表面活性劑CTAB的用量,采用一步水熱及熱處理合成了CoFe2O4納米顆粒、納米球、中空納米立方體及實心納米立方體,其中中空立方體性能最優,容量為1 313.06 F·g-1,但倍率性能有待提高。Gao等[12]通過使用不同沉淀劑制備具有不同微觀結構的NiFe2O4,以尿素做沉淀劑得到納米片狀的NiFe2O4,而醋酸鈉為沉淀劑時NiFe2O4呈現納米顆粒,由于納米片比表面積更大因而具有更高的比電容。不同絡合劑的配位速度不同,借助這一特點,Vadiyar等[13]開發了一種在柔性不銹鋼網上生長ZnFe2O4的方法,當僅添加MEA(單乙醇胺)時,產物呈現片狀陣列,僅添加BGBE(鷹嘴豆提取汁)時基底生長碳顆粒,同時添加2種絡合劑可以組裝ZnFe2O4/C顆粒附著的三維ZnFe2O4片層。該柔性電極在彎曲、旋轉后不影響使用,其作為負極與rGO正極組成的器件比能量可達81 Wh·kg-1。
1.2 尺寸調整
材料尺寸變化還可以通過調控粒徑和片層厚度得以實現,降低粒徑可以充分發揮材料的納米效應,成倍地增加活性位點。Saravanakumar等[14]采用簡單的溶劑熱法獲得了球形單分散的CuFe2O4納米粒子,通過提高沉淀劑KOH的濃度能夠降低CuFe2O4尺寸至20 nm,進而使得比電容提升20%。研究還發現在制備ZnFe2O4時,pH值升高同樣能導致顆粒尺寸顯著下降,從而提升電極性能[15]。以上現象可能是由于堿性越強,成核速度越快,導致粒徑縮小。Wang等[16]考察了pH值對NiFe2O4合成的影響,發現在pH值為10的條件下,微粒分散性好、粒徑合適、電極性能最佳。
Zhu等[17]制備了MnO2片層附著的CoFe2O4納米管,如圖2所示,MnO2的片層厚度和表面空隙率可由KMnO4濃度調控。PVA-KOH膜與該材料組成的全固態超級電容器工作電壓高達1.7 V,比能量為93.6 Wh·kg-1,性能提升較為明顯。與此同時,沉淀劑濃度、反應時間、反應溫度等一系列實驗參數能夠調控CuFe2O4納米球的尺寸和形貌[18],為同類微觀結構氧化物的合成提供理論支持。

圖2 不同KMnO4濃度制備MnO2/CoFe2O4的SEM圖[17]Fig.2 SEM images of MnO2/CoFe2O4 prepared at different concentrations of KMnO4[17]
1.3 中空結構
中空結構功能材料的設計與合成為先進能源存儲器件的電極制備提供了嶄新思路。中空結構材料具有密度小、比表面積大、活性位點暴露充分、開放型孔道豐富等特點,該特殊結構有利于電極和電解液的有效接觸,能夠顯著增強反應動力學。
在研究中,通常采用模板法合成大小和形貌可控的中空結構,模板法又包括軟模板和硬模板,一般來說軟模板包括氣泡、膠束等,硬模板有硬碳、二氧化硅等,并在后期將硬模板選擇性去除[19]。
Zardkhoshoui等[20]設計了一種制備NiFe2O4中空球的方法,以DMF和乙二醇混合液為溶劑,1,4-苯二甲酸為配體,形成Ni-Fe金屬有機框架(MOF),利用熱處理過程的非均勻收縮可獲得蛋黃殼結構NiFe2O4,最后用石墨烯進行包覆。利用類似方法繼續制備NiGa2O4中空球,由rGO-NiGa2O4//rGO-NiFe2O4組成的器件的比能量為118.97 Wh·kg-1。Chu等[21]也構建了NiFe-MOF,發現有機配體的分解導致了中空立方結構的形成,將產物進一步通過2次水熱以生長NiCo-LDH和rGO片層包裹的NiFe2O4-NiCo-LDH@rGO中空立方體,該結構提供了超多的活性位點,電極的比能量達750 C·g-1,可以應用于電化學傳感器領域。
Li等[22]以碳球為硬模板經陳化反應構建FeMnO3中空球,再與氧化石墨進行復合,中空結構有效改善了離子擴散,并提供離子“蓄水池”。電化學測試表明,該電極具有189 F·g-1的質量比電容。Jhajharia等[23]發現利用碳球和葡萄糖均能合成ZnO/ZnFe2O4蛋黃殼結構,且使用碳球作為模板時制備的材料直徑更小,隨后將ZnO/ZnFe2O4生長在復合石墨烯的鎳網上,圖3展示了該電極優異的循環穩定性和質量比電容。Wang等[24]報道了一種層數可控的CoFe2O4制備方法,通過調整水和乙醇的比例,能夠制備出1~4層的中空球結構,其中3層殼的CoFe2O4比表面積最大,電化學性能最佳,該工作創新性的通過空腔體積的調控來進一步優化電極性能。
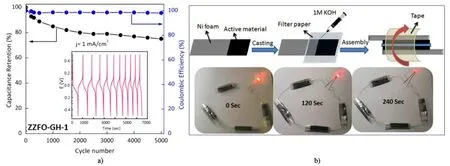
圖3 循環性能和器件裝配圖[23]Fig.3 Cyclic performance and device assembly steps[23]
此外,進一步縮小微粒尺寸,提高材料的均一性和分散性也是中空結構材料的重要研究方向[25]。復雜中空結構的構建通常比較困難,因此基于無模板或自模板的一步合成是未來的發展方向,同時相比于簡單中空結構,復雜中空結構如何發揮功能性優勢正在受到越來越多的關注。
2 鐵基二元金屬氧化物復合電極
鐵基氧化物較差的導電性導致其電極實際容量遠低于理論容量。例如Fe3O4電極的理論質量比電容高達2 299 F·g-1[6],但在眾多已發表的相關研究中,鐵基氧化物電極材料的質量比電容通常小于500 F·g-1,特別是在高質量負載下,離子擴散速率不足,實際質量比電容進一步降低。制備鐵基氧化物復合材料能夠發揮不同組分之間的協同效應,有效提高電極導電性及電化學性能,解決充放電過程中結構崩塌問題。常見的復合電極有碳材料、氧化物、氫氧化物和導電聚合物等。
2.1 碳材料復合電極
碳材料具有比表面積大、化學穩定性好、孔徑可調等特點。其中還原氧化石墨烯(rGO)、多壁碳納米管、活性炭是較常使用的碳材料。碳材料可以作為生長模板,構建三維分級自主裝材料。許多研究表明復合碳材料后,鐵基氧化物的分散性得以改善,粒子間團聚現象得到緩解并形成導電網絡,電極導電性大幅提高。此外,在復合材料制備過程中,添加某些少量碳材料即可顯著提高電極性能,比如在含有烏洛托品的NiFe2O4合成液中加入5 mg多壁碳納米管(CNTs)就可以合成比電容為1 291 F·g-1的超高性能復合電極[26]。
Yang等[27]將源于棉花的活性炭纖維浸泡在含有硝酸鋅和硝酸鐵的甲醇溶液中,合成的ZnFe2O4納米顆粒被限制在活性炭纖維上殘留的納米孔中。如圖4所示,此結構避免了材料團聚且提供了連續的電子和離子傳輸通路。與不添加纖維直接制備的ZnFe2O4相比,比電容和循環穩定性均得到增強。Zhang[28]的工作也體現了限域原理,他們使用微波輔助法合成了由高結晶度ZnFe2O4、大片石墨烯、超小石墨烯構建的雙石墨稀網格,該材料豐富的彈性緩沖空間可以適應體積變化,并且擁有較短的Li+擴散路徑,電極比容量高達1 257 mAh·g-1。
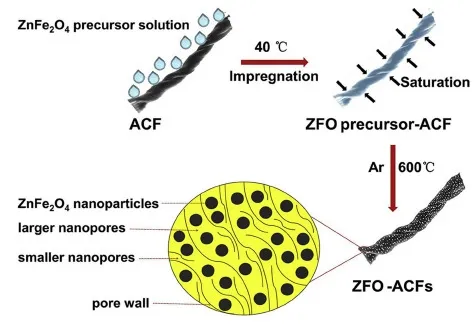
圖4 ZnFe2O4制備過程示意圖[27]Fig.4 Schematic illustration of the procedure for preparing ZnFe2O4[27]
生物質碳材料來源豐富、綠色環保,體現了物質循環利用的優勢,Fu等[29]以蟹殼為原料制備多孔碳材料,實驗表明復合材料中CoFe2O4組分的質量百分比為75%時性能最佳,質量比電容為739.4 F·g-1。
Chandel等[30]利用原位共沉淀法制備CuFe2O4/rGO納米復合材料,在2 A·g-1電流密度下,比電容為797 F·g-1,經過2 000次循環,容量保持率為92%。Mishra等[31]將聲化學應用在FeVO4/rGO的合成,在0.5 mA·cm-1電流密度時,比電容為97.5 F·g-1,另外他們通過DFT仿真明確了上述電極材料的雜化結構和電子特性。Chodankar等[32]使用CoFe2O4修飾rGO薄片的構建策略,基于氧化物和rGO很強的化學結合,電極在負電位處具有1 710 F·g-1超高比電容,適合作為不對稱超級電容器負極。Tabrizi等[33]利用改良的Hummer法,制備含有錳離子的蠕蟲狀氧化石墨分散液,后經沉淀反應和還原過程獲得MnFe2O4/rGO納米復合材料,在 6 mol/L KOH 水溶液中得到271 F·g-1的比電容。在5 000次循環后,電極持久穩定,容量保持率為104%。上述工作旨在利用rGO提高導電性,增大電極材料和電解液的接觸面積,改善電極材料在循環過程中的穩定性。引入rGO還可以增加材料表面活性位點并拓寬電位窗口,基于rGO修飾的FeMoO4電容器的電壓可達1.8 V[34]。
借助碳材料可交聯、易成膜的特點,研究人員制備了可直接作為電極片的碳基復合材料。Zhang等[35]使用凝膠法制備固定著極細NiFe2O4立方體的石墨烯宏觀體,經冷凍干燥切割可直接成為電極片,不需要添加黏合劑從而降低內阻,基于該電極組裝的全固態柔性器件電壓可達1.8 V,比能量為62.5 Wh·kg-1并且在彎曲狀態下穩定。Athika等[36]借助濕化學燃燒法,在甘氨酸溶液中合成Ni/NiFe2O4@C復合電極,該電極中Ni與NiFe2O4的協同效應能夠增強導電性同時提升氧化還原活性,比能量突破62 Wh·kg-1。Yang等[37]報道了一種被rGO包裹的ZnFe2O4@C核殼材料,利用這種材料構建的ZnFe2O4@C/rGO//AC鋰離子電容器最大比能量為174 Wh·kg-1,其增強歸因于氧化物和碳材料間的C—O—M鍵。Geng等[38]采用溶劑為戊醇和環己烷的微乳液法,合成MnFe2O4@C納米線。原位碳涂層能夠提高材料的導電性和孔隙率,MnFe2O4@C電極在0.1 A·g-1時比電容為824 F·g-1,由MnFe2O4@C//AC組成的器件比能量和比功率分別為27 Wh·kg-1和290 W·kg-1。Su等[39]使用DMF作溶劑,以錳鐵羰基化合物、氧化石墨為原料,通過簡單溶劑熱合成MnFe2O4量子點修飾的氮摻雜石墨片層,其結構類似火龍果片,活性物質負載量高,比電容可達905 F·g-1。
由此可見,碳基材料和氧化物之間的協同作用是相互的,碳基材料提供骨架加速離子遷移的同時,氧化物顆粒優化了碳材料的層間距和體密度并且含有碳材料的復合物具有更寬的工作電壓,較復合貴金屬化合物也具有更低的成本。
2.2 氧化物/氫氧化物復合電極
將鐵基氧化物和其他具有氧化還原活性的過渡金屬氧化物、氫氧化物等進行復合有以下優勢。首先,材料結合產生的雜質能帶效應可以提高導電性,2種都具有法拉第電容的組分間發生協同效應,可以展現更高的電極性能。另外,鐵基氧化物和客體氧化物之間可以形成核殼類異質結構,產生界面效應,為電化學反應提供更多活性位點。
Khan等[40]使用低溫共沉積法合成CuFe2O4-Fe2O3復合材料,與同種方法制備的純CuFe2O4相比,質量比電容提升了16倍。如圖5所示,電極性能的提升主要依靠原子配位結構的改變以及Cu2+和Fe3+離子間的氧化還原耦合效應。
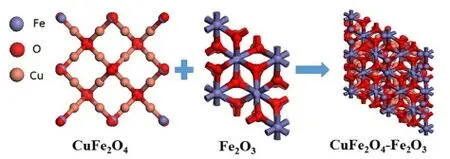
圖5 CuFe2O4-Fe2O3形成過程中原子結構變化圖[40]Fig.5 Diagram of atomic structure changes during CuFe2O4-Fe2O3 formation[40]
He等[41]構建分級核殼結構的FeCo2O4@NiCo-LDH納米線,得益于獨特的異質結構和界面作用,電極比電容可達2 426 F·g-1,組裝的全固態柔性器件具有94.9 Wh·kg-1的高比能量。Wang等[42]成功合成了Co(OH)2@FeCo2O4納米復合電極,在1 A·g-1時比電容為1 173.4 F·g-1,循環穩定性優異。Chang等[43]在合成NiFe2O4時不額外添加鎳鹽,以硝酸鐵為氧化劑,對硝酸鐵的添加量進行優化,最大面積比電容可達1.43 F·cm-2。
如圖6所示,Gopi等[44]先在Ni網表面涂刷導電石墨油墨再通過水熱反應構建ZnFe2O4-MnFe2O4/Gink電極,其比電容可達537.96 F·g-1。Zhu[45]和Lin等[46]分別在碳布和泡沫鎳表面生長CoFe2O4@MnO2核殼型納米片層陣列,前者使用3 mol/L KOH水溶液,后者使用PVA-LiCl凝膠電解質,2者比能量均約為22 Wh·kg-1。Liu等[47]利用兩步水熱法在泡沫Ni基底上構建分級ZnFe2O4@MnO2納米片陣列生長在ZnFe2O4表面的MnO2呈現蜂巢狀,提供了超大的電化學反應面積。制備具有特殊結構的復合材料可以改善電荷轉移的效率,多種組分間以化學鍵的形式有機結合,機械強度高,可以避免額外添加聚合物黏結劑。
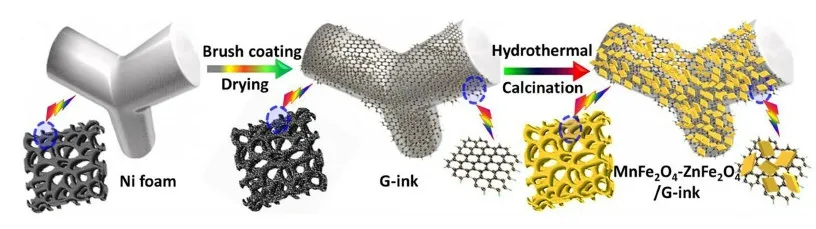
圖6 泡沫鎳表面生長菱形Mn-Zn-Fe-O/G-ink納米片原理圖[44]Fig.6 Schematic of the fabrication for rhombus-like Mn-Zn-Fe-O/G-ink nanosheets on Ni foam surface[44]
2.3 導電聚合物復合電極
導電聚合物主鏈上存在共軛堿系統,通過摻雜/去摻雜行為儲存電荷,其具有導電性好、環保、易合成和低成本等特點。導電聚合物可以優化復合材料的電子結構也可以作為支撐體緩解材料在充放電時發生的體積變化[48]。聚苯胺(PANI)的合成需要低溫環境,研究人員一般在冰水浴中合成PANI復合材料,解決純導電聚合物在多次循環后能量大幅度衰減的問題。Nagaraj等[49]制備了NiFe2O4/PANI復合材料,在高電流密度下沖擊后仍能保持良好的循環穩定性,利用該電極制備的全固態柔性器件在折疊和壓力下表現出更高的比電容,說明其適用于可彎曲設備。
Lin等[50]采用原位沉積法制備多孔ZnFe2O4/PANI復合電極,氧化物粗糙多孔的特性能夠為聚合物提供附著位點,因此獲得較大的PANI沉積量。該電極在1 A·g-1電流密度下比電容為328 F·g-1。Ghadimi等[51]借助過硫酸銨和高氯酸制備MnFe2O4納米顆粒附著的聚苯胺纖維,800 ℃熱處理后,材料的氮元素質量分數高達8%,能夠顯著增強潤濕性,此外該結構構建了如圖7所示的電子和離子雙重快速傳輸通路,有利于加快電極的法拉第反應速率。
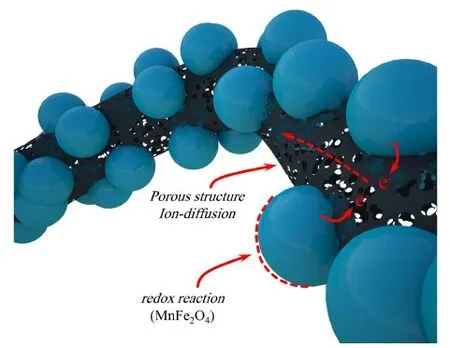
圖7 電極電子傳導和離子傳輸示意圖[51]Fig.7 Schematic of the electronic conduct and ionic transport process in the electrode[51]
聚吡咯(PPy)也是使用較多的一類導電聚合物,它含有豐富的親水性官能團,可以保證電極良好的潤濕性,有利于電解質離子擴散和運輸。如圖8所示,He等[52]制備了具有核殼結構的CoFe2O4@PPy納米線,PPy殼的厚度可以通過改變吡咯單體的聚合反應時間進行調控,經過6 h聚合反應的材料性能最佳,具有2 269 F·g-1的超高比電容。Thu等[53]合成rGO/MnFe2O4/PPy復合電極,PPy的質量分數為42.9%時具有最佳的協同效應,在0.5 A·g-1電流密度下質量比電容為147.2 F·g-1。Song等[54]將3,4-聚乙烯二氧噻吩和聚苯乙烯磺酸噴涂在生長有CoFe2O4納米顆粒的碳布表面形成具有三明治結構的復合電極,導電聚合物涂層可以有效防止CoFe2O4的脫落,在1 A·g-1電流密度下,該電極的質量比電容為472.5 F·g-1。Sankar等[55]合成CoFe2O4/rGO/PANI復合材料并作為超級電容器負極,CoFe2O4顆粒分散在氧化石墨片層間,緩解了氧化石墨層間堆積的問題,而聚吡咯能夠進一步提高復合電極的整體導電性,組裝的CoFe2O4/rGO/PANI//βCo(OH)2不對稱式器件的面積比電容為4.13 mF·cm-1。

圖8 a)CoFe2O4@PPy制備流程圖;CoFe2O4@PPy納米線的b)SEM 圖和c)~d)TEM圖[52]Fig.8 Flow chart of preparation of a) CoFe2O4@PPy, b) SEM image and c)-d) TEM images of CoFe2O4@PPy nanowires[52]
在構筑復合材料的過程中也經常用到元素摻雜手段來調控電極電勢、材料潤濕性、導電率。例如將復合材料浸于含有尿素和硫代硫酸鈉的水熱液中反應可獲得氮、硫雙元素摻雜的CoFe2O4@CNTs,質量比電容可提升近1倍[56]。摻雜元素不限于非金屬,當使用質量分數為2%的Zn離子摻雜MgFe2O4時,材料晶體結構和形貌均發生明顯變化,阻抗降低,比電容得以提升[57]。
表1總結了鐵基過渡金屬氧化物復合材料的測試條件和電化學性能,研究人員試圖降低堿液濃度,提高電壓區間至0.5 V以上,力求在循環5 000次充放電后仍有90%以上的容量保持率。
3 一體式電極的構建
構建具有導電基底的一體式電極能夠去除黏結劑、形成分級結構,并有利于柔性器件的組裝。常用的基底包括泡沫鎳、不銹鋼網、碳布等。柔性電極的制備及與固態電解質的結合,能夠獲得具有可拉伸、可穿戴、透明等功能的超級電容器。在水熱溶劑中添加尿素和氟化銨能夠在金屬基底表面生長片層陣列。Mohamed等[58]按照此種方案構建FeCo2O4/Ni一體式電極,在1 mV·s-1掃速下獲得433 F·g-1的比電容,將這種材料用于鋰離子電池陽極也獲得了較高容量。
Zhang等[59]采用兩步水熱與煅燒處理相結合的方法,制備了NiFe2O4@MnO2納米片陣列,電流密度為2 mA·cm-2時,復合電極的比電容為1 391 F·g-1,由NiFe2O4@MnO2//AC組成的器件的比能量為45.2 Wh·kg-1。Javed等[60]報道了使用低溫水熱法在碳紡布材料上生長分級介孔NiFe2O4納米錐,納米錐之間的開放空間便于電解質擴散。以LiCl為電解液,能夠緩解堿性溶液對設備的腐蝕以及爬堿現象,該電極組裝對稱式電容器的比能量為54.9 Wh·kg-1,3個串聯的器件可以點亮4枚額定電壓為2 V的LED小燈2 min,體現了實際應用的潛力。如圖9所示,Raut等[61]使用連續離子層吸附法(SILAR),在不使用表面活性劑或模板的情況下,將不銹鋼網依次浸泡在兩種陽離子和陰離子前驅溶液中,經過熱處理即可獲得ZnFe2O4薄膜。在1 mol·L-1KOH溶液中,電極比電容為471 F·g-1,采用PVA-LiClO4凝膠電解質組成的對稱式超級電容器的比能量為53.22 Wh·kg-1。
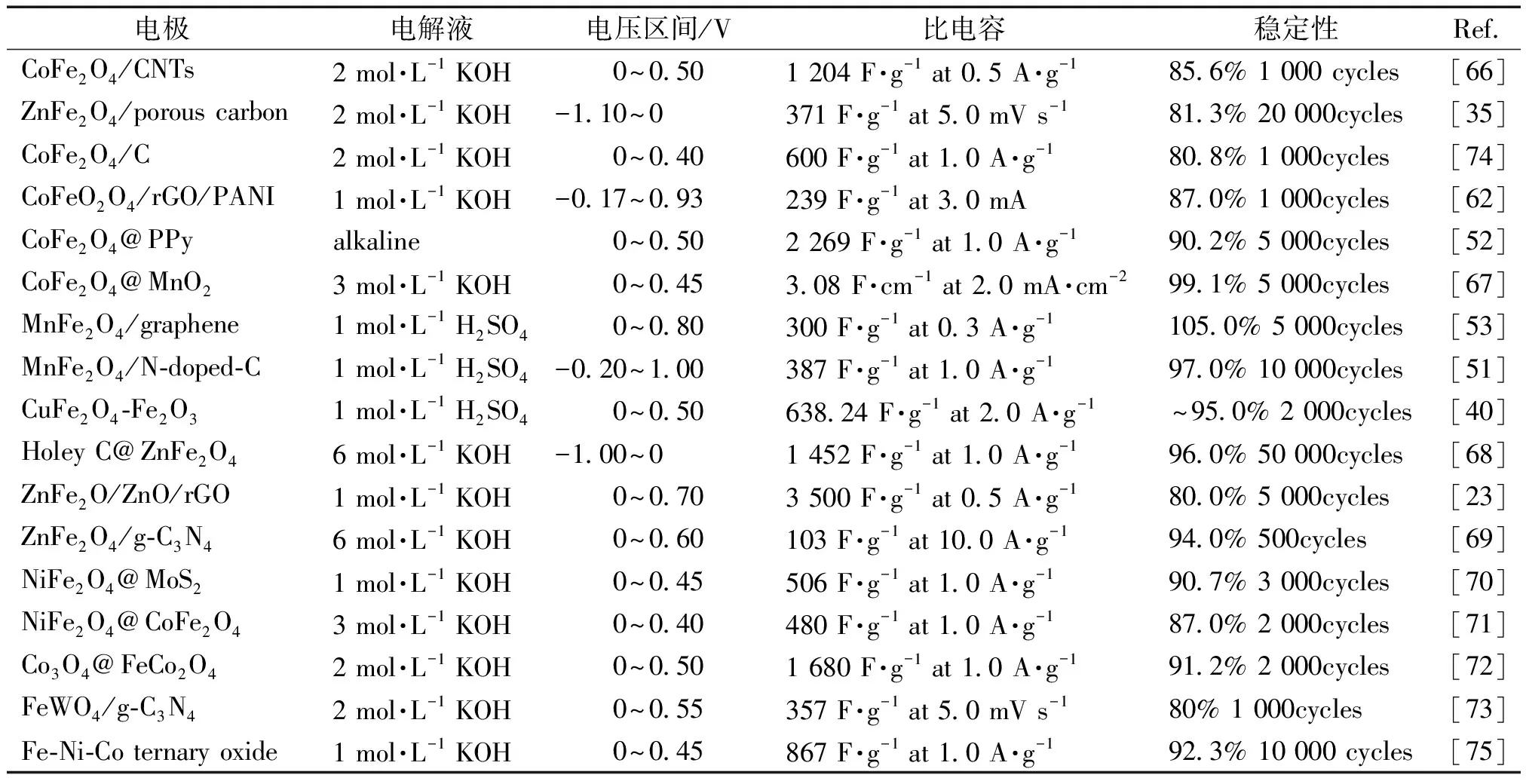
表1 鐵基二元氧化物復合材料的電極測試條件和性能參數Table 1 Comparison of test conditions and performance of iron-based binary oxide electrode
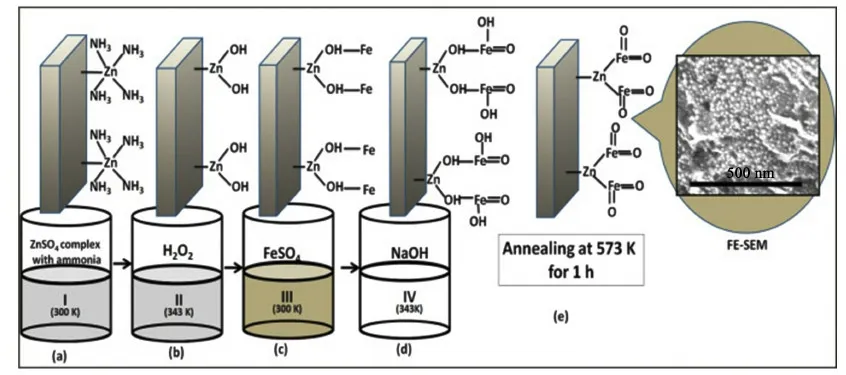
圖9 ZnFe2O4薄膜的構建原理圖[61]Fig.9 Schematic diagram of the fabrication for ZnFe2O4film[61]
柔性電容器的關鍵是制備具有足夠機械強度的柔性電極,如圖10所示,Cai等[62]通過簡單的溶劑熱法將MnFe2O4附著在石墨烯薄片上,再將分散液滴在作為集流體的石墨片層上烘干,以PVA-H2SO4為電解質,電極厚度僅227 μm。Zhao等[63]在碳砂芯表面生長有序大孔蜂窩狀NiFe2O4,結構穩定且便于離子傳輸,將2根涂覆PVA-KOH凝膠的砂線纏繞即完成纖維器件的組裝,比電容可達247 mF·cm-1,該器件可作為可穿戴設備的儲能單元。
不難發現,生長于基底表面的針狀、片層狀、管狀陣列常作為前驅體,通過對其進行表面成分調控、次級結構優化可形成穩定的三維網絡從而顯著改善離子擴散、降低接觸電阻[64-65]。
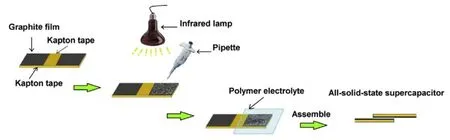
圖10 柔性全固態超級電容器制造工藝原理圖[63]Fig.10 Schematic diagram of the fabrication process of flexible all-solid-state supercapacitors[63]
4 總結與展望
作為超級電容器的電極材料,鐵基二元金屬氧化物已得到廣泛的研究。微觀結構調控能夠提高材料的比表面積,而復合電極的構建能夠顯著改善電極導電性。通過調配電解質類型和優化正負電極匹配能夠提高器件的工作電壓和性能,但在以下方面仍面臨困難和挑戰:1)鐵基二元金屬氧化物的電子結構和晶體結構調控對于電極電勢、穩定性和導電性的影響機理方面的研究仍有欠缺;可以借助計算和模擬,深入了解界面現象、晶體氧空位、電荷傳導對電極性能的作用機制,自上而下、有據可循地開展材料設計;2)鐵基過渡金屬氧化物的低電導率是影響電極性能的關鍵點之一,對此今后可采取部分硫化或硒化的方法改善電子結構進而提高電導率;3)鐵基氧化物的電化學窗口較低,通過調整金屬元素的比例可實現對電極電位的有效調控,提升晶體的本征電化學活性;4)近來NbFe2O4、SrFe2O4等鐵基氧化物逐漸應用在鋰離子電池等儲能器件,此類電極用于超級電容器領域的研究能夠成為新機遇。
此外,隨著便攜式移動電子設備、可穿戴電子產品領域的技術革新,超級電容器的相關創新研究將呈井噴式增長。超級電容器向柔性、微型化、纖維化等方向的發展會成為必然趨勢,這也將帶動柔性電極材料和柔性全固態電解質的同步發展。

