大黃對腦出血大鼠的腦保護作用
吳冬梅,趙 旭,汪 坤,楊艷華,崔應麟
1)河南省中醫院門診部 鄭州 450002 2)河南省中醫院藥學部 鄭州 450002 3)河南省中醫院腦病科 鄭州 450002
腦出血(intracerebral hemorrhage,ICH)是指非外傷性腦實質內的自發性出血,具有高發病率、高致死率和高致殘率的特點;ICH會引起腦血腫、腦水腫、顱內壓升高、腦損傷等一系列病理生理過程,其中腦損傷是引起ICH患者致死和致殘的關鍵因素[1],而且腦損傷后會引起行為學的改變。目前,ICH后腦損傷的治療措施有低溫保護、人工冬眠療法,其目的在于降低腦的基礎代謝而延緩病情發展;常用的治療藥物有腦細胞營養修復藥物,包括神經節苷脂、腦蛋白水解物(腦活素)和清除自由基藥物(依達拉奉),但以上藥物治療都屬于對癥治療[2]。中醫對ICH的病機、治法治則、用藥已經形成了成熟的體系[3]。有臨床研究[4]提示,中藥治療ICH具有整體治療、副作用小等優勢。因此尋求中醫藥治療ICH后繼發性腦損傷,對降低ICH致殘率、致死率具有重要意義。
有文獻[5-6]報道,含大黃的方劑大承氣湯和大黃素對腦出血大鼠均具有一定的腦保護作用。課題組的前期研究[7]也發現以大黃為君藥的醒腦灌腸液對ICH模型大鼠具有顯著的腦保護作用,說明大黃在ICH治療中具有重要的應用價值,但其作用機制尚不清楚。為此,課題組開展了如下研究,探討大黃對ICH模型大鼠的腦保護作用及機制,為大黃在ICH的臨床應用提供理論依據。
1 材料與方法
1.1實驗動物和主要儀器雄性Wistar大鼠,共200只,體重250~300 g,由北京維通利華實驗動物技術有限公司提供,合格證號SCXK(京)2016-0011。ZH-藍星D型動物腦立體定位儀(安徽正華生物儀器設備有限公司),CPA324S型電子天平(北京賽多利斯儀器系統有限公司),生物顯微鏡(日本奧林巴斯公司),全自動酶標儀[賽默飛世爾科技(中國)有限公司]。DYCZ-24DN垂直電泳槽、DYY-7C電泳儀電源、DYCZ-40電轉儀(北京六一儀器廠),磁力攪拌器(江蘇金壇市中大儀器廠),HI650離心機(湖南湘儀實驗室儀器開發有限公司)。
1.2主要試劑和藥物Ⅶ型膠原酶(美國Sigma公司),水合氯醛、多聚甲醛(北京索萊寶科技有限公司)、羧甲基纖維素鈉(CMC-Na,天津致遠化學試劑有限公司),依文思藍(Evans blue,EB;北京鼎國生物技術有限公司),RIPA裂解液、BCA蛋白濃度測定試劑盒(上海碧云天生物技術有限公司),谷胱甘肽(GSH)測試試劑盒(南京建成生物工程研究所)。兔抗人Nrf2抗體(武漢三鷹生物技術有限公司公司),TNF-α、IL-6、IL-4、IL-10和IFN-γ ELISA檢測試劑盒(武漢伊萊瑞特生物科技有限公司)。
大黃購自安徽普仁中藥飲片有限公司(批號1808043),經河南省中醫院黃小敏副主任藥師鑒定為蓼科植物藥用大黃的干燥根及根莖。大黃提取液的制備:體積分數75%乙醇回流提取2次(100 mL,80 mL),每次1 h,合并提取液,過濾,濃縮至質量濃度為0.9 g/mL。陽性對照藥安宮牛黃丸(北京同仁堂科技發展有限公司制藥廠,批號16011928),去除球殼,用5 g/L CMC-Na配制成含藥0.18 g/mL的混懸液。
1.3ICH大鼠模型的制備參考文獻[5]方法采用膠原酶注射尾狀核法復制大鼠腦出血模型,Longa5級評分法評價模型是否成功。
1.4分組及給藥實驗分組為空白組、假手術組、ICH模型組、安宮牛黃丸組、大黃組,每組20只(200只大鼠分兩批進行實驗,每批100只)。大鼠禁食24 h(避免大鼠頻繁排便,影響灌腸給藥),不禁水,清醒狀態下不固定(毛巾蓋住頭部使其保持安靜)進行灌腸給藥;將導尿管插入大鼠直腸,深度不超過4 cm,后端連接注射器吸取藥物并1 mL/min推注水浴加溫至30 ℃的藥液。
空白組(不造模,生理鹽水灌腸)、假手術組(按照ICH造模方法操作但不注射膠原酶,生理鹽水灌腸)、ICH模型組(造模,生理鹽水灌腸)、安宮牛黃丸組(造模,灌腸給藥安宮牛黃丸混懸液0.27 g/kg)、大黃組(造模,灌腸給藥大黃提取液3.60 g/kg)5個實驗組,每組設4個時間點進行實驗或取樣(每組每個時間點均為5只大鼠),各組動物灌腸1次/d。第一次灌腸后于12 h、24 h進行實驗或取樣,為12 h、24 h兩個檢測時間點;剩余大鼠繼續給藥2 d后、6 d后實驗或取樣,為3 d、7 d兩個檢測時間點。
1.5EB法檢測ICH大鼠血腦屏障的通透性參考文獻[7]方法,按照1.4項的操作方法,分別于給藥后12 h、24 h、3 d、7 d 4個時間點腹腔注射體積分數10%的水合氯醛(3 mL/kg)麻醉大鼠(第一批大鼠)并固定,然后按照4 mL/kg的劑量左側頸靜脈注射20 g/L EB,大鼠全身變藍后剖開胸腔,用注射針頭從左心尖插入肺動脈,固定針頭后剪開右心耳,生理鹽水沖洗右心耳直至流出液清澈,在冰盤上迅速斷頭取腦并自正中線切開,用濾紙吸干出血側腦組織表面的水分,稱腦組織的重量。腦組織放置于5倍體積的甲酰胺中,60 ℃水浴放置24 h,3 000 r/min離心10 min,取上清液,用分光光度計在620 nm處測定吸光度(以甲酰胺標準液做空白對照并做標準曲線),計算腦組織中EB含量(腦組織EB含量=樣品EB濃度/腦濕重)。
1.6大鼠腦功能損傷程度評分采用改良的神經功能損傷程度評分(modified neurological severity score,mNSS)對各組大鼠(第二批大鼠)腦損傷程度進行評價[6]。按照1.4項的操作方法,分別于給藥后12 h、24 h、3 d、7 d 4個時間點記錄每只大鼠的mNSS得分,分析每組大鼠神經功能損傷及恢復情況。
1.7大鼠血清中TNF-α、IL-6、IFN-γ、IL-4、IL-10、GSH含量的ELISA 法檢測按照1.4項的操作方法,分別于給藥后12 h、24 h、3 d、7 d后4個時間點每組各取5只大鼠(第二批大鼠),腹主動脈取血,離心后取上層血清,采用ELISA法檢測大鼠血清中GSH、TNF-α、IL-6、IL-4、IL-10和IFN-γ含量,具體步驟參照試劑盒說明書進行。
1.8大鼠腦組織中Nrf2蛋白表達的Western blot檢測1.7項中的大鼠采血后迅速斷頭處死,開顱并剝離、保留出血側腦組織,PBS沖洗干凈后進行總蛋白提取、濃度測定。取每個樣品的總蛋白40 μg加入電泳槽的上樣孔,進行電泳分離;將樣品凝膠中的蛋白轉印至PVDF膜(轉膜條件為GAPDH:200 mA 90 min;Nrf2:200 mA 120 min后300 mA 30 min);轉膜后室溫封閉2 h;加入一抗(GAPDH按1∶1 000稀釋;Nrf2按1∶600稀釋)4 ℃孵育過夜;封閉液洗滌PVDF膜6次,5 min/次;加入二抗(按1∶50 000稀釋)37 ℃搖床孵育2 h,封閉液洗滌PVDF膜6次,5 min/次。滴加ECL進行顯色,反應至熒光帶明顯后,吸去多余液體,覆上保鮮膜,X光膠片壓片后依次顯影、定影、沖洗膠片。晾干后掃描膠片,用BandScan 5.0軟件分析膠片灰度值。以目的蛋白條帶灰度值與內參GAPDH條帶灰度值的比值表示Nrf2蛋白的表示相對表達量。
1.9統計學處理采用SPSS 25.0進行數據分析,應用單因素方差分析比較各組大鼠及其不同時間點腦組織中EB含量,mNSS評分,血清中TNF-α、IL-6、IFN-γ、IL-4、IL-10、GSH含量以及出血側腦組織中Nrf2蛋白相對表達量的差異,檢驗水準α=0.05。
2 結果
2.1各組大鼠不同時間點血腦屏障的通透性的變化見表1。由表1可知,ICH模型組與假手術組比較,EB含量升高(P<0.05),說明ICH模型組大鼠血腦屏障通透性增加,3 d時達到峰值。與ICH組比較,安宮牛黃丸組大鼠腦組織EB含量降低(P<0.05),大黃組在12 h、3 d時大鼠腦組織EB含量降低(P<0.05)。
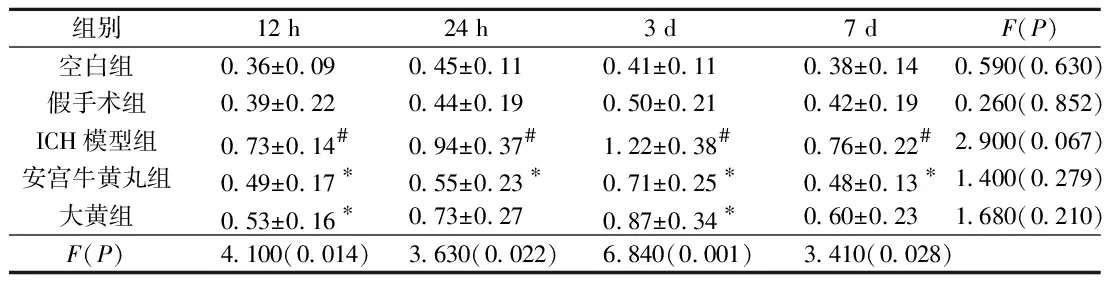
表1 各組大鼠不同時間點腦組織中EB含量比較(n=5)
2.2各組大鼠mNSS評分的比較空白組4個時間點mNSS評分均為0;假手術組12和24 h mNSS評分均為(2.24±0.39),3和7 d時mNSS評分均為0。其余3組mNSS評分見表2。由表2可知,ICH模型組mNSS評分升高,說明出血模型造模成功;且隨著出血的發展,mNSS評分升高,3 d時達到峰值。與ICH模型組比較,安宮牛黃丸組在4個時間點時大鼠的mNSS評分均降低(P<0.05),大黃組在3 d、7 d時大鼠的mNSS評分降低(P<0.05)。
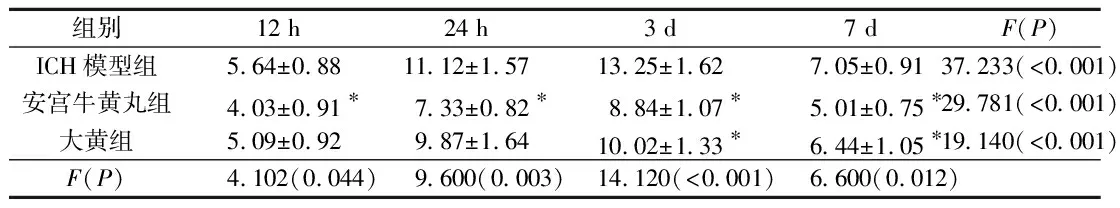
表2 各組大鼠不同時間點mNSS評分比較(n=5)
2.3各組大鼠不同時間點血清中TNF-α含量的比較見表3。由表3可知,與假手術組比較,ICH模型組大鼠4個時間點血清中TNF-α的含量均增加(P<0.05)。與ICH模型組比較,安宮牛黃丸組大鼠4個時間點血清中TNF-α的含量降低(P<0.05);大黃組在24 h、3 d、7 d時TNF-α的含量降低(P<0.05)。
2.4各組大鼠不同時間點血清中IL-6含量的比較見表4。由表4可知,與假手術組比較,ICH模型組大鼠4個時間點血清中IL-6的含量升高(P<0.05)。與ICH模型組比較,安宮牛黃丸組和大黃組大鼠4個時間點血清中IL-6的含量均降低(P<0.05)。

表3 各組大鼠不同時間點血清中TNF-α含量的比較(n=5) ng/L

表4 各組大鼠不同時間點血清中IL-6含量的比較(n=5) ng/L
2.5各組大鼠不同時間點血清中IFN-γ含量的比較見表5。由表5可知,空白組與假手術組比較,ICH模型組大鼠4個時間點血清中IFN-γ的含量增加(P<0.05)。與ICH模型組比較,安宮牛黃丸組和大黃組大鼠4個時間點血清中IFN-γ的含量均降低(P<0.05)。

表5 各組大鼠不同時間點血清中IFN-γ含量的比較(n=5) ng/L
2.6各組大鼠不同時間點血清中IL-4含量的比較見表6。由表6可知,與假手術組比較,ICH模型組大鼠血清中IL-4的含量在出血后12 h升高(P<0.05),然后隨著出血的進展,在24 h、3 d、7 d時IL-4的含量降低(P<0.05)。與ICH模型組比較,安宮牛黃丸組大鼠4個時間點血清中IL-4含量均升高(P<0.05);大黃組IL-4含量在3 d、7 d時升高(P<0.05)。
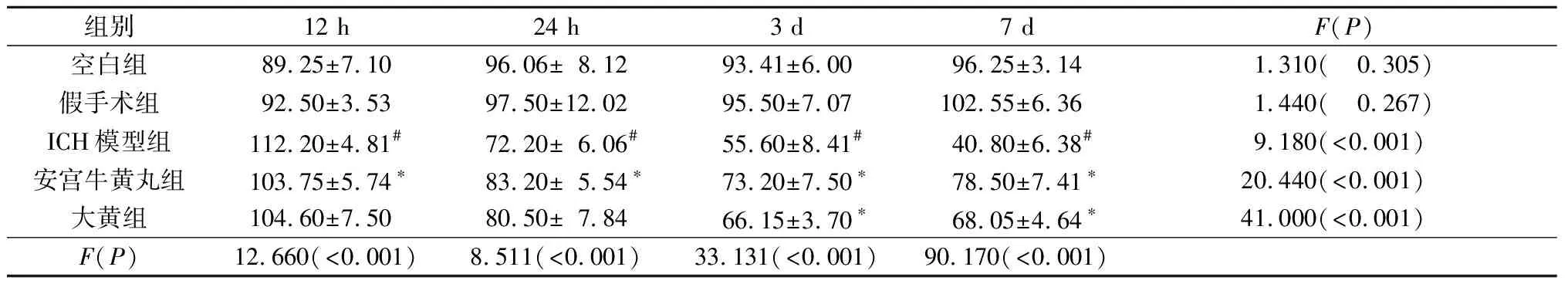
表6 各組大鼠不同時間點血清中IL-4含量的比較(n=5) ng/L
2.7各組大鼠不同時間點血清中IL-10含量的比較見表7。由表7可知,與假手術組比較,ICH模型組大鼠血清中IL-10的含量在出血后12 h是先升高,然后隨著出血的進展,在24 h、3 d、7 d時IL-10的含量降低(P<0.05)。與ICH模型組比較,安宮牛黃丸組和大黃組大鼠血清中IL-10的含量在24 h、3 d和7 d時升高(P<0.05)。
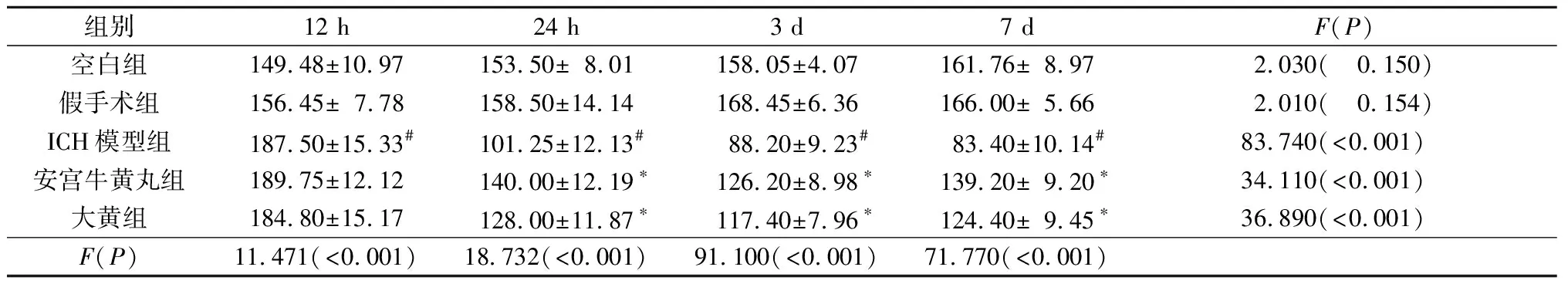
表7 各組大鼠不同時間點血清中IL-10含量的比較(n=5) ng/L
2.8各組大鼠不同時間點血清中GSH含量的比較見表8。由表8可知,與空白組相比,假手術組GSH含量差異無統計學意義(P>0.05)。與假手術組比較,ICH模型組大鼠4個時間點血清中GSH的含量降低(P<0.05),說明ICH過程中生成大量ROS,它能夠消耗GSH并使其水平降低。與ICH組比較,安宮牛黃丸組大鼠4個時間點血清中GSH的含量增加(P<0.05);大黃組大鼠血清中GSH的含量在24 h、3 d、7 d時增加(P<0.05)。
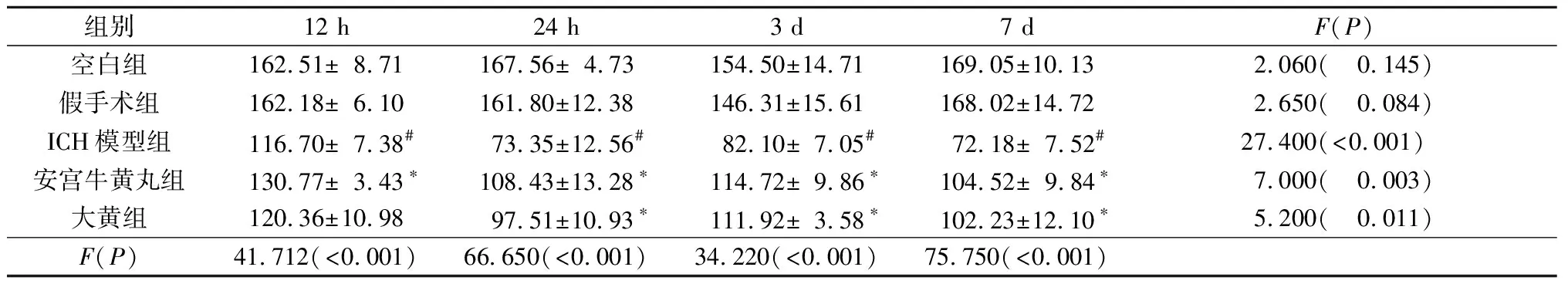
表8 各組大鼠不同時間點血清中GSH含量的比較(n=5) μmol/L
2.9各組大鼠不同時間點出血側腦組織中Nrf2蛋白相對表達量的比較見表9。由表9可知,與空白組相比,假手術組出血側腦組織中Nrf2蛋白的相對表達量差異無統計學意義(P>0.05)。與假手術組比較,在12 h、24 h、3 d、7 d時ICH模型大鼠出血側腦組織中Nrf2蛋白的相對表達量升高(P<0.05)。與ICH組比較,安宮牛黃丸組出血側腦組織中Nrf2蛋白的相對表達量升高(P<0.05);大黃組大鼠出血側腦組織中Nrf2蛋白的相對表達量在3、7 d時升高(P<0.05)。

表9 各組大鼠不同時間點出血側腦組織中Nrf2蛋白相對表達量的比較(n=5)
3 討論
現代藥理研究[8]表明,安宮牛黃丸可以通過抗氧化、抗炎等作用改善患者認知功能和神經功能,因此本研究中選擇安宮牛黃丸為陽性對照藥物。本實驗結果顯示安宮牛黃丸在大鼠ICH中表現出明確的抗氧化、抗炎效應,指標顯現相應的改變。大黃是我國常用中藥之一,具有清熱攻積、瀉火涼血、逐瘀解毒之功效,其主要活性成分為蒽醌類化合物,主要為大黃酚、大黃素、大黃素甲醚、蘆薈大黃素、大黃酸等。近年來,大黃及其活性成分對腦損傷的抗炎和抗氧化的作用研究越來越多:彭紹鵬等[9]采用自體血注入大鼠紋狀體建立腦出血模型,以大黃素干預,發現大黃素治療組能夠降低TNF-α的含量,抑制炎性因子的釋放,降低谷氨酸的表達水平,減輕腦出血后腦水;趙薇等[10]研究大黃酚對于腦缺血再灌注損傷的神經方面的保護作用時發現,大黃酚可以上調SIRT3的表達,增強SOD的抗氧化作用,增強抗細胞凋亡作用,下調AQP4的表達,進而減輕腦缺血后腦水腫的發生,發揮其對腦缺血再灌注的神經保護作用;畢勇志等[11]研究表明,大黃素可通過抑制 NF-κB信號通路,降低大鼠海馬組織中促炎性細胞因子如 IL-6、IL-1β和 TNF-α的水平,抑制腦組織的炎癥反應,發揮對局灶性腦缺血的神經保護作用。
血腦屏障(blood-brain barrier,BBB)是保持腦組織生理環境的重要屏障,可以有效避免腦組織被循環血液中的有害物質損害,對保持中樞神經系統的有效生理功能具有重要意義[12]。本實驗結果發現,大黃提取液干預ICH模型大鼠后,在3 d作用時間點可以有效降低血腦屏障通透性、改善mNSS評分,發揮了腦保護作用。
TNF-α、IL-6、IFN-γ均是腦出血后高表達的炎癥細胞因子,這些炎癥細胞因子在后續的繼發性腦損傷中發揮著重要角色,通過炎性浸潤激發基質金屬蛋白酶表達,破壞血腦屏障,進而引起神經細胞凋亡[13-14];抗炎細胞因子IL-4可以抑制TNF-α、IL-6的表達[15];IL-10能降低炎癥應激反應[16]。本實驗結果發現,大黃提取液干預ICH模型大鼠后,可以顯著上調IL-4、IL-10表達,下調TNF-α、IL-6、IFN-γ 表達,發揮抗炎作用。
ICH病理過程中發生的氧化應激反應是導致BBB破壞的重要機制[17]。氧化應激損傷與體內清除自由基的天然抗氧化物如GSH的消耗有關。ICH過程中生成的大量ROS能夠消耗GSH,使其水平降低,進一步削弱血腫組織的抗氧化能力。Nrf2是維護機體抗氧化與氧化平衡的重要因子,在受到氧化應激等刺激后激活,轉位到細胞核內,以Nrf2-Maf 的形式與ARE結合,通過相關激活程序,促使下游基因轉錄,常見的下游基因產物多是抗氧化物質,包括醌氧化還原酶、谷胱甘肽巰基轉移酶、谷氨酰半胱氨酸連接酶以及血紅素加氧酶1等,可有效對抗腦出血后的腦損傷[18]。本實驗結果發現,大黃提取液干預ICH模型大鼠后,可以上調ICH模型大鼠腦組織中Nrf2蛋白的相對表達量、增加血清中GSH含量,發揮抗氧化應激作用,減輕腦損傷。
總之,本研究結果顯示大黃可通過抗炎和抗氧化作用,起到保護血腦屏障的作用,從而發揮對ICH的腦保護作用。

