長鏈非編碼RNA通過ceRNA在乳腺癌中的調控機制
翟博雅,龔予希,楊野梵,張 響,張智弘
乳腺癌是全球女性腫瘤死亡的主要原因之一,其發病的分子機制復雜。長鏈非編碼RNA(long non-coding RNA, lncRNA)在很長一段時間內均被認為是一種“轉錄噪音”,近十年來隨著人們對非編碼RNA的認知深入,lncRNA在人體內的調控作用才逐漸被重視。研究發現lncRNA、mRNA、環狀RNA(circRNA)、假基因等通過競爭性內源性RNA(competing endogenous RNA, ceRNA)機制互相作用,形成ceRNA調控網絡,干擾許多因子的表達影響疾病的整體進程。本文現就lncRNA通過ceRNA調控機制在乳腺癌中發揮作用的研究進展進行綜述。
1 ceRNA調控機制
ceRNA假說由Salmena等[1]于2011年首次提出,假說以微小核糖核酸(microRNA, miRNA)為核心展開,其中心內容:除了傳統的miRNA對mRNA作用之外,還存在RNA調控miRNA作用方式,即RNA分子之間可以雙向調控。mRNA、lncRNA、假基因與真基因的基因組序列相似的非功能性DNA拷貝)等在體內并非處于互不干擾的狀態,而是可以通過某種特殊的“語言”進行交流。miRNA反應元件(miRNA response elements, MREs)是各種類型RNA上可以被miRNA結合的小片段序列,當mRNA、lncRNA、假基因上有相同的MREs時,它們就能夠和同一種miRNA結合,此時這些不同類型的RNA就可以競爭miRNA的結合位點,它們之間互為ceRNA。不同種類的RNA通過MREs這種新的“語言”相互“交流”,形成一張大規模ceRNA調控網絡,從而影響癌癥發生、物質代謝等一系列的生物活動。作為ceRNA網絡的中心,miRNA是一類長度約為22個核苷酸的非編碼RNA,其可以與靶基因的互補序列區域結合,從而降低靶基因的穩定性或者限制它們的翻譯[2];miRNA通常被認為是活躍的調控元件,當處于調控網絡中心的miRNA表達水平變化時,就會對上皮-間質轉化(epithelial-mesenchymal transition, EMT)、免疫調節、腫瘤微血管形成、細胞自噬、糖脂代謝、細胞分化等產生影響[3]。此外,該假說認為所有類型的RNA,如lncRNA、mRNA、circRNA、假基因均可以競爭miRNA,因此ceRNA并非是一種RNA類型,而是一種RNA調控機制(圖1)。

圖1 lncRNA、mRNA、circRNA、假基因均可以結合miRNA,彼此互為ceRNA
2 lncRNA與miRNA的互相作用機制
lncRNA是一類長度大于200 nt的不具有編碼蛋白質功能的RNA。lncRNA在細胞內發揮多種生命調控作用,如與轉錄因子相互作用參與轉錄調節、影響mRNA功能參與轉錄后調節及翻譯調控、修飾染色體參與表觀調節等,從而導致包括腫瘤等多種疾病的發生、發展[4-7]。
lncRNA常常在腫瘤和正常組織中差異表達,導致這種差異表達的因素很多[8-9]。當lncRNA作為ceRNA時,能夠與miRNA結合,“占用”其MREs。當體內lncRNA的含量升高時,所結合的miRNA增多,miRNA與下游靶基因的結合位點減少,下游靶基因表達增加;反之,當體內lncRNA表達水平降低時,靶miRNA上的結合位點空出,更多下游靶基因就能夠與該miRNA結合,體內能夠檢測到的下游靶基因含量就會減少。即有相同MREs的兩種RNA表達趨勢是一致的(圖2)。當RNA發揮這種作用時也被稱為“分子海綿”作用。值得注意的是,一個miRNA上可以存在多個RNA結合靶點,而一種lncRNA也可以和多種miRNA結合,此時涉及的基因更多,機制更加復雜[10]。ceRNA網絡中各因子的合作有助于協調許多生物學過程。若靶基因與lncRNA結合的miRNA或與lncRNA有相同MREs的RNA參與了疾病的發生、發展,那么lncRNA的含量變化就會影響疾病進程。

圖2 有共同MREs的RNAs表達趨勢一致
3 lncRNA通過ceRNA調控機制在乳腺癌中發揮的作用
WHO針對全球癌癥發病情況的報告指出:乳腺腫瘤是導致女性因癌癥死亡的常見腫瘤之一[11]。因此,對乳腺癌的病因、發病機制進行研究有著重要的意義。
3.1 ceRNA網絡在乳腺癌增殖、侵襲、轉移中的作用lncRNA在細胞內具有重要的調控作用,參與了腫瘤增殖、侵襲、轉移、遷移等過程[12](圖3)。Chi等[13]的研究結果表明,lncRNA SNHG5是乳腺癌中的致癌基因和潛在的乳腺癌預測標志物,其作為miR-154-5p的“分子海綿”,削弱了miR-154-5p對靶基因PCNA的抑制作用,加強乳腺癌細胞的增殖,提示了ceRNA在乳腺癌增殖中的作用。Yang等[14]發現雄激素受體(AR)陽性的三陰型乳腺癌患者預后比AR陰性患者更好,他們發現一種AR陰性誘導的lncRNA ARNILA,計算機預測和熒光素酶報告基因實驗均顯示ARNILA上存在miR-204的直接結合位點,miR-204能夠和參與乳腺癌EMT的Sox4結合,即ARNILA作為ceRNA使miR-204加強Sox4的表達;反之,敲降ARNILA減少了Sox4及其蛋白表達水平。通過間接調控Sox4,ARNILA參與了乳腺癌的EMT過程,并促進了乳腺癌的增殖、侵襲和轉移。癌細胞的動態可塑性介導腫瘤的轉移性,通過EMT和間質-上皮轉化(mesenchymal-epithelial transition, MET),癌細胞可以在上皮和間質兩種表型間轉化[15-16]。Zhou等[17]構建了小鼠自發轉移乳腺癌模型研究lncRNA H19對乳腺癌發生、發展的作用。作者發現H19在轉移性乳腺癌中高表達,小鼠GIT2基因是miR-200b/c的靶基因,而miR-200b/c對維持上皮表型有重要作用,作者用計算機分析和雙熒光素酶報告基因實驗均證實H19與miR-200b/c存在結合位點;當敲降H19后,miR-200b/c的豐度沒有改變,但減少了細胞中GIT2的表達。這些結果證實了H19作為ceRNA調控miR-200b/c在細胞中發揮作用。此外,作者還發現H19充當了不止一個ceRNA作用,其同樣可以與miRNA let-7結合,與GIT2和CYTH3互為ceRNA,調控癌細胞的EMT,影響乳腺癌的轉移。
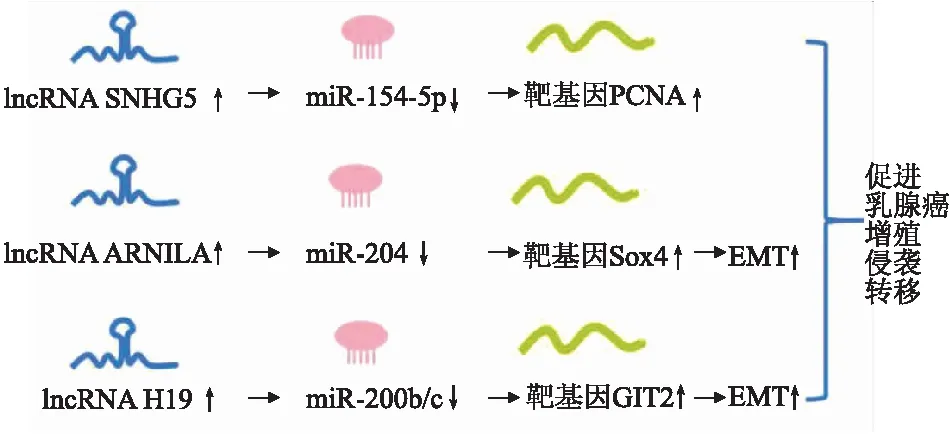
圖3 ceRNA網絡在乳腺癌增殖、侵襲、轉移中的作用
3.2 ceRNA網絡在乳腺癌耐藥中的作用手術治療是早期乳腺癌患者的一線治療方案,對于中晚期患者,藥物治療是必不可少的,但耐藥往往是導致患者預后不良的主要原因之一(圖4)。Dong等[18]發現,lncRNA TINCR在耐曲妥珠單抗乳腺癌患者中高表達,且與患者預后相關,其與HER-2互為ceRNA,共同競爭miR-125b上的結合位點,沉默miR-125b表達以促進HER-2表達,導致乳腺癌患者對曲妥珠單抗耐藥,同時促進癌細胞中EMT;敲降TINCER后miR-125b表達增加,HER-2表達降低。這表明TINCER可以作為miR-125b調節HER-2表達的“分子海綿”。研究還發現mRNA Snail-1同樣是miR-125b的下游靶基因,過表達miR-125b顯著抑制了乳腺癌細胞中Snail的表達;使用miR-125b抑制劑后結果相反,即在耐曲妥珠單抗過程中,mRNA Snail-1是TINCER/miR-125b的功能性靶點;lncRNA TINCER可能是HER-2陽性患者的潛在治療靶點。Gu等[19]發現,lncRNA GAS5在HER-2陽性患者和耐他莫昔芬乳腺癌細胞中低表達,其下調會導致患者預后變差。有研究[20-21]發現,miR-222是GAS5的下游靶標,且受GAS5的負向調控。通過競爭性結合miR-222,GAS5上調PTEN表達,而PTEN基因是已知的調控乳腺癌患者對他莫昔芬敏感性的藥物。敲降GAS5可以在乳腺癌細胞中下調拉帕替尼誘導抑制的PTEN表達,上調GAS5則可以使之通過分子海綿的作用調控miR-222加強對他莫昔芬等的敏感性。Yao等[22]發現lncRNA NONHSAT101069在乳腺癌組織和細胞中上調,且與miR-129-5p結合,miR-129-5p在乳腺癌組織中比癌旁組織含量更低;敲降NONHSAT101069后miR-129-5p的含量增加。Twist1是miR-129-5p的下游靶蛋白,其是調控EMT的關鍵因子且促進乳腺癌對表柔比星的耐藥、遷移、侵襲。實驗結果表明NONHSAT101069/miR-129-5p軸確實可以作用于Twist1,從而加強乳腺癌的耐藥。
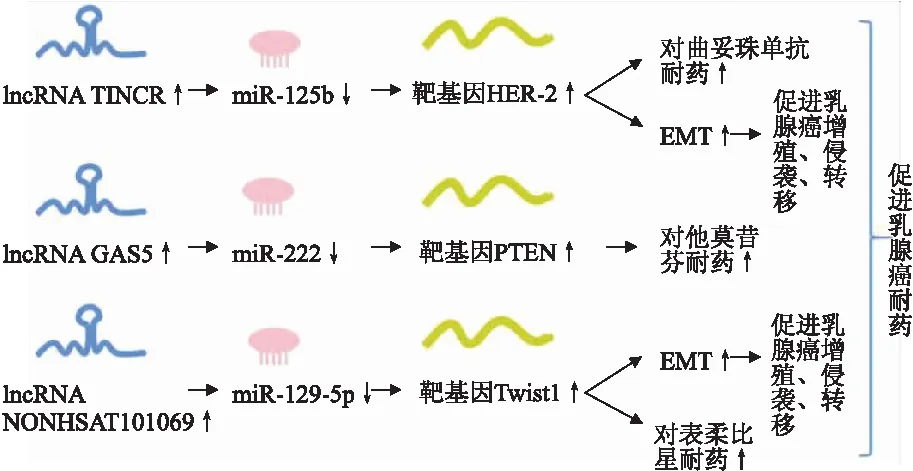
圖4 ceRNA網絡在乳腺癌耐藥中的作用
4 展望
Abdollahzadeh等[23]首次引入了“ceRnome”作為ceRNA研究的一個新術語,描述細胞或組織內所有參與病理生理過程的RNA分子的聚集現象,旨在說明各種分子作為一個整體影響疾病的發生、發展。lncRNA作為“分子海綿”在體內影響了眾多因子的表達變化,從而影響了包括腫瘤在內的許多疾病的進展。但lncRNA作為ceRNA網絡的意義不僅在此,Olgun等[24]對多名患者的基因表達譜進行數學分析和測試,發現lncRNA在不同亞型乳腺癌中會充當特定的海綿作用,將患者根據特定的ceRNA互相作用機制的表達模式分組,其生存分布差異有顯著性;而若僅僅依據參與ceRNA網絡的單個RNA表達情況進行分組,結果則無統計學意義。這表明ceRNA網絡有助于對乳腺癌進行新分型并進一步闡明各種亞型獨特的發病機制,該方法對于其他類型的腫瘤也具有借鑒作用,有廣泛的適用性。
雖然有大量實驗佐證了ceRNA網絡的重要性,但同樣不能忽視的是,對于ceRNA網絡也存在一些質疑的聲音[25]。對于ceRNA假說質疑的主要論點:單個miRNA靶標表達的任何變化都可能僅占靶標位點豐度的小部分,即單個lncRNA表達變化不足以抑制miRNA活性[26-27]。
總之,ceRNA網絡作為基因表達調節的可能機制被廣泛接受并得到了初步承認,發現新的RNA及其在疾病進程中的作用機制,對于發現新的腫瘤標志物和開發新藥物有積極作用,拓展了新的研究領域。隨著人們對lncRNA、miRNA、mRNA、假基因等功能的進一步探究,對于ceRNA的認識可能會更加客觀和全面。

