RNA N6-腺苷酸甲基化修飾在慢性肝病中作用的研究進展
申 敏,李余佳,邵江娟,2,3,張 峰,2,3,張自力,2,3,鄭仕中,2,3
〔南京中醫藥大學1.江蘇省中藥藥效與安全性評價重點實驗室,2.江蘇省中藥功效物質重點實驗室,3.中藥品質與效能國家重點實驗室(培育),江蘇 南京210023〕
肝是人體最大的器官,具有代謝解毒等多種生理功能。肝功能主要由肝細胞執行,肝細胞是肝中最主要的實質細胞,參與包括蛋白質、碳水化合物和脂質的代謝處理、異源化合物的解毒以及必需分子的分泌[1]。肝的非實質細胞包括膽管細胞(上皮細胞)、肝竇內皮細胞、肝星狀細胞、庫普弗細胞和其他免疫細胞包括淋巴細胞,通過旁分泌因子與肝細胞相互作用,調節肝功能。長期慢性肝損傷包括乙型肝炎和(或)丙型肝炎病毒感染、過量飲酒、藥物性肝損傷、自身免疫性疾病和遺傳因素等[2-3]造成的慢性肝炎、肝纖維化、肝硬化和肝癌等已成為全球主要的公共衛生問題之一,嚴重威脅著人們的身心健康,給社會帶來重大經濟負擔。據統計,全球約有8.44億慢性肝病患者,每年導致約200萬人死亡[1,4]。
轉錄后調控是指在轉錄后對基因表達的調控,是對真核生物基因的轉錄產物進行的一系列修飾和加工,包括RNA分子整個生命周期中的多種過程,如加工、輸運、翻譯和降解等[5]。與RNA的轉錄調控相比,轉錄后調控對蛋白表達量的微調能力以及對疾病局部控制的能力具有更顯著的優勢[6]。已知細胞RNA 在轉錄后會動態可逆地經歷不同的化學修飾,如N6-腺苷酸甲基化(N6-methyladenosine,m6A)、m1A、N6,2′-O-腺苷酸二甲基化(m6Am)和5-胞嘧啶甲基化(m5C)等。轉錄后的動態修飾通過調節靶RNA的轉運、加工、剪接、翻譯和降解等,調控靶RNA的命運,進而影響疾病的進程。其中,m6A修飾是真核細胞RNA最豐富的內部修飾,與調控RNA的代謝密切相關。有研究表明,m6A修飾在胚胎發育、腫瘤形成和神經元生成等生理過程中發揮重要作用[7],并且m6A修飾在調節細胞內穩態方面也發揮重要作用[8]。
研究發現,m6A 修飾在病毒性肝炎、肝纖維化、肝脂代謝紊亂、非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)和肝癌等慢性肝病中發揮重要的生物學和臨床作用。研究特定轉錄本的m6A 修飾水平的調節機制及其在慢性肝病中發揮的作用,設計或篩選靶向調控m6A 修飾相關酶的新型藥物將為慢性肝病的治療帶來希望。本文對m6A修飾在慢性肝病中的作用予以綜述。
1 m6A修飾
m6A 是RNA 中N6位的腺苷酸發生的甲基化修飾,是真核RNA 中最普遍的內部修飾,能夠調控多種生理事件,已引起研究者的極大興趣[9]。轉錄組圖譜顯示,m6A 修飾存在于大量RNA 轉錄本中,但其功能和機制仍然未知。現已明確,m6A修飾是一個可逆的過程,受m6A修飾相關的“編輯器(writers)”和“消碼器(erasers)”酶的平衡調節。研究表明,m6A修飾嵌入在mRNA 的共有序列5′-RRACU-3′(R=A 或G)中,前期對mRNA 的拓撲研究表明,m6A 修飾通常出現在mRNA 的3′非編碼區。隨后,mRNA中5′端的m6A 修飾也被發現,并已揭示其與蛋白質翻譯密切相關[10-11]。
哺乳動物細胞中,m6A 的修飾是由甲基轉移酶復合物催化的,該復合物包含甲基轉移酶樣3(methyl?transferase like 3, METTL3),METTL14 和維爾姆斯瘤蛋白1 相關蛋白(Wilms tumor 1-associated protein,WTAP)[12]。METTL3 和METTL14 均含有S-腺苷甲硫氨酸結合基序,在WTAP 的幫助下,在核中共定位并形成異二聚體,催化甲基與腺嘌呤共價結合[13]。此外,一些新的甲基化酶被陸續發現,如KIAA1429 和RNA 結合基序蛋白15 已被鑒定為m6A 修飾轉移酶復合物的新成員[14]。Wen 等[15]研究表明,鋅指CCCH 結合域蛋白13(zinc finger CCCH domain-containing protein,ZC3H13)是一種新的RNA m6A修飾調節因子,可促進小鼠胚胎干細胞的自我更新。Chen等[16]發現了一種新的m6A修飾甲基化轉移酶ZCCHC4,它在肝癌組織中高表達,與肝癌的發展密切相關。相反,α-酮戊二酸依賴雙加氧酶ALKB同源蛋白5(α-Ketoglutarate-dependent dioxygenase ALKB homolog 5,ALKBH5)和去甲基化酶肥胖相關蛋白(fat mass and obesity-asso?ciated protein,FTO)作為哺乳動物RNA 去甲基酶能夠逆轉m6A 修飾。去甲基化酶FTO 和ALKBH5都屬于ALKB 雙加氧酶家族。ALKBH5 可直接去除RNA 的m6A 修飾,去甲基化酶FTO 可將m6A 依次氧化成穩定的N6-羥甲基腺苷(Hm6A)和N6-甲酰腺苷(F6A),隨后可水解成腺嘌呤。
m6A 修飾的生物學功能主要是通過改變RNA結構或招募m6A 修飾識別蛋白來發揮的。目前研究的主要有3 類m6A 修飾識別蛋白。①m6A 修飾識別蛋白含有一個進化上保守的YTH 結構域,可直接與m6A 結合。研究表明,人類基因組中有5 個YTH結構域蛋白,包括YTHDF1~3和YTHDC1~2,也是主要的m6A 修飾識別蛋白。其中,YTHDF2 是第一個被鑒定也是研究最多的m6A 修飾識別蛋白,通過與位于3′UTR 的m6A 結合,能夠影響mRNA的穩定性或加速靶mRNA 的降解[17]。此外,Du等[18]報道,YTHDF2 能夠招募C-C 基序趨化因子受體4-NOT 去腺苷化酶復合物以促進mRNA 降解。另一方面,YTHDF1 識別m6A 修飾的mRNA,提高mRNA 的翻譯效率[11]。YTHDF1 結合翻譯起始復合物真核起始因子3 促進m6A 修飾mRNA 的蛋白翻譯。YTHDF3 和YTHDF1 通過與翻譯相關元件相互作用促進蛋白質合成,YTHDF3 也能夠提高m6A修飾RNA的降解率。曾有研究者認為,YTHDF2和YTHDF1 的拮抗功能可能在調節其共同靶點的mRNA降解和翻譯之間的平衡中起重要作用。最新研究也證明,YTHDF3 能夠首先識別m6A 修飾的mRNA 前體,然后YTHDF1和YTHDF2競爭性結合YTHDF3 來調節靶基因的表達[19]。YTHDC1 是一個介導RNA 剪接的m6A 修飾識別蛋白,可募集mRNA 剪接因子富含絲氨酸和精氨酸的剪接因子3(serine and arginine rich splicing factor 3,SRSF3)和SRSF10 分別促進外顯子融合和缺失。此外,YTHDC1 還通過與SRSF3 和核RNA 輸出因子1 相互作用來控制核孔輸出[20]。YTHDC2 與RNA 解旋酶相互作用,正向調節翻譯的延伸[21]。②m6A 修飾識別蛋白包括3 種異質核糖核蛋白,即核不均一核糖蛋白C(heterogeneous nuclear ribonucleopro?tein C,HNRNPC),HNRNPG 和HNRNPA2B1。這些蛋白質通過“m6A-開關”選擇性地與含有m6A 修飾的轉錄本結合。在這種機制中,m6A 修飾削弱正常的堿基配對,破壞RNA 的穩定,從而暴露單鏈HNRNP 結合基序。曾有研究表明,HNRNPC 和HNRNPG 可以作為潛在的細胞核內RNA 的m6A修飾識別蛋白,影響mRNA 的定位和選擇性剪接[22]。另一個HNRNP 成員HNRNPA2B1 與m6A 修飾的微RNA 前體結合,并招募相關復合體來促進微RNA 的成熟[23]。③胰島素樣生長因子2 結合蛋白1/2/3(insulin-like growth factor 2 mRNA-binding protein 1/2/3,IGF2BP1/2/3)是第3 類m6A 修飾識別蛋白。這類蛋白質具有共同的RNA結合域,如識別含有m6A 修飾的轉錄本的KH 結構域。然而其確切的調控機制仍不清楚。IGF2BP 蛋白優先與含有m6A 修飾的轉錄本結合,其結合基序UGGAC 與m6A 修飾共有序列RRACH 重疊。IGF2BP 蛋白通過招募RNA 穩定因子如HUR 來發揮其功能,以保護m6A 修飾的mRNA 不被降解。上述m6A 修飾識別蛋白具有多種功能,參與調節RNA代謝的幾乎每一步,包括含有m6A 修飾的轉錄本的穩定性、翻譯和剪接。
綜上所述,m6A 修飾相關的甲基化、去甲基化酶和識別蛋白共同參與靶RNA的轉錄后調控(圖1)。
2 m6A修飾在慢性肝病的作用
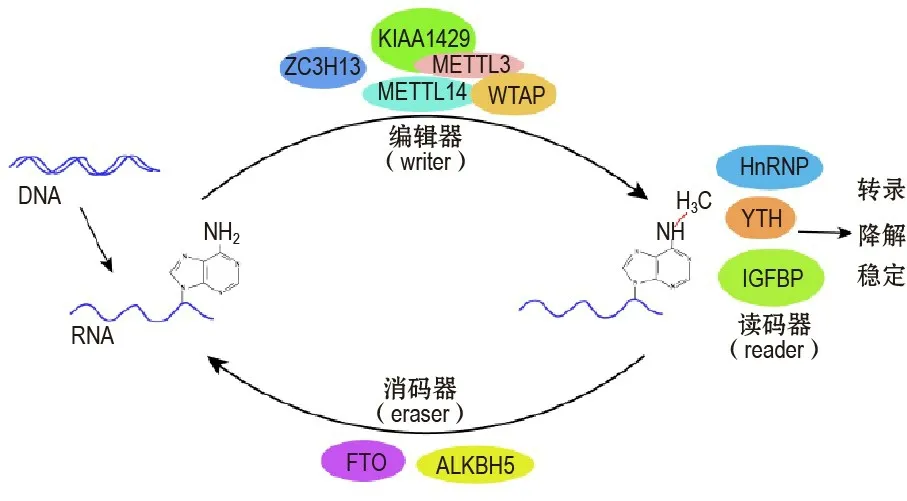
圖1 N 6-腺苷酸甲基化(m6A)調控模式. METTL3:甲基轉移酶樣3;WTAP:維爾姆斯瘤蛋白1 相關蛋白;KIAA1429:病毒樣m6A 轉移相關蛋白;ZC3H13:CCCH 型鋅指蛋白;FTO:肥胖相關蛋白;ALKBH5:ALKB同源蛋白5;HNRNP:核不均一核糖核蛋白;YTH:YTH結構域蛋白;IGFBP:胰島素樣生長因子結合蛋白.
m6A修飾的動態調控影響大量的基因表達及其相關的信號通路轉導,并進一步影響疾病的進程。RNA 的m6A 修飾可以調節幾種重要肝病的進程,如病毒性肝炎、肝纖維化、NAFLD 和肝癌等(表1)。并且肝發揮生理功能的任何特定階段都需要不同水平的m6A修飾調控[24]。可見,RNA m6A修飾對肝病進程有重要影響。
2.1 病毒性肝炎
乙型肝炎病毒(hepatitis B virus,HBV)和丙型肝炎病毒(hepatitis C virus,HCV)感染是慢性肝病的常見原因。HBV 是一種DNA 病毒,主要通過前基因組RNA 的調控來完成其生命周期,Imam 等[25]發現,HBV mRNA 的3′端m6A 修飾導致所有HBV轉錄本不穩定,而前基因組RNA 的5′和3′端m6A修飾使其轉錄穩定,提示m6A 修飾對HBV RNA 具有雙重調節功能。Tan 等[26]發現,m6A 修飾能夠抑制病毒包裝從而負調控HCV 的復制。當被HCV 感染時,YTHDF 蛋白重新定位到脂滴,即病毒組裝的位置抑制病毒復制[27]。m6A 修飾識別蛋白YTHDF2 或YTHDF3 能 夠與m6A 修 飾的RNA 結合抑制視黃酸誘導因子1 轉導信號,可能是HBV 和HCV 逃避免疫調控的原因[28]。慢性HBV 和HCV感染是肝細胞癌的最主要原因,而m6A 修飾識別蛋白與病毒RNA 相互作用的具體機制在很大程度上仍未知。研究發現,m6A 修飾在慢性肝炎病毒中可能存在雙重調節作用。闡明m6A修飾在肝慢性病毒感染及其免疫逃逸中的作用,為病毒性肝炎的防治提供新思路。
2.2 肝纖維化
肝纖維化是一個動態的創傷愈合過程,在慢性刺激下正常肝會發生肝纖維化,并進一步發展為肝硬化甚至肝癌。在這個過程中,肝星狀細胞的持續激活導致細胞外基質過度沉積,從而破壞肝的結構和功能。研究證實,肝纖維化是一種可逆性瘢痕修復反應,在其形成過程中進行適當的干預可以阻斷甚至逆轉肝纖維化。研究發現,黃曲霉毒素B1 誘導的肝細胞凋亡與m6A 修飾密切相關,m6A 修飾通過調節胱天蛋白酶3 依賴的途徑參與細胞凋亡[29]。Feng 等[30]報道,慢性皮質醇誘導的雞肝炎和纖維化中,熱休克蛋白水平降低;進一步研究發現,慢性皮質醇處理后甲基化酶METTL3 表達上調,使熱休克蛋白mRNA 的m6A 修飾水平升高,降低其mRNA的穩定性,誘導雞肝炎和纖維化。肝纖維化是各種慢性肝病發展的共同病理過程,其潛在機制和復雜的調控網絡尚不清楚,治療肝纖維化的選擇有限。m6A修飾在肝纖維化中的研究較少,因此從轉錄后調控機制特別是m6A修飾角度,尋找有效的抗肝纖維化治療策略具有重要意義。

表1 m6A調控因子在慢性肝病中的作用
2.3 非酒精性脂肪肝病
肝是機體物質代謝的中樞,其脂質代謝紊亂將導致肝甘油三脂或脂肪的堆積,與胰島素抵抗和肥胖等代謝綜合征密切相關,多項研究表明,m6A修飾能夠調控肝脂質代謝。Luo等[31]利用數據庫分析后提出,m6A 修飾通過RNA 結合蛋白Ago2 作用于脂代謝相關基因調控肝脂質代謝。Lu等[32]報道,中藥活性成分姜黃素可影響m6A 修飾相關酶METTL3,MELLT14 和ALKBH5 等表達,提高肝m6A 修飾水平,從而增加p53 mRNA 表達,保護肝損傷和脂質代謝。METTL3 調控脂肪酸合成酶的m6A 修飾,促進脂肪酸代謝,抑制肝胰島素抵抗[33],YTHDF2 結合m6A 修飾的PPARα,調節其mRNA 的穩定性,促進肝脂代謝[34]。關于肝癌細胞脂肪生成研究,Zuo等[35]報道,METTL3介導長鏈非編碼RNA LINC00958的m6A 修飾,并通過miR-3619-5p 上調肝癌衍生生長因子的表達,從而促進肝癌細胞中的脂肪生成,提示調控肝m6A 修飾可能是恢復肝脂質代謝的有效手段。
NAFLD 主要以肝脂肪變性為主要特征。研究發現,肥胖相關蛋白FTO 通過降低m6A 修飾調控脂肪生成,如干擾肥胖相關蛋白FTO 的表達,使成脂基因CCAAT 增強子結合蛋白、過氧化物酶體增殖物激活受體γ(peroxisome proliferators-activated receptor gamma,PPARγ)、Fas細胞表面死亡受體和乙酰輔酶A 羧化酶表達顯著降低,而脂肪甘油三酯脂肪酶的表達顯著增加,甲基化酶METTL3 上調m6A修飾抑制肝脂肪生成相關基因表達[36-37]。在NAFLD 患者肝中發現,FTO mRNA 和蛋白水平顯著增加[36]。在NAFLD 大鼠中也發現,FTO mRNA和蛋白水平升高,并表明其與氧化應激和脂質沉積有關[38]。Hu 等[39]報道,糖皮質激素受體介導FTO的活化,降低脂肪生成基因的m6A 修飾,參與NAFLD 的發生。甜菜堿可以降低肝內FTO 表達,減少新生脂肪生成并增加脂肪分解以保護小鼠免受NAFLD 的影響[40]。總之,上述研究為肥胖相關蛋白FTO 作為m6A 修飾的去甲基化酶在調節肝脂肪代謝中的作用提供了新的視角。
2.4 肝細胞癌
肝細胞癌的發生多與長期的慢性肝損傷有關,如HBV 或HCV 感染或乙醇刺激等。以往研究已經表明,m6A 修飾能夠調控癌基因表達。最新研究顯示,m6A 修飾與肝癌細胞增殖、分化、侵襲和轉移密切相關。在肝癌進程中,m6A 修飾水平顯著增加[41]。Qu 等[42]利用癌癥基因組圖譜和國際癌癥基因組聯合會數據庫中的數據分析發現,甲基化調控因子YTHDF1,YTHDF2,METTL3 和KIAA1429 是肝細胞癌發展過程中的關鍵調控因子,這些因子的發現對預測和治療肝細胞癌具有潛在的應用價值。此外,甲基化酶METTL3 在肝癌中顯著上調,可能作為肝癌潛在的預后生物標志物[43]。去甲基化酶FTO 降低癌基因19、TEA 結構域轉錄因子2(TEA domain transcription factor 2,TEAD2)mRNA 穩定性,過表達去甲基化酶FTO 能夠抑制腫瘤生長。Zhou 等[44]在臨床樣本中發現,m6A 修飾相關因子METTL3 和YTHDF1 在肝癌患者中顯著上調。將YTHDF1 共表達基因進行GO 和KEGG 通路分析發現,YTHDF1 在調控肝癌細胞周期進程和代謝中發揮重要作用[45]。進一步研究發現,丙酮酸脫氫酶激酶4(pyruvate dehydrogenase kinase 4,PDK4)的5′UTR 與YTHDF1/真核翻譯延伸因子2 復合物以及IGF2BP3 結合,調節PDK4 穩定性進而調控肝癌細胞的糖酵解[46]。Ding 等[47]也報道,G 蛋白亞單位α mRNA 的m6A 修飾增加并與YTHDF1 結合,使其表達增加并與轉錄激活因子信號轉導與轉錄激活因子3 相互作用,促進肝癌細胞的生長和轉移。Hou 等[48]也發現,肝癌患者組織中m6A 修飾水平增加,并伴隨著YTHDF2 的降低。YTHDF2 能夠直接結合表皮生長因子受體3′UTR 的m6A 修飾位點,促進肝癌細胞表皮生長因子受體的降解,抑制了肝癌細胞增殖和生長[49]。總之,上述發現對理解靶向人類肝癌中m6A 修飾提供了新的治療靶標和方向。
3 結語
綜上所述,m6A 修飾作為真核生物RNA 最豐富、最重要的內部修飾,在慢性肝病進程中發揮了重要作用。m6A修飾水平可能是慢性肝病早期診斷的潛在指標,m6A 修飾相關酶可能是治療肝病的潛在靶點。m6A修飾與病毒性肝炎進展密切相關。在HCV 和HBV 中,m6A 修飾能調控病毒的感染和復制,但其在病毒性肝炎中的作用尚存在爭議,因此其對肝炎病毒的調控作用仍需深入研究。m6A修飾在肝纖維化中的研究較少,而肝纖維化是各種慢性肝病的共同病理過程,m6A 修飾對肝纖維化的調控能夠抑制慢性肝病的進展。NAFLD 的發病機制是一個復雜的過程,涉及多種調控機制,包括脂肪生成、脂肪堆積、胰島素抵抗和內質網應激等。研究表明,m6A 修飾參與肝胰島素抵抗和脂質的積累。此外,m6A 修飾與肝癌的發生密切相關,在肝癌中m6A 修飾調節因子特異性地調控mRNA 的剪接、翻譯和降解等。探究m6A 修飾在肝癌中的調控機制,可為肝癌治療提供新策略。但m6A 修飾在慢性肝病中的研究尚存在較大空間,待深入探討。

