線粒體活性氧自由基抑制劑R(+)-普拉克索對腦缺血再灌注損傷大鼠JAK2-STAT3通路及炎性因子TNF-α的影響
丁 錨 楊 楠 黃語悠 師文娟 閆 峰 趙詠梅 劉克建
(首都醫科大學宣武醫院 北京市老年病醫療研究中心 腦血管病轉化醫學北京市重點實驗室,北京 100053)
缺血性腦卒中是導致長期神經功能障礙的重要原因。腦缺血發生時,涉及一系列復雜的病理生理反應,造成內穩態失衡,線粒體功能紊亂。線粒體功能障礙可產生大量活性氧自由基(reactive oxygen species,ROS),進而對神經元造成氧化應激損傷。本課題組研究[1]顯示,大鼠腦缺血再灌注6 h時線粒體ROS大量產生,對缺血神經元造成氧化應激損傷,進而引起細胞死亡。這一研究結果首次證明線粒體是腦缺血損傷早期ROS產生的主要來源,線粒體ROS大量生成是造成腦缺血再灌注早期神經元損傷的重要原因之一[1]。多巴胺受體激動劑普拉克索(pramipexole,PPX)具有抗氧化活性,為線粒體靶向抗氧化劑。PPX可通過阻止線粒體通透性轉運孔的開放,保護線粒體膜完整性,進而抑制線粒體ROS產生[2]。本團隊前期研究[3]表明,R(+)-普拉克索[R(+)-PPX]可顯著減少大鼠腦缺血再灌注6 h時線粒體ROS的產生,從而降低大鼠腦梗死體積,說明R(+)-PPX能對腦缺血的早期損傷產生保護作用。但腦缺血再灌注早期R(+)-PPX的神經保護作用機制尚不明確。
內源性酪氨酸激酶2(janus kinase 2,JAK2)-信號轉換器和轉錄激活因子3(signal transducer and activator of transcription 3,STAT3)信號通路是多種細胞因子和生長因子在細胞內傳遞信號的共同途徑,與機體各種生命活動密切相關。JAK2-STAT3通路的激活參與了細胞增殖、炎性反應、血管生成和細胞凋亡等多種生理病理活動[4]。目前關于JAK2-STAT3通路是否在腦缺血再灌注早期發展階段就被激活的研究尚少。磷酸化STAT3(phosphorylated STAT3,p-STAT3)是STAT3的激活形式,有研究[5]表明,H2O2處理的大鼠成纖維細胞中STAT3被顯著激活,并且過表達的p-STAT3可被抗氧化劑抑制,表明JAK2-STAT3信號通路可能在調節氧化應激反應中發揮重要作用。STAT3除了分布在細胞質和細胞核以外,也存在于線粒體中,ROS對心肌細胞線粒體STAT3的氧化作用,使得STAT3被激活[6]。然而,目前暫無研究明確報道,在腦缺血再灌注早期,線粒體ROS是否通過激活JAK2-STAT3通路產生神經損傷作用。
炎性反應是腦缺血再灌注損傷的重要病理生理機制之一,腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)在腦缺血損傷后表達上調,通過促進炎性反應加快細胞凋亡。有文獻[7]報道,誘導線粒體ROS產生可增加炎性因子的釋放,提示線粒體ROS可直接調節炎性因子的表達。另外,JAK2-STAT3也是一條重要的炎性反應相關通路,JAK2-STAT3通路的激活參與炎性反應相關的信號轉導過程。研究[8]顯示,應用JAK2抑制劑AG490可抑制STAT3活化,進而明顯下調成纖維細胞內TNF-α的表達水平,說明JAK2-STAT3通路的激活也能影響TNF-α的表達。
為了深入探究R(+)-PPX保護腦缺血再灌注早期損傷的機制,本研究采用大腦中動脈梗塞(middle cerebral artery occlusion,MCAO)再灌注模型大鼠,觀察缺血再灌注6 h時缺血腦組織p-JAK2、p-STAT3和TNF-α的表達變化,以及R(+)-PPX對缺血大鼠腦內JAK2-STAT3通路和TNF-α表達的影響,以期為R(+)-PPX的腦保護作用研究提供更多的科學依據。
1 材料與方法
1.1 實驗動物及分組
健康雄性SD大鼠體質量為280~320 g,購自北京維通利華實驗動物公司,實驗動物許可證號:SCXK(京)2012-0001,于SPF級動物實驗室恒溫飼養,術前12 h禁食水。將30只大鼠應用數字表法隨機分為3組:假手術組(Sham組)、MCAO再灌注6 h組(MCAO組)和MCAO再灌注6 h+R(+)-PPX組[R(+)-PPX組]。每組10只大鼠。R(+)-PPX溶于0.9%(質量分數)氯化鈉注射液(以下簡稱生理鹽水)中。R(+)-PPX組于MCAO前30 min腹腔一次性注射R(+)-PPX,劑量為1 mg/kg[1],Sham組和MCAO組皮下注射同等體積的生理鹽水。
1.2 主要儀器設備
小動物麻醉機(Harvard Apparatus公司,美國)、手術顯微鏡(Carl Zeiss公司,德國)、反饋式溫度調節儀(CMA 150,Carnegie Medicin公司,瑞典)、雙極電凝器(ACC100,北京德威醫療器械有限公司)、小動物呼吸機(Harvard Apparatus 683,Harvard Apparatus公司,美國)、冰凍切片機(Thermo Fisher Scientific公司,美國)、熒光顯微鏡(Nikon公司,日本)。
1.3 試劑
恩氟烷(河北一品制藥有限公司);水合氯醛(首都醫科大學宣武醫院); R(+)-PPX(Sigma公司,美國);DHE(Sigma公司,美國);p-JAK2抗體(CST公司,美國); p-STAT3抗體(CST公司,美國);TNF-α抗體(CST公司,美國);β-actin抗體(Santa Cruz公司,美國)等。
1.4 動物模型制作
MCAO大鼠模型的制備依照改良Zea Longa法。在70%(體積分數)N2O和30%(體積分數)O2中混合5%(體積分數)恩氟烷誘導麻醉,而后改用面罩吸入2%(體積分數)恩氟烷維持麻醉。大鼠仰臥位固定,去除頸部毛并消毒后,沿頸部正中線做一縱行切口,分離且夾閉右側頸總動脈。分離右側頸外動脈,結扎并電凝斷后,眼科剪呈 45°在右側頸外動脈近心端血管壁上剪一小口,將尼龍線栓(頭端直徑為0.38 mm)插入至大腦中動脈起始端處固定線栓。術中使用反饋性控溫毯監測術中大鼠肛溫,使其維持在(37.0±0.5)℃,并檢測大鼠心率及血壓。于缺血90 min 后拔出線栓,進行再灌注。Sham組大鼠相應部位皮膚切開分離血管后不插栓即縫合。
1.5 DHE染色
Sham組、MCAO組以及R(+)-PPX組大鼠腹腔注射水合氯醛,快速斷頭取腦包埋,行腦組織冰凍切片,每片腦組織厚度均為20 μm。未進行固定的新鮮冰凍切片浸入10 μmol/L的超氧化物陰離子熒光探針(dihydroethidium,DHE)溶液中(生理鹽水溶解),避光條件下37 ℃孵育90 min后用PBS沖洗,封片后于熒光顯微鏡下觀察,觀察區域為缺血側腦皮質中的半暗帶區。
1.6 免疫熒光雙標染色
各組大鼠腦組織冰凍切片(厚度20 μm)于預冷的4%(質量分數)多聚甲醛中固定10 min,PBS漂洗后用含0.2%(體積分數)TritonX-100的PBS室溫孵育10 min,之后滴加5%(體積分數)山羊血清室溫封閉30 min,棄血清,滴加一抗(p-STAT3抗體 1∶100,TNF-α抗體 1∶100),4 ℃孵育過夜。次日將切片于室溫復溫1 h,PBS漂洗3次,滴加熒光二抗(1∶200稀釋),室溫避光孵育1 h。PBS漂洗3次,滴加含DAPI(4′,6-diamidino-2-phenylindole)的封片劑,之后在熒光顯微鏡下觀察。
ROS分別與p-STAT3、TNF-α的熒光雙標染色:腦組織冰凍切片用DHE熒光染劑孵育90 min。PBS沖洗后,滴加一抗(p-STAT3抗體1∶100,TNF-α抗體 1∶100)孵育過夜。次日將切片室溫復溫1 h,PBS漂洗后,滴加熒光二抗(1∶200稀釋)。用含DAPI的封片劑封片后在熒光顯微鏡下觀察。
1.7 Western blotting檢測
取新鮮大鼠右側腦組織,立即于前囟0~-0.1處切取1 mm厚的腦組織冠狀切片。加入含有蛋白酶抑制劑的裂解液后,將缺血側腦組織于冰上勻漿,冰浴靜置30 min后,4 ℃條件下12 000 g離心30 min取上清。用BCA法測定蛋白濃度。樣品中加入上樣緩沖液煮沸,采用SDS-PAGE電泳濕轉法轉膜90 min,于5%(質量分數)脫脂牛奶室溫下封閉1 h,加入一抗(p-JAK-2抗體1∶1 000,β-actin抗體1∶1 000)孵育過夜,次日用TBST洗膜3次,室溫下于HRP標記的山羊抗小鼠/兔(1∶6 000)二抗中孵育1 h,TBST洗膜3次,用ECL化學發光液顯色,并用化學發光系統掃描檢測。
1.8 統計學方法
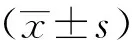
2 結果
2.1 R(+)-PPX抑制MCAO大鼠缺血側腦組織p-JAK2的表達
Western blotting檢測結果顯示,3組間大鼠右側腦組織p-JAK2表達量差異有統計學意義(P<0.05)。兩兩比較結果顯示,與Sham組相比,MCAO組大鼠再灌注6 h缺血側腦組織p-JAK2表達量明顯增加;與MCAO組大鼠相比,R(+)-PPX組大鼠再灌注6 h缺血側腦組織p-JAK2表達量顯著降低,差異有統計學意義(P<0.05)(圖1)。

圖1 蛋白免疫印跡法檢測Sham、MCAO及R(+)-PPX組大鼠再灌注6 h缺血腦組織p-JAK2蛋白的表達Fig.1 Expression of p-JAK2 in ischemic brain tissue of Sham, MCAO and R(+)-PPX groups after 6 h reperfusion Representative Western blotting images of p-JAK2 and quantification of optical density measurements normalized to β-actin. Data are (n=6). *P<0.05 vs Sham group, #P<0.05 vs MCAO group; MCAO: middle cerebral artery occlusion; PPX: pramipexole; p-JAK2: phosphor-ylated-janus kinase 2.
2.2 R(+)-PPX抑制MCAO大鼠腦缺血半暗帶區p-STAT3的表達
免疫熒光染色結果顯示,Sham組大鼠與缺血半暗帶相對應的腦區未見p-STAT3綠色熒光陽性細胞,而MCAO、R(+)-PPX組大鼠再灌注6 h缺血半暗帶區均可見p-STAT3陽性細胞(圖2A),3組間大鼠缺血半暗帶區p-STAT3陽性細胞數差異有統計學意義(P<0.05)。兩兩比較結果顯示,與Sham組相比,MCAO組大鼠再灌注6 h缺血半暗帶區p-STAT3陽性細胞數明顯增加;與MCAO組相比,R(+)-PPX組大鼠再灌注6 h缺血半暗帶區p-STAT3陽性細胞數明顯減少,差異有統計學意義(P<0.05)(圖2B)。
2.3 腦缺血再灌注早期,大鼠腦缺血半暗帶區ROS與p-STAT3共定位
熒光雙標結果顯示,MCAO組大鼠再灌注6 h缺血半暗帶區ROS熒光探針DHE呈現紅色熒光,p-STAT3免疫熒光染色陽性細胞呈現綠色熒光,DAPI染色細胞核為藍色熒光。進行圖像合并后發現,DHE的紅色熒光陽性細胞和p-STAT3的綠色熒光陽性細胞重合,說明ROS與p-STAT3共定位(圖2A)。提示腦缺血再灌注早期,ROS的產生與STAT3的激活相關。

圖2 熒光雙標染色法檢測Sham、MCAO與R(+)-PPX組大鼠再灌注6 h腦缺血半暗帶區p-STAT3和ROS的表達Fig.2 Expression of p-STAT3 and ROS in the ischemic penumbra of Sham, MCAO and R(+)-PPX groups after 6 h reperfusionA: representative double labeling fluorescence images for the colocalization of ROS (red) and p-STAT3 (green) after 6 h reperfusion. Scale bar=20 μm; B: quantification of p-STAT3 positive cells. Data are (n=6). *P<0.05 vs Sham group, #P<0.05 vs MCAO group; MCAO: middle cerebral artery occlusion; PPX: pramipexole; p-STAT3: phosphorylated signal transducer and activator of transcription 3; ROS: reactive oxygen species; DAPI: 4′,6-diamidino-2-phenylindole.
2.4 腦缺血再灌注早期,大鼠腦缺血半暗帶區ROS與炎性因子TNF-α共定位,且R(+)-PPX減少MCAO大鼠腦缺血半暗帶區TNF-α的表達
熒光染色結果顯示,MCAO組大鼠再灌注6 h缺血半暗帶區ROS熒光探針DHE呈現紅色熒光,TNF-α免疫熒光染色陽性細胞呈現綠色熒光,DAPI染色細胞核為藍色熒光。進行圖像合并后發現,DHE的紅色熒光陽性細胞和TNF-α的綠色熒光陽性細胞重合,說明ROS與TNF-α共定位(圖3A)。
Sham組大鼠與缺血半暗帶相對應的腦區未見TNF-α綠色熒光陽性細胞,而MCAO、R(+)-PPX組大鼠再灌注6 h缺血半暗帶區均可見TNF-α陽性細胞(圖3A),3組間大鼠缺血半暗帶區TNF-α陽性細胞差異有統計學意義(P<0.05)。兩兩比較結果顯示,與Sham組相比,MCAO組大鼠再灌注6 h缺血半暗帶區TNF-α陽性細胞數明顯增加;與MCAO組大鼠相比,R(+)-PPX組大鼠再灌注6 h缺血半暗帶區TNF-α陽性細胞數明顯減少,差異有統計學意義(P<0.05)(圖3B)。
2.5 腦缺血再灌注早期,大鼠腦缺血半暗帶區p-STAT3與TNF-α共定位
免疫熒光雙標染色結果顯示,MCAO組大鼠再灌注6 h缺血半暗帶區p-STAT3呈現紅色熒光,TNF-α免疫熒光染色陽性細胞呈現綠色熒光,DAPI染色細胞核為藍色熒光。進行圖像合并后發現,p-STAT3陽性細胞的紅色熒光和TNF-α陽性細胞的綠色熒光重合,說明腦缺血再灌注早期,大鼠腦缺血半暗帶區p-STAT3與TNF-α共定位(圖3C)。

圖3 熒光雙標染色法檢測Sham、MCAO與R(+)-PPX組大鼠再灌注6 h腦缺血半暗帶區TNF-α和ROS的表達;免疫熒光雙標染色法檢測MCAO大鼠腦缺血半暗帶區p-STAT3和TNF-α的表達Fig.3 Expression of TNF-α and ROS in the ischemic penumbra of Sham, MCAO and R(+)-PPX groups after 6 h reperfusion;expression of p-STAT3 and TNF-α in the ischemic penumbra of MCAO ratsA: representative double labeling fluorescence images for the colocalization of ROS (red) and TNF-α (green) after 6 h reperfusion. Scale bar=20 μm; B: quantification of TNF-α positive cells. Data are (n=6). *P<0.05 vs Sham group, #P<0.05 vs MCAO group; C: representative double labeling immunofluorescence images of p-STAT3 (red) and TNF-α (green) after 6 h reperfusion. Scale bar=20 μm; MCAO: middle cerebral artery occlusion; PPX: pramipexole; TNF-α: tumor necrosis factor-α; ROS: reactive oxygen species; p-STAT3: phosphorylated STAT3; DAPI: 4′,6-diamidino-2-phenylindole.
3 討論
氧化應激是腦缺血再灌注過程中加重腦組織損傷的重要原因之一。在腦缺血后,特別是再灌注發生時,神經元內產生大量自由基、過氧化物等造成細胞氧化應激損傷[9]。線粒體是體內超氧化物的主要來源之一,本課題組最近的研究[1]顯示,腦缺血再灌注早期的氧化應激損傷主要是由于線粒體ROS大量產生造成的,因此抑制線粒體ROS可能對早期腦缺血再灌注損傷具有神經保護作用。PPX是線粒體靶向抗氧化劑,能抑制線粒體ROS的產生。筆者在實驗中證明,R(+)-PPX可明顯減少腦缺血再灌注6 h大鼠缺血大腦半球線粒體ROS的生成,從而發揮神經保護作用[3]。然而,R(+)-PPX在缺血性腦損傷過程中發揮早期腦保護作用的具體機制尚不完全清楚。
JAK2-STAT3作為重要的細胞因子信號轉導途徑,參與細胞增殖分化、氧化應激、炎性反應、免疫調節等多個生理病理環節。有研究[10]顯示,JAK2-STAT3通路在腦缺血再灌注24 h后被激活,說明JAK2-STAT3通路參與腦缺血損傷。但目前關于JAK2、STAT3是否在腦缺血再灌注早期即被激活的研究尚少。筆者利用Western blotting檢測腦缺血大鼠再灌注6 h后缺血側腦組織中p-JAK2表達量,免疫熒光染色法檢測p-STAT3的水平,研究結果顯示,MCAO組大鼠再灌注6 h,缺血半暗帶區p-JAK2及p-STAT3表達量比Sham組明顯增加,說明 JAK2-STAT3通路在腦缺血再灌注早期即被激活。
研究[5,11]證明,JAK2-STAT3信號通路在氧化應激損傷的細胞及動物模型中被激活,提示該信號通路可能在調節氧化應激反應中發揮重要作用。有文獻[12]報道,ROS作為一種信號分子可激活JAK2,進而導致STAT3磷酸化。而清除活性氧能抑制體內STAT3磷酸化。由此可見,ROS對于啟動JAK2-STAT3通路具有重要意義。為了探究ROS在腦缺血再灌注早期能否介導JAK2-STAT3通路的激活。筆者對MCAO再灌注6 h大鼠缺血半暗帶區ROS與p-STAT3進行熒光雙標染色,結果顯示ROS與p-STAT3共定位,說明腦缺血再灌注6 h時,STAT3的激活與ROS的產生密切相關。筆者還發現,腹腔注射R(+)-PPX抑制ROS后,大鼠缺血腦組織內p-JAK2、p-STAT3表達水平均顯著下降。該結果進一步說明,腦缺血再灌注早期,線粒體ROS的大量產生可激活JAK2-STAT3通路。結合本課題組之前的研究[3]結果,給予R(+)-PPX治療能明顯降低MCAO再灌注6 h大鼠腦梗死體積,減少細胞凋亡,筆者推測,R(+)-PPX很可能通過抑制JAK2-STAT3通路的激活,從而發揮神經保護作用。
炎性反應是加重腦缺血再灌注損傷的重要原因之一,腦缺血急性期大量釋放的TNF-α是缺血后炎性損傷的重要啟動因子[13]。有研究[14]顯示,線粒體ROS參與銅誘導小膠質細胞炎性反應的過程,抑制ROS可緩解銅導致的炎性反應,降低炎性因子TNF-α的水平。為了觀察腦缺血再灌注損傷后TNF-α的表達是否與ROS有關,本研究對TNF-α和ROS進行熒光染色雙標,結果顯示,大鼠缺血半暗帶區TNF-α陽性細胞與ROS共定位,說明腦缺血再灌注早期TNF-α的表達與ROS密切相關。給予R(+)-PPX抑制線粒體ROS產生后可明顯降低MCAO再灌注6 h大鼠腦缺血半暗帶區TNF-α的表達量,進一步說明,腦缺血再灌注早期線粒體ROS能直接誘導炎性因子TNF-α的表達。另外,研究[10]報道,JAK2-STAT3通路被激活后,p-STAT3與細胞核DNA結合從而增加炎性因子的表達。對周圍巨噬細胞的研究[15]也發現,JAK2-STAT3的激活能介導炎性因子的釋放,誘發巨噬細胞炎性反應。本研究用免疫熒光染色法對p-STAT3和TNF-α進行雙標,發現p-STAT3陽性細胞和TNF-α陽性細胞在大鼠腦缺血半暗帶區能夠重合,說明腦缺血再灌注損傷后TNF-α的產生與p-STAT3的激活有關。因此,筆者推測,腦缺血再灌注損傷后線粒體ROS也可能是通過激活JAK2-STAT3通路,進而引起炎性因子TNF-α的表達增加。
了解線粒體ROS損傷神經元的機制,對于早期挽救缺血半暗帶具有重要意義。本研究重點探究了腦缺血再灌注損傷早期,R(+)-PPX發揮抗氧化作用的機制。證明R(+)-PPX通過減少MCAO再灌注6 h大鼠線粒體ROS產生,抑制JAK2-STAT3通路激活,降低TNF-α表達,產生神經保護作用。該結果在本課題組前期研究的基礎上,進一步完善了線粒體ROS造成腦缺血再灌注早期損傷的機制,并為深入探討R(+)-PPX的神經保護作用機制提供了相關的實驗數據。

