乳腺癌多模態超聲特征與VEGF、SATB1、CK5/6表達的相關性*
車欣 朱婷 伍瓏 胡蓉菲
(復旦大學附屬華山醫院北院寶山分院超聲科, 上海 200431)
乳腺癌是常見的女性惡性腫瘤,近年來我國的發病率居高不下[1]。隨著分子生物學的迅猛發展,許多與乳腺癌病理及預后有關的分子標志物成為了眾多學者研究的重點,如普遍被認知的雌激素受體(Estrogen Receptor,ER)、孕激素受體(Progesterone Receptor,PR)、人表皮生長因子受體2(Human Epidermal Growth Factor Receptor-2,HER-2)和Ki67等[2-5]。由于乳腺癌的發生、發展機制非常復雜,近年來許多研究者也報道了包括血管內皮生長因子(Vascular Endothelial Growth Factor,VEGF)、特異AT序列結合蛋白1(Special-At Rich Sequence Binding Protein 1,SATB1)和CK5/6等在內的其他分子標志物與乳腺癌病理和預后密切相關[6-8]。然而,目前這些分子標志物的檢測都是有創性的,需通過獲得活體組織標本,結合病理診斷結果才能完成。常規超聲、剪切波彈性成像(Shear Wave Elastography,SWE)和超聲造影(Contrast-Enhanced Ultrasonography,CEUS)都是常用的乳腺病變臨床檢測方式。已有研究報道,常規超聲、SWE和CEUS特征與乳腺癌ER、PR、HER-2和Ki67表達有關[9-10],而目前還未有研究探討多模態超聲特征與VEGF、SATB1和CK5/6這些已被報道的乳腺癌相關分子標志物的相關性。因此,本研究旨在通過描述不同VEGF、SATB1和CK5/6表達狀態乳腺癌的多模態超聲特征,探討兩者的的相關性,以期術前無創評估乳腺癌預后,從而為疾病的臨床診治提供影像學新思路。
1 材料與方法
1.1 一般資料 選取2018年8月~2020年8月于復旦大學附屬華山醫院寶山分院和西北婦女兒童醫院行手術治療的216例女性乳腺癌患者為研究對象,共216個病灶。患者年齡21~79歲,平均(46.33±7.48)歲。納入標準:①術前均行常規超聲、SWE和超聲造影檢查,檢查前未行穿刺及切檢操作。②檢查前未進行放、化療和內分泌治療。③術后切除標本組織行病理和免疫組化分析,檢測VEGF、SATB1和CK5/6表達情況。④自愿參加研究。排除標準:①復發、多灶及雙側乳腺病灶。②超聲特征或免疫組化資料不完整。本研究獲得了醫院倫理委員會審核并通過,并且患者簽署了知情同意書。
1.2 方法
1.2.1 儀器和檢查方法 采用超聲科Supersonic Imagine Aixplorer型超聲診斷儀,常規超聲及SWE成像使用L15-4線陣探頭,頻率4~15 MHz; CEUS使用L10-2線陣探頭,頻率2~10 MHz。根據ACR第五版BI-RADS分級標準對病灶大小、內部回聲、后方回聲、腫塊邊緣、有無微鈣化以及血流程度等常規超聲特征進行觀察描述。然后切換至SWE模式,當發現病灶周圍高彈性模量的“硬環征”或病灶中心彈性模量缺失的“黑洞征”時,進行記錄。更換探頭,調至造影模式,選擇病灶區與周圍正常乳腺組織為感興趣區,得到時間強度曲線,分析病灶的增強強度、以及是否早于周邊正常組織增強或消退。
1.2.2 免疫組織化學方法及判定標準 取手術切除乳腺癌標本,采用免疫組織化學SP法檢測乳腺癌組織中的VEGF、SATB1和CK5/6。評估時采用雙盲法,當結果不一致時,可由2名以上主任醫師進行商討,最終確定評定結果。判定標準為:VEGF主要定位在細胞質,呈棕黃色,陽性細胞百分比計分如下:無陽性細胞為0分,1%~10%為1分,11%~25%為2分,26%~50%為3分,51%~75%為4分,≥76%為5分;染色強度計分如下:無著色為0分,淡黃色或黃色為1 分,棕黃色為2分,棕褐色為3分,取兩項乘積作為最終得分,其中分數>3分為陽性,≤3分為陰性[11]。SATB1定位于細胞核,顆粒為棕黃色且陽性細胞百分比≥50%,或顆粒為棕褐色且陽性細胞百分比≥25% 即為表達陽性,否則認為表達陰性[12]。CK5/6 定位于細胞質,有棕黃色顆粒出現即為陽性細胞,若陽性細胞百分比<10%,則為CK5/6陰性;若≥10%,則為 CK5/6 陽性[13]。

2 結果
2.1 病理及免疫組化結果 216例乳腺癌中,浸潤性導管癌176例、導管內原位癌20例、黏液腺癌12例、髓樣癌4例、2例惡性葉狀腫瘤、2例多形性癌。腫瘤直徑0.5~4.0 cm,平均(2.19±0.88) cm。VEGF陽性128例(59.3%),陰性88例(40.7%);SATB1陽性144例(66.7%),陰性72例(33.3%);CK5/6陽性156例(72.2%),陰性60例(27.8%)。
2.2 常規超聲特征與VEGF、SATB1和CK5/6表達水平的關系 常規超聲特征中有無微鈣化與VEGF表達水平有關,VEGF陽性者出現微鈣化的比例均顯著高于陰性者,差異有統計學意義(P<0.05),見表1。腫塊邊緣狀態和有無微鈣化與SATB1表達水平有關,SATB1陽性者出現腫塊邊緣不光整和鈣化的比例均顯著高于陰性者,差異有統計學意義(P<0.05),見表2。有無微鈣化與CK5/6表達水平有關,CK5/6陽性者出現微鈣化鈣化的比例顯著高于陰性者,差異有統計學意義(P<0.05),見表3。
VEGF、SATB1和CK5/6表達陽性的患者常規超聲多表現為邊緣不光整和微鈣化,見圖1A; VEGF、SATB1和CK5/6表達陰性的患者常規超聲多表現為邊緣光整和無微鈣化,見圖1B。

表1 常規超聲特征與VEGF表達水平的關系

表2 常規超聲特征與SATB1表達水平的關系

表3 常規超聲特征與CK5/6表達水平的關系
2.3 SWE征象與VEGF、SATB1和CK5/6表達水平的關系 VEGF陽性和陰性者出現硬環征、黑洞征的比例比較,差異無統計學意義(P>0.05);SATB1和CK5/6陽性者出現硬環征的比例均顯著高于陰性者(P<0.05),而出現黑洞征的比例在各組陽性和陰性者間差異無統計學意義(P>0.05),見表4。SWE典型征象硬環征和黑洞征,見圖2。

圖1 乳腺癌常規超聲典型特征

表4 SWE征象與VEGF、SATB1和CK5/6表達水平的關系

圖2 乳腺癌SWE典型特征
2.4 CEUS特征與VEGF、SATB1和CK5/6表達水平的關系 CEUS的增強程度、增強方式和消退方式均與VEGF表達水平有關,VEGF陽性表達者出現高增強、晚增強和晚消退的比例顯著高于陰性者(均P<0.05),見表5。消退方式與SATB1表達水平有關,SATB1陽性者出現晚消退的比例顯著高于陰性者(P<0.05),見表6。增強程度和消退方式均與CK5/6表達水平有關,CK5/6陽性表達者出現高增強和晚消退的比例均顯著高于陰性者(P<0.05),見表7。
VEGF、SATB1和CK5/6表達陽性的患者CEUS多表現為高增強,見圖3A。VEGF、SATB1和CK5/6表達陰性的患者CEUS多表現為無增強,見圖3B。

表5 CEUS特征與VEGF表達水平的關系

表6 CEUS特征與SATB1表達水平的關系
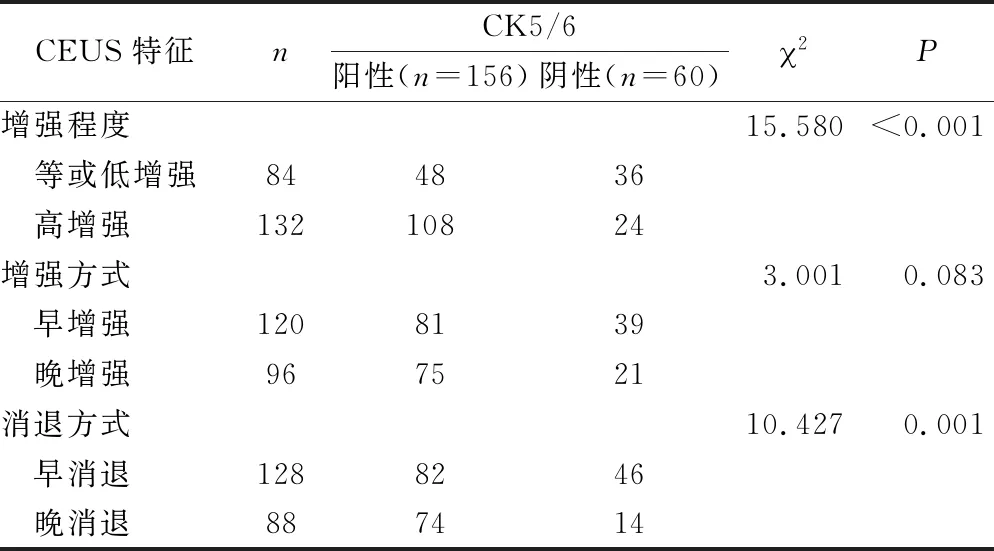
表7 CEUS特征與CK5/6表達水平的關系
2.5 二元Logistic回歸分析 對單因素分析中的變量賦值,見表8。分別以VEGF、SATB1和CK5/6表達水平為因變量(陰性=0;陽性=1),以各自單因素分析結果中有意義的變量作為自變量,進行二元Logistic分析。結果顯示,CEUS表現高增強、晚消退是乳腺癌VEGF表達陽性的獨立危險因素(P<0.05);出現微鈣化、硬環征和CEUS表現晚消退是SATB1表達陽性的獨立危險因素(P<0.05);出現微鈣化,CEUS表現高增強、晚消退是乳腺癌CK5/6表達陽性的獨立危險因素(P<0.05),見表9。

圖3 乳腺癌CEUS典型特征

表8 多模態超聲特征各變量的賦值

表9 Logistic回歸分析結果
3 討論
目前乳腺癌位居我國女性主要癌癥發病率的首位,嚴重影響患者身心健康。由于乳腺癌的發生、發展機制十分復雜,并且尚不明確,隨著分子生物學的發生,近年來許多學者都致力于對乳腺癌分子標志物的研究,以期找到分子靶向乳腺癌治療的突破點[14-15]。VEGF在腫瘤血管形成及轉移中起重要作用,VEGF對乳腺癌的預后有明顯影響,VEGF表達陽性的乳腺癌患者的無進展生存期及生存率往往較短,且對放、化療及內分泌治療等敏感性下降[16]。SATB1是一種組織特異性表達的核基質結合區結合蛋白,可參與T細胞的發育和成熟,研究顯示SATB1與乳腺癌發展的惡性進程有關,其高表達可能提示乳腺癌的預后不良[7]。CK5/6屬于細胞角蛋白家族中的一員,主要表達于上皮組織的基底細胞層,CK5/6陽性是三陰性乳腺癌患者預后的重要危險因素,與CK5/6 陰性患者相比,CK5/6陽性的患者可以更多地從蒽環聯合紫杉類化療中獲益[17]。因此,這些分子標志物都是乳腺癌相關的預后分子標志,術前通過無創的超聲檢測方式鑒別其在乳腺癌中的表達狀態對臨床診治可提供一定參考價值。
超聲檢查是目前乳腺檢查中應用最廣泛的一種檢查手段,可用來判斷腫塊部位、大小及性質[18]。本研究結果顯示,常規超聲特征中是否有微鈣化與VEGF、CK5/6表達水平有關,腫塊邊緣狀態和是否有微鈣化與SATB1表達水平有關,可見微鈣化的發生對判斷乳腺癌預后因子的表達至關重要。微鈣化是由于腫瘤細胞生長過快,癌細胞氧耗增加導致營養供應不足,從而發生變性溶解,引起鈣鹽沉積而形成的。腫瘤的惡性程度越高越容易發生微鈣化,而惡性程度高的腫瘤往往也預后較差[19]。此外,腫塊邊緣狀態也可能是乳腺癌預后因子SATB1陽性表達的預測因素,相對于SATB1陰性者,陽性者可能更成“侵襲性”生長,對周圍組織有浸潤,并且存在炎性反應,故具有上述邊緣不規整的征象出現[10]。
SWE能實時采集乳腺正常組織和病灶成像速度方面的變化,亦能通過實時獲取局部組織的定性表現來直觀反映病變組織的空間分布,為乳腺良惡性病變的鑒別診斷提供了新的依據[20]。本研究中探討了乳腺癌典型SWE征象 “硬環征”和“黑洞征”與預后分子標志物的相關性,結果顯示,SATB1和CK5/6陽性者出現“硬環征”的比例均顯著高于陰性者,而出現黑洞征的比例在各組陽性和陰性者中的比例無顯著差異。對于“硬環征”的出現,有研究[20]提出了兩種解釋,一種是促纖維結締組織增生導致間質組織致密纖維化,或癌細胞浸潤間質組織,導致病灶周緣硬度增加,第二種是剪切波在經過乳腺惡性病灶周緣時,能量發生衰減,以致進入病灶內部時振幅和/或噪聲減少,而導致硬環征的產生。張美戀[20]的研究顯示,“硬環征”對乳腺癌的惡性病灶具有預測作用,也在一定程度上反映了疾病的預后不良,因此是乳腺癌預后因子陽性表達的危險因素。
CEUS能夠充分顯示腫瘤新生血管,從而為評價乳腺腫瘤的微血管灌注提供了可能。本研究中只分析了病灶的CEUS增強強度以及病灶是否早于周邊正常組織增強或消退。結果顯示,CEUS表現高增強、晚消退與VEGF和CK5/6陽性表達有關,晚消退與SATB1陽性表達有關。乳腺癌是一種血管依賴性病變,新生血管由于缺乏肌層,管壁較薄且走形扭曲,容易形成動靜脈瘺,這可能會導致乳腺癌CEUS的高增強,此外,而新生血管扭曲,狹窄,并且內部易有癌栓形成,阻塞出路,這可能是出現晚消退的原因。本研究結果提示,CEUS表現高增強和晚消退可以預測乳腺癌預后因子的表達。
4 結論
本研究結果顯示,乳腺癌多模態超聲特征可用于預測VEGF、SATB1和CK5/6的表達狀態,從而為疾病的臨床診治提供重要參考依據。

