不同方法測定水中丁基黃原酸的差異性分析
(上海市環境監測中心,上海 200030)
0 引言
丁基黃原酸鹽結構式為C4H9OCSSK,是黃原酸鹽的一種。黃原酸鹽俗稱黃藥,是有色金屬選礦工藝中應用最廣的高效廉價捕集劑,廣泛應用于各種有色金屬硫化礦的混合浮選[1-3],類別主要有乙基、異丙基、丁基、異丁基、戊基、異戊基的黃原酸鹽,其中國內最常見的為丁基黃原酸[4]。丁基黃原酸鹽性質極不穩定,堿性條件下相對穩定,酸性條件下極易分解。丁基黃原酸具有中等毒性,會傷及人的神經系統和肝臟器官。水溶性強,易對水環境產生污染,不合格的處理廢水排放會污染水體質量,嚴重破壞水域生態平衡,危害人體健康。其對飲用水源存在潛在安全風險,被列為水環境質量的主要監控對象之一[5]。
丁基黃原酸在GB 3838—2002 《地表水環境質量標準》、GB 5749—2006《生活飲用水衛生標準》和DB 31/199—2018《上海市污水綜合排放標準》中均有相當嚴格的標準限值要求,分別為0.005,0.001 和0.005 mg/L(一級)。因此,為配套現行環境質量標準和污水排放標準,采用高靈敏度、高準確性的檢測方法勢在必行。實際水樣中,尤其廢水樣品基質復雜,丁基黃原酸的檢測一直是個技術難點,不同實驗室之間的數據很難一致。目前水質中丁基黃原酸的分析方法主要有銅試劑亞銅分光光度法[6]、紫外分光光度法[7-8]、吹掃捕集氣相色譜質譜法[9]和超高效液相色譜串聯質譜法[10-12]等。銅試劑亞銅分光光度法方法繁瑣冗長,且毒性較強,抗干擾性差,不具普適性,故不在本文討論范圍內。本文主要針對紫外分光光度法、吹掃捕集/氣相色譜-質譜(P&T-GC/MS)法和液相色譜-三重四極桿串聯質譜(VPLC-MS/MS)法3種方法,分別從樣品的采集和保存、方法原理、方法性能、干擾和影響等多方面因素,結合實際分析的比對結果,對容易出現的測定結果不理想以及定性定量等問題進行深入研究。通過對檢測方法的差異性分析,選擇最優的方法,滿足各種水質分析要求,以期為丁基黃原酸的準確測定提供技術參考。
1 實驗部分
1.1 儀器與試劑
主要儀器:島津UV-2600 紫外可見分光光度計(日本);Agilent 7890A-5977 氣相色譜-質譜聯用儀(美國);OI 4660 吹掃捕集儀(美國);氣相色譜柱DB 624(60 m × 0.20 mm × 1.12 μm);Waters ACQUITY UPLC H-Class XEVO TQD 超高效液相色譜質譜聯用儀(美國),帶ESI 源;液相色譜柱Waters ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm)(美國)。
主要試劑:丁基黃原酸鉀(100 μg/mL),氟苯(內標,100 μg/mL),2,4-二氯苯氧乙酸-13C6(內標,100 μg/mL)均產自o2si 公司;氨水(Sigma-Aldrich,HPLC級),甲醇HPLC 級(德國Merck 公司);濃磷酸(分析純);氫氧化鈉(分析純);硫代硫酸鈉(分析純);水相濾膜(孔徑為0.22 μm)。
1.2 P&T-GC/MS 儀器使用條件
吹掃捕集條件:取樣體積為5 mL;吹掃溫度為40 ℃;吹掃流速為40 mL/min;吹掃時間為11 min;脫附溫度為180 ℃;脫附時間為1 min;烘烤溫度為190 ℃;烘烤時間為10 min。
氣相色譜分析條件:程序升溫40 ℃保持1.0 min,以5 ℃/min 升至120 ℃,保持1.0 min,再以20℃/min 升至250 ℃,保持2.0 min;進樣口溫度為230℃;載氣流量為1.0 mL/min;分流進樣(分流比5∶1)。
質譜分析條件:電子轟擊源為EI 源;離子化能量為70 eV;離子源溫度為230 ℃;傳輸線溫度為280 ℃;全掃描,掃描范圍在30~260 amu;四極桿溫度為150 ℃;溶劑延遲時間為6 min;定量離子為二硫化碳m/z:76,氟苯m/z:96。
1.3 UPLC-MS/MS 儀器方法
流動相A 為氨水溶液(pH 值為9.5),B 為甲醇,流速為0.2 mL/min,梯度洗脫程序:0~1.5 min,體積分數為80%A;1.5~2.5 min,體積分數為80%~10%A;2.5~3.5 min,體積分數為10%A;3.5~4.0 min,體積分數為10%~80%A。柱溫為40 ℃,進樣體積為10 μL。
采用電噴霧離子源(ESI),負離子掃描,多反應監測(MRM)模式。離子源溫度為150 ℃,離子化電壓為3 kV,具體質譜參數見表1。

表1 目標化合物的質譜參數
2 結果與討論
2.1 樣品的采集和保存
丁基黃原酸極不穩定,故其水樣的采集和保存是監測的重要環節之一。HJ 896—2017 氣相色譜-質譜法和HJ 1002—2018 液相色譜-三重四極桿串聯質譜法均要求水樣保存在弱堿性條件下。采用HJ 756—2015 采用紫外分光光度法的水樣在中性條件下可保存3 d。經驗證:丁基黃原酸在中性條件下降解極快,而在pH 值為10 的條件下避光4 ℃保存,48 h 內降解速率較慢,降解率<30%。其次,加入Na2S2O3有助于樣品保存,但會對UPLC-MS/MS 法產生干擾而不適用。建議為準確定量丁基黃原酸,應在弱堿性條件下保存且盡快分析。采樣要求的差異性比較見表2。

表2 采樣要求的差異性比較
2.2 方法原理
黃原酸類化合物在波長301 nm 處有最強吸收峰,遇酸發生分解,吸收峰消失。紫外分光光度法通過加酸分解前后的吸光度差值可間接測定黃原酸的總量濃度。
P&T-GC/MS 法利用了黃原酸類化合物遇酸分解產生二硫化碳(CS2),通過測定加酸前后CS2的濃度間接測定水中黃原酸類的總量濃度。CS2經高純N2吹掃后吸附于捕集管中,采用迅速加熱捕集管并以高純N2反吹進行熱脫附,再經氣相色譜分離后通過質譜檢測器檢測。
在同一生境中,植物必然會競爭空間、養分等,甚至會產生一些次生物質,對其他植物產生不利的影響,即化感作用[20-22]。紫莖澤蘭具有較強的化感作用,其提取物能抑制多種植物的種子萌發和幼苗生長[23]。而地桃花是在紫莖澤蘭下可正常生長并表現出一定競爭優勢的一種植物。通過試驗發現,地桃花提取物在濃度為10 mg/mL時對刺莧和稗的抑制效果分別達75.70%、62.01%,但其效果比已成功研發的植物源除草劑癸酸低15%左右。可以通過活性成分分離、鑒定來提高產品效果[24],具體原因還需要進一步深入研究。
UPLC-MS/MS 法為水樣經孔徑為0.22 μm 水相濾膜直接進樣,液相色譜分離后,串聯質譜儀在多反應監測模式下測定,是唯一可對丁基黃原酸的具體組分準確定性定量的分析方法。由于不涉及任何前處理,對基質復雜的污水樣品直接進樣時,會大幅增加儀器的維護成本和損耗風險。3 種方法原理差異性比較見表3。

表3 3 種方法原理差異性比較
2.3 方法性能
3 種方法均適用地表水、地下水、生活污水和工業廢水的檢測。丁基黃原酸被列為GB 3838—2002《地表水環境質量標準》集中式生活飲用水地表水源地水質特定監測項目,質量濃度限值為5 μg/L。其中紫外分光光度法的檢出限(4 μg/L)雖滿足了限值要求,但其測定下限高于限值要求,應用存在一定的局限性。其它2 種方法均可滿足現有的任一標準限值要求。3 種方法性能的差異性比較見表4。

表4 3 種方法性能的差異性比較
2.4 干擾和影響
紫外分光光度法為非專用檢測器,任何在301 nm 波長處有吸收的物質,如懸浮物、有色物質、硝酸鹽等其它共存物均會產生假陽性的分析結果。此外研究表明[13]亞硫酸鹽、連二硫酸鹽、偏亞硫酸氫鹽等通過譜圖掃描在301 nm 處沒有吸收峰,但是在加酸酸化后生成的SO2在301 nm 處有吸收峰,給測定帶來負干擾。故此方法存在一定的使用局限性。
P&T-GC/MS 法定性定量基本準確。但因其主要是通過測定加酸前后CS2的濃度來間接測定黃原酸鹽的總量,故任何影響CS2轉換效率或吹掃捕集效率的因素,如電導率、高氯含量或氧化性物質的共存干擾等均會大大降低丁基黃原酸的定量準確性。此外,代森鋅類農藥或化學試劑DDTC 有與黃原酸相似的結構特點,也會遇酸生成CS2,會對測定結果產生假陽性。
以上2 種間接測定法在選擇性方面均難以滿足丁基黃原酸準確測定的要求,考慮到丁基黃原酸普遍只在選礦廢水中存在,建議若水樣中檢出丁基黃原酸,必要時還需采用其他方法進一步確認。
UPLC-MS/MS 法定性定量最為準確,抗干擾能力最強。但由于丁基黃原酸在液質上不同pH 值時電離程度差別很大,故必須嚴格把控實驗環節中流動相體系、校準曲線和實際水樣的pH 值一致,否則會產生分析偏差。3 種方法抗干擾能力的差異性比較見表5。

表5 3 種方法抗干擾能力的差異性比較
2.5 實際樣品測定結果
分別使用3 種檢測方法,對本市某污水廠Z 總排口廢水樣品(采樣時加氨水,堿性條件下保存)進行實際樣品和樣品加標分析,分析結果見表6。由表6可以看出,使用P&T-GC/MS 法和UPLC-MS/MS法均未檢出丁基黃原酸,而紫外分光光度法卻檢出丁基黃原酸質量濃度為35.6 μg/L,即高出前2 種方法2~3 個數量級,方法間數值偏差較大。

表6 實樣測定結果的差異性比較

表7 基質測定結果的差異性比較
從加標回收數據判斷,P&T-GC/MS 法雖然方法精密度良好,6 次基質加標平行測定的相對偏差為8.7%,但其加標回收率最差,僅22.4%,存在嚴重的負干擾。類似的干擾問題也同樣存在于本市污水廠S 和污水廠W 的出口廢水樣品中。具體見表8。P&T-GC/MS 法在測定水樣中的丁基黃原酸時,雖靈敏度高,對干凈基質樣品(如地表水樣品,6 次平均加標回收率為86.0%)可準確定性定量,但對經污水處理工藝排放的廢水樣品,僅可準確定性,不能準確定量。其在廢水等復雜基質的分析應用上存在一定的局限性。

表8 不同點位污水廠樣品測定結果(P&T-GC/MS 法)
UPLC-MS/MS 法測定實際樣品加標的回收率最為理想,分別在96.0%~112%范圍內。該方法可同時對水環境基質和廢水基質中的丁基黃原酸準確定性定量,且抗干擾強,靈敏度高。當使用其它方法在水樣中檢出丁基黃原酸時,亦可使用本方法進行定性驗證。具體見表9。
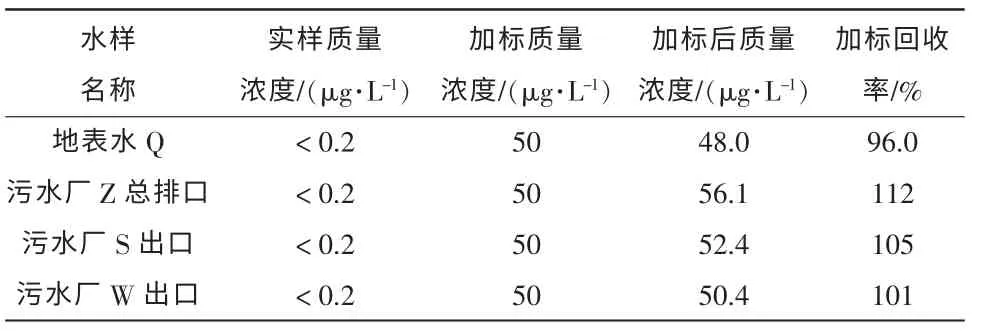
表9 不同實樣測定結果(UPLC-MS/MS 法)
2.6 3 種方法適用性的探討
紫外分光光度法操作最簡便,檢出限質量濃度為4 μg/L,雖滿足地表水環境質量標準對丁基黃原酸的限值要求,但其測定下限質量濃度為16 μg/L仍高于限值要求。懸浮物、有色物質、硝酸鹽等其它共存物會產生假陽性的分析結果。使用該方法在水樣中檢出丁基黃原酸,有必要選用其他分析方法進一步確認。此外,其樣品的采集和保存方法建議與其它方法一致,在弱堿性條件下避光保存且盡快分析。
P&T-GC/MS 法通過測定加酸前后水樣中CS2的濃度來間接測定黃原酸的總量濃度。該方法靈敏度高,檢出限質量濃度為0.04 μg/L。對干凈基質樣品(如潔凈地表水)可準確定性定量。但對高電導率樣品或氧化性物質共存的水樣,如經污水處理工藝排放的廢水樣品,容易產生負干擾,不能準確定量。建議使用氣/質方法測定丁基黃原酸時,如遇樣品有檢出或懷疑假陽性干擾,需做進一步驗證。
UPLC-MS/MS 法水樣經0.22 μm 濾膜過濾后直接進樣,經液相色譜分離,通過多反應監測(MRM)模式檢測。檢出限質量濃度為0.2 μg/L,水樣加標回收率在96.0%~112%。該方法操作簡單、快速,靈敏度高,抗干擾能力強,可對水樣中的丁基黃原酸準確定性定量。但基質復雜的污水樣品直接進樣,會增加液質儀器質譜部分的損耗風險。考慮到丁基黃原酸一般僅存在于選礦廢水中,故建議在實驗室的常規分析中,可使用其他簡便方法進行丁基黃原酸的測定,而對有檢出樣品再以液質聯用方法作為定性驗證補充。
3 結論
針對水質中丁基黃原酸的3 種檢測方法(紫外分光光度法、P&T-GC/MS 法、UPLC-MS/MS 法),從樣品采集、方法原理、方法性能、干擾和影響、實樣檢測等多方面進行橫向比較和討論,選擇最優的方法對廢水中丁基黃原酸進行檢測,保證檢測結果準確。分析了水質檢測應用的差異性,詳細說明了各自的優缺點和適用性,并對實測數據之間的矛盾進行了解釋,解決了原紫外分光光度法假陽性干擾的難題。

