青紫顆粒制備工藝及質量控制方法研究
馬葆睿,倪健,龐琳諾,蔡夢如,覃柳瑩,白杰,張志勤,張萌,王曉玲,曲昌海
(1.北京中醫藥大學中藥學院,北京102488;2.首都醫科大學附屬北京兒童醫院,北京100045)
青紫顆粒以首都醫科大學附屬北京兒童醫院院內制劑青紫合劑為基礎,經改劑型而成。該方在臨床已實踐多年,廣泛應用于治療過敏性紫癜及其合并癥,療效確切[1]。青紫顆粒由青黛、紫草、茵陳、丹參等藥味組成,藥理試驗研究表明青紫顆粒可有效改善因卵蛋白所致過敏性紫癜大鼠炎癥反應和腎臟組織病理學損害[2]。青黛、紫草均有抗感染、鎮痛的作用[3-4];丹參有活血、涼血消癰的作用,有研究表明其主要成分丹酚酸B對慢性血清病腎炎大鼠腎臟具有一定的保護作用[5],茵陳具有清熱利濕、利膽退黃的作用,其中綠原酸具有良好的抗炎作用[6]。本研究建立青紫顆粒中丹酚酸B和綠原酸的含量測定方法,并將此方法用于青紫顆粒制備工藝過程的質量控制,并對中試樣品中丹酚酸B 和綠原酸含量進行測定。
1 儀器與試藥
1.1 儀器
LC-20AT 高效液相色譜儀、SPD-M20A 檢測器(日本島津公司);SB-5200DTD 超聲波提取器(寧波新芝生物科技股份有限公司);MS105DU 分析天平(0.01 mg,瑞士梅特勒-托利多儀器有限公司);YP5002電子天平(上海佑科儀器儀表有限公司)。
1.2 藥品與試劑
青黛(生產批號:20180328)、紫草(生產批號:20180704)、茵陳(生產批號:20181020)、綿馬貫眾(生產批號:20171213)、丹參(生產批號:20181006)、白芷(生產批號:20180411)、北寒水石(生產批號:20180407)、威靈仙(生產批號:20180923),以上藥材均購自北京本草方源藥業有限公司,經北京本草方源藥物有限公司研究助理王穎鑒定為正品。丹酚酸B(批號111562-201917,質量分數96.6%)、綠原酸(批號110753-201817,質量分數96.8%)中國食品藥品檢定研究院提供;3 批青紫顆粒(自制,批號201015、201016、201017);甲醇、乙腈(色譜醇,Fisher 公司);純凈水(娃哈哈集團有限公司);其他試劑均為分析純。
2 方法與結果
2.1 HPLC法測定丹酚酸B與綠原酸的質量分數
2.1.1 色譜條件 色譜柱:Agilent Zorbax SB-C18色譜柱(4.6 mm×250 mm,5 μm);流動相:以乙腈為流動相A,0.1%磷酸為流動相B,梯度洗脫(0~25 min,7%A;25~26 min,7%A~21%A;26~55 min,21%A;55~56 min,21%A~7%A;56~75 min,7%A);流速:1 mL/min;檢測波長:286 nm(丹酚酸B)和327 nm(綠原酸);柱溫:30 ℃;進樣量:10 μL。
2.1.2 對照品溶液的制備 取丹酚酸B 對照品及綠原酸對照品適量,精密稱定,置25 mL 棕色量瓶中,加75%(體積分數,下同)甲醇制成每1 mL 含丹酚酸B 784.39 μg、綠原酸170.37 μg 的母液,取0.5 mL 母液置于10 mL棕色量瓶中,加75%甲醇至刻度,即得每1 mL 含丹酚酸B 39.22 μg、綠原酸8.52 μg 的混合對照品溶液。
2.1.3 供試品溶液的制備 顆粒供試品溶液:取顆粒適量,研成細粉,取約0.5 g,精密稱定,置于50 mL具塞錐形瓶中,精密加入75%甲醇溶液50 mL,稱定質量,超聲提取30 min(300 W,40 kHz),放冷后稱定質量,用75%甲醇溶液補重,濾過,制得顆粒供試品溶液。
提取液供試品溶液:取浸膏粉約1 g,精密稱定,置于50 mL 具塞錐形瓶中,精密加入75%甲醇溶液50 mL,稱定質量,超聲提取30 min(300 W,40 kHz),放冷后稱定質量,用75%甲醇溶液補足損失的質量,濾過,制得浸膏粉供試品溶液。
2.1.4 陰性樣品溶液的制備 同法分別自制不含丹參及茵陳的陰性樣品,按照“2.1.3”項同法處理制得陰性供試品溶液。
2.1.5 系統適應性試驗 精密吸取混合對照品溶液、供試品溶液和陰性樣品溶液進樣檢測,記錄色譜圖,結果顯示供試品溶液色譜圖中丹酚酸B 和綠原酸與對照品色譜峰對應的位置上無干擾峰出現,且分離度均大于1.5,理論塔板數大于4 000,表明方法專屬性良好,見圖1。
2.1.6 線性關系考察 精密吸取“2.1.2”項下對照品溶液4、7、10、13、16 μL,進樣測定峰面積。以進樣量為橫坐標(X,μg),峰面積為縱坐標(Y)進行線性回歸,得丹酚酸B 回歸方程為Y=10 06494.14X+391.8,r=1.000 0,進樣量在0.16~0.63 μg范圍內線性關系良好;綠原酸回歸方程為Y=2 895 406.89X-880.07,r=1.000 0,進樣量在0.03~0.14 μg 范圍內線性關系良好。

圖1 各成分高效液相色譜圖Figure 1 HPLC chromatograms of each constituent
2.1.7 精密度試驗 精密吸取同一份對照品溶液適量,在“2.1.1”項色譜條件下進樣測定6次,測得丹酚酸B 和綠原酸峰面積RSD 值分別為1.21%、0.35%,表明儀器精密度良好。
2.1.8 重復性試驗 稱取青紫顆粒(批號:201015)約0.5 g,共6 份,按“2.1.3”項方法制備供試品溶液,在“2.1.1”項色譜條件下進樣測定,測得丹酚酸B 質量分數為2.96 mg/g,其RSD 值為1.52%;綠原酸質量分數為0.74 mg/g,其RSD值為0.55%。
2.1.9 穩定性試驗 取青紫顆粒(批號:201015)供試品溶液,于0、4、6、8、10、12、24 h 在“2.1.1”項色譜條件下進樣測定,測得丹酚酸B 和綠原酸峰面積RSD值分別為0.67%、1.15%。
2.1.10 加樣回收率試驗 取已知質量分數(丹酚酸B:2.96 mg/g;綠原酸:0.74 mg/g)的青紫顆粒(批號:201015)0.25 g,精密稱定9 份,分3 組,每組3 份,分別按樣品中丹酚酸B及綠原酸含有量與相應對照品加入量的比例約為1∶0.8、1∶1、1∶1.2,加入丹酚酸B、綠原酸混合對照品儲備液(丹酚酸B:0.740 mg/mL;綠原酸:0.189 mg/mL)0.8、1.0、1.2 mL,在“2.1.1”項色譜條件下進樣測定,計算回收率結果見表1和表2。
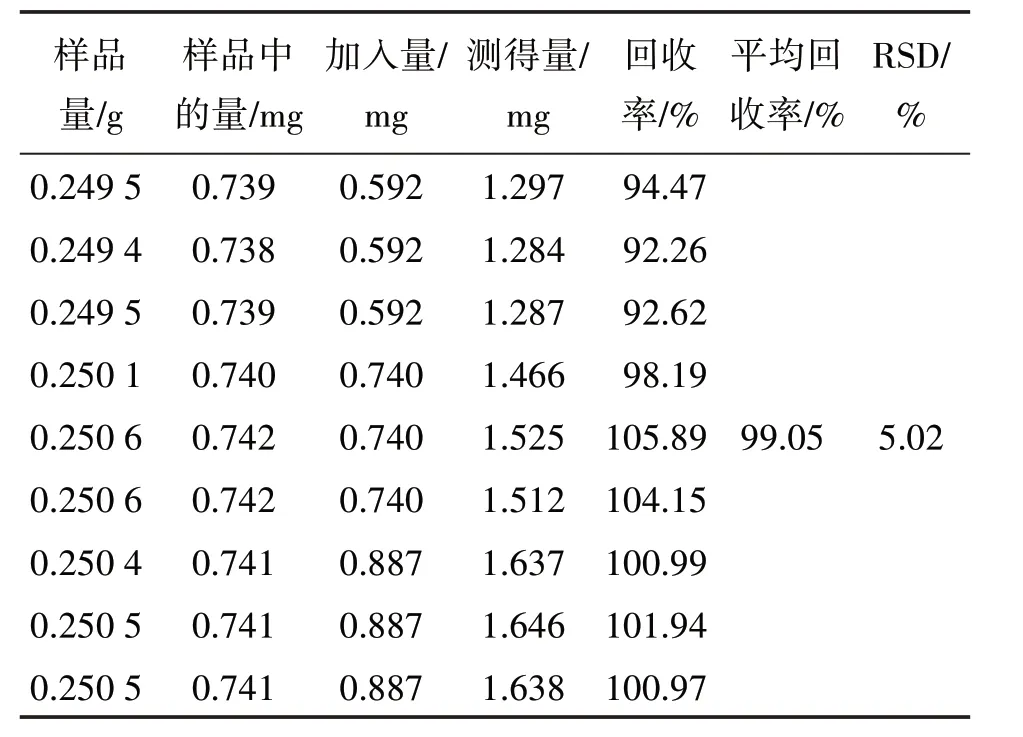
表1 丹酚酸B加樣回收率試驗結果(n=9)Table 1 Results of recovery tests of salvianolic acid B
2.2 提取工藝考察
2.2.1 正交試驗 以綠原酸及丹酚酸B 提取率為考察指標,選取提取次數(A)、提取時間(B)、加水倍量(C)為影響因素,采用正交設計優選最佳水提工藝。因素水平見表3,試驗設計與結果見表4,方差分析結果見表5、表6。根據K 值直觀分析表確定最佳工藝為A2B1C3,即加12倍量水,提取2次,每次1 h。
2.2.2 驗證試驗 按優選工藝A2B1C3進行3 批驗證試驗,即加12 倍量水,提取2 次,每次1 h,考察工藝穩定性。驗證結果見表6,結果表明該提取工藝合理,穩定可行。
2.3 濃縮溫度考察
以綠原酸及丹酚酸B 的提取率為考察指標,對水提液的最佳濃縮溫度進行考察。按照之前所考察的優選工藝進行提取,分別在60、70、80 ℃下減壓濃縮至一定體積(相對密度為1.05~1.10),放冷,加水復溶至原體積后測定綠原酸及丹酚酸B 的含量,計算不同溫度下濃縮前后綠原酸、丹酚酸B 的轉移率,測定結果見表7,結果表明兩種成分幾乎沒有損失,濃縮溫度在80 ℃以下即可。
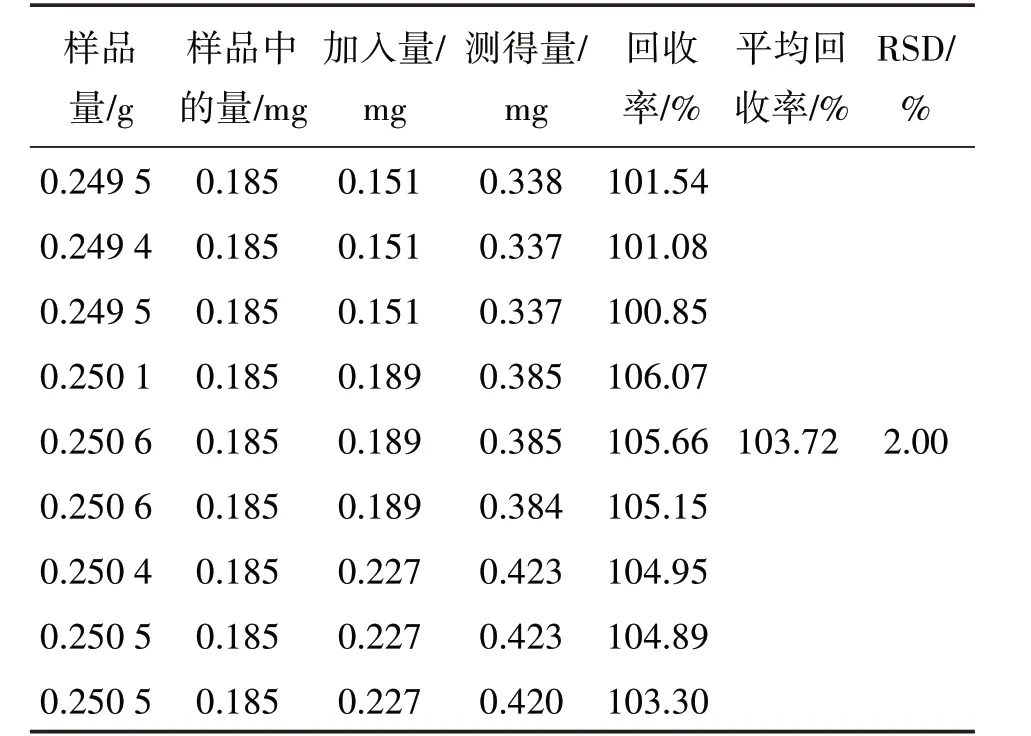
表2 綠原酸加樣回收率試驗結果Table 2 Results of recovery tests of chlorogenic acid(n=9)
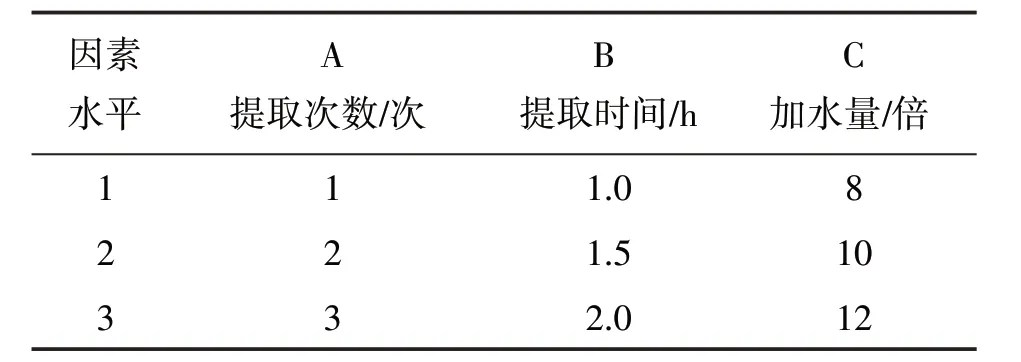
表3 因素水平表Table 3 Design of factor and level
2.4 干燥溫度考察
按優選的提取濃縮工藝得到稠膏,分別在60、70、80 ℃下減壓干燥一定的時間,得干浸膏,復溶后進行檢測,結果見表8。可見,干燥溫度在60~70 ℃時,2 種成分的損失率均在10%以內,損失較少,表明干燥溫度在70 ℃以下即可。
2.5 樣品含量測定
采用優選得到的提取濃縮干燥工藝參數進行中試放大研究,將浸膏粉∶糊精∶蔗糖以5∶3∶2(質量比)的比例混合均勻,加入0.04%糖精鈉為矯味劑,2%聚乙烯吡咯烷酮的95%乙醇溶液為潤濕劑進行制粒,并對所得中試樣品進行測定。
取3 批青紫顆粒樣品(201015、201016、201017)按“2.1.3”項方法制備供試品溶液,并在“2.1.1”項色譜條件下進樣測定,分別計算丹酚酸B、綠原酸2 種成分的質量分數,結果見表9。
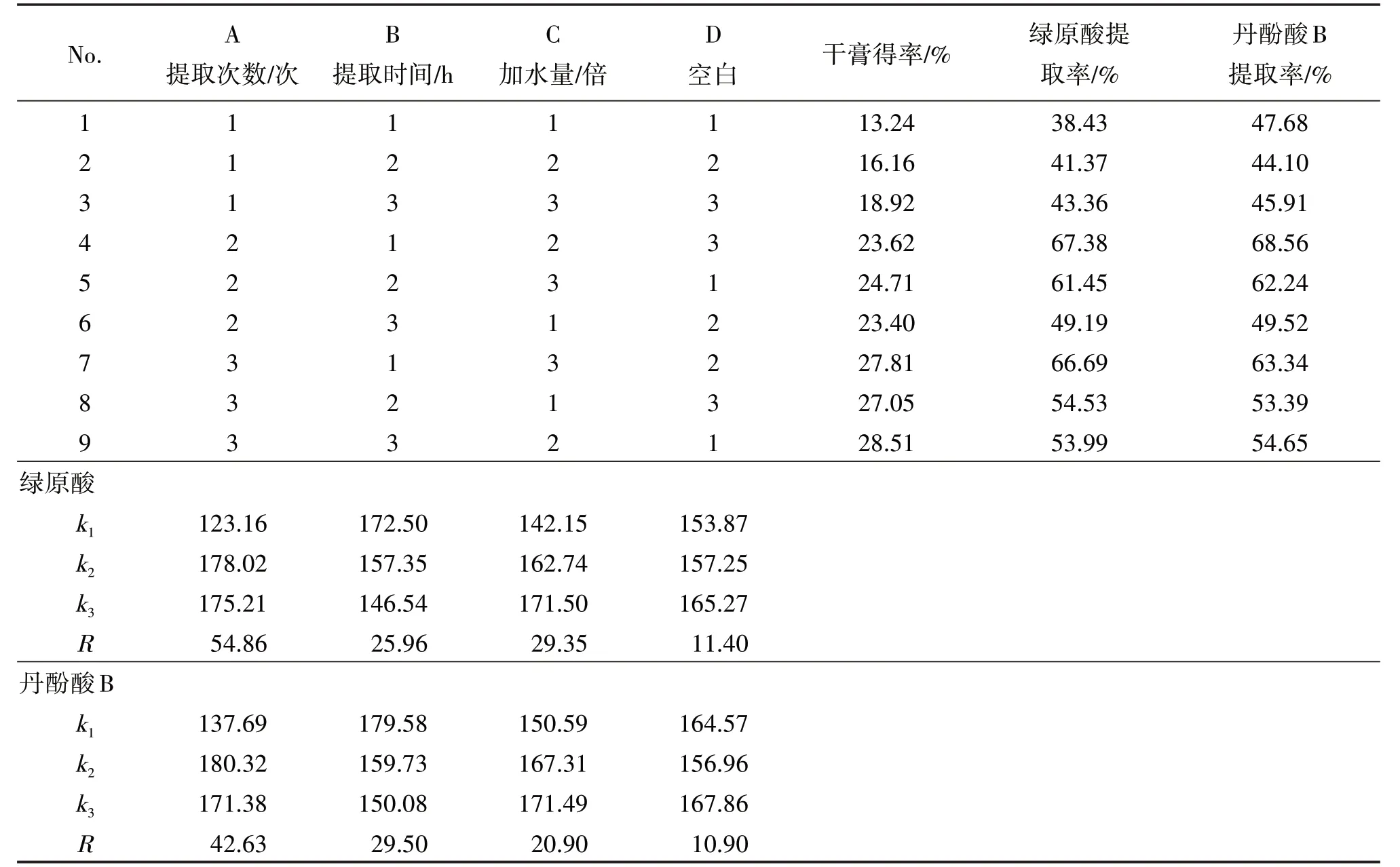
表4 水提工藝直觀分析表Table 4 Visual analysis table of water extraction process
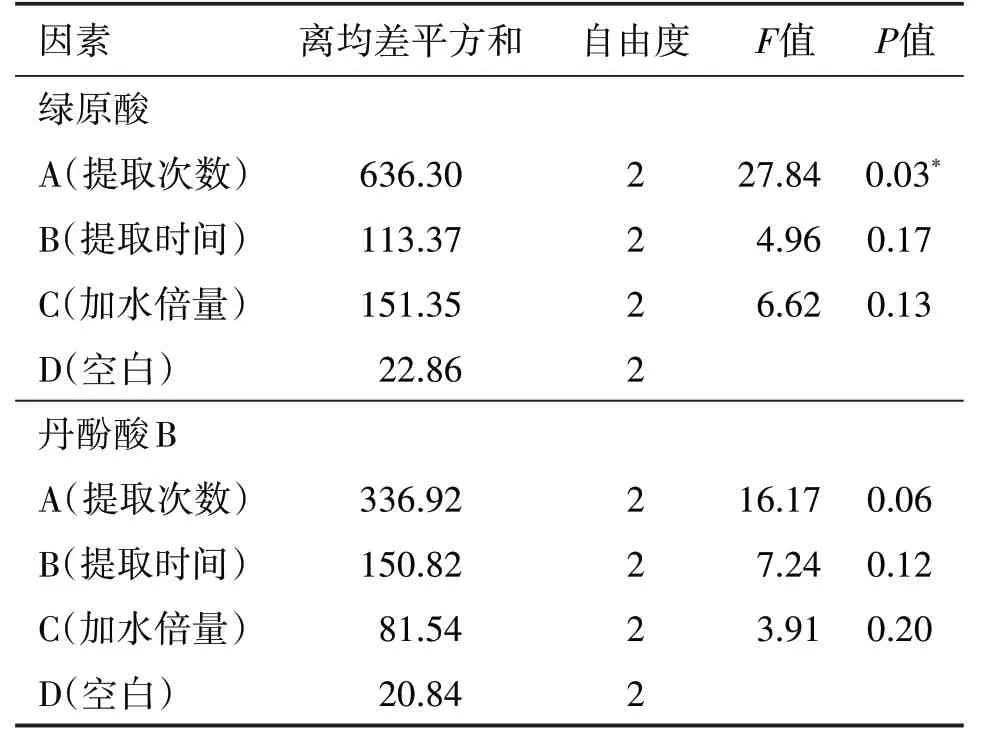
表5 綠原酸與丹酚酸B提取率方差分析表Table 5 Variance analysis of extraction rate of chlorogenic acid and salvianolic acid B
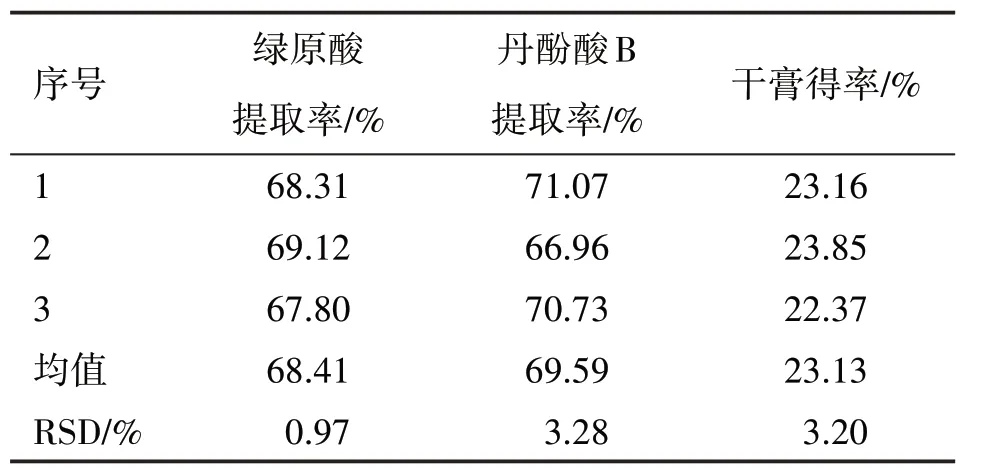
表6 驗證試驗結果Table 6 Verification test
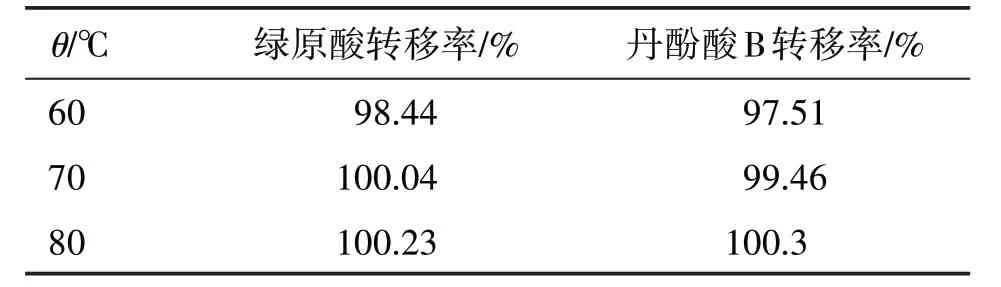
表7 濃縮溫度考察結果Table 7 Results of concentration temperature(n=3)
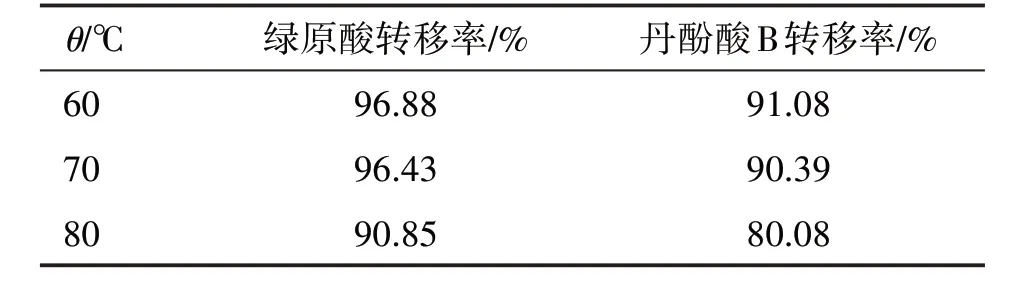
表8 干燥溫度考察Table 8 Results of drying temperature(n=3)
3 討論
3.1 供試品溶液制備方法的選擇
在供試品溶液制備時,以青紫顆粒中的丹酚酸B 和綠原酸的提取率為指標,首先對比考察了不同提取溶劑(甲醇、75%甲醇、水)[7-9],結果顯示75%甲醇作為提取溶劑時,2 種檢測成分的提取率較佳,且無雜質峰干擾。對不同溶劑倍量(25、50、100、150倍)進行考察,結果顯示在溶劑倍量為50 倍時2 種成分已經可以提取完全。最終選擇100 倍劑量即50 mL的75%甲醇為溶劑對供試品進行提取。
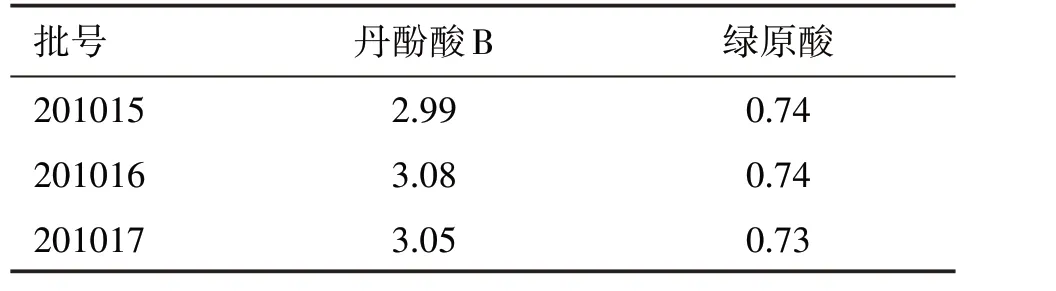
表9 3批青紫顆粒中丹酚酸B、綠原酸質量分數測定結果Table 9 The contents of salvianolic acid B and chlorogenic acid in three batches of Qingzi granules w/(mg·g-1)
3.2 指標性成分的選擇
本試驗在保留青紫合劑水提工藝的基礎上對指標性成分進行篩選,青黛中靛玉紅提取率不足5%,故未選為指標性成分,紫草中有效成分未檢出。最終選擇君藥茵陳中的綠原酸及臣藥丹參中的丹酚酸B為指標性成分,結果重復性好,穩定性佳。
3.3 流動相和波長的選擇
試驗對甲醇-0.1%磷酸、乙腈-0.1%磷酸2 種流動相系統進行考察[10-12],波長的選擇參照2020 年版《中國藥典》選擇286 nm(丹酚酸B)與327 nm(綠原酸),以青紫顆粒中丹酚酸B 和綠原酸的峰形、分離效果和色譜圖中基線平穩、雜質干擾為指標,結果顯示乙腈-0.1%磷酸系統效果較佳,最終選擇該系統,按照一定的流動相比例作為樣品的測定條件。
3.4 提取工藝的選擇
由正交試驗結果可知,綠原酸提取率的影響因素順序為A>C>B,即提取次數>加水倍量>提取時間;丹酚酸B 提取率的影響順序為A>B>C,即提取次數>提取時間>加水倍量。方差分析發現,對于綠原酸,提取次數的影響最顯著,根據K值直觀分析表可發現2 個指標成分的最佳工藝均為A2B1C3,故選擇最優提取工藝為A2B1C3,即加12 倍量水,提取2次,每次1 h。由濃縮及干燥溫度考察試驗結果可知,此兩種成分在高溫下損失率均不太大,因此將濃縮溫度控制在80 ℃以下,干燥溫度在70 ℃以下即可,為今后的大規模生產提供了依據。
本研究采用HPLC 梯度洗脫法對青紫顆粒中丹酚酸B 和綠原酸進行了同時測定,建立了青紫顆粒中多指標質量控制模式,所建立的含量測定方法操作簡便,專屬性強,結果準確,為青紫顆粒質量評價提供了依據。

