螺旋藻養(yǎng)殖加工和安全性研究進(jìn)展
許洪高 周琪樂 魯緋
摘要:螺旋藻(Spirulina)是四大人工養(yǎng)殖微藻中產(chǎn)量和產(chǎn)值最大的微藻,在營(yíng)養(yǎng)健康、畜牧養(yǎng)殖、固碳減排、環(huán)境工程等領(lǐng)域的作用正被越來越充分地認(rèn)識(shí)和挖掘。我國(guó)的螺旋藻粉產(chǎn)量占全球產(chǎn)量的80%,市場(chǎng)上流通的螺旋藻產(chǎn)品(粉、片、膠囊等)中,90%屬于膳食補(bǔ)充劑。本文主要立足于營(yíng)養(yǎng)健康領(lǐng)域,對(duì)螺旋藻產(chǎn)業(yè)化養(yǎng)殖、加工環(huán)節(jié)的影響因素和研究進(jìn)展進(jìn)行綜述,同時(shí)概述螺旋藻產(chǎn)品的營(yíng)養(yǎng)特性和安全特性,最后對(duì)不同國(guó)家和地區(qū)的螺旋藻產(chǎn)品標(biāo)準(zhǔn)進(jìn)行梳理,并對(duì)螺旋藻產(chǎn)業(yè)在營(yíng)養(yǎng)健康領(lǐng)域的發(fā)展方向進(jìn)行展望。可進(jìn)行CO2生物轉(zhuǎn)化和具有可持續(xù)發(fā)展特性的螺旋藻產(chǎn)業(yè),需要在提高單位產(chǎn)量、養(yǎng)殖作業(yè)標(biāo)準(zhǔn)化的基礎(chǔ)上,提升產(chǎn)品的安全性以及結(jié)合物聯(lián)網(wǎng)技術(shù),大力拓展新鮮螺旋藻在營(yíng)養(yǎng)健康領(lǐng)域的應(yīng)用。
關(guān)鍵詞:螺旋藻;養(yǎng)殖;加工;營(yíng)養(yǎng);安全性;質(zhì)量
螺旋藻(Spirulina)是低等原核生物“節(jié)旋藻”的別稱,是一種堿性水體(pH值約為9.5)中天然存在的浮游光合藍(lán)細(xì)菌,少數(shù)屬于底棲型[1]。螺旋藻由單列細(xì)胞組成不分枝絲狀體,藻絲體長(zhǎng)為200~500 μm,寬為5~10 μm,呈疏松或緊密的有規(guī)則的螺旋形彎曲,在生長(zhǎng)到一定長(zhǎng)度(螺旋數(shù))后通過斷裂進(jìn)行繁殖。1519年,西班牙科學(xué)家Hernando Cortez在墨西哥的Texcoco湖首次發(fā)現(xiàn)螺旋藻[2]。在南非乍得共和國(guó),螺旋藻干燥的藻泥餅粉末有與番茄醬、胡椒拌和后澆淋在食物(米飯、豆、魚、肉)上食用的習(xí)慣[3]。螺旋藻不僅可以應(yīng)用于食品(功能食品、添加劑)、醫(yī)藥(天然胡蘿卜素)和飼料工業(yè),還在環(huán)境(檢測(cè)、修復(fù))、生物技術(shù)、可再生能源等領(lǐng)域具有廣泛的應(yīng)用前景。
目前,全球螺旋藻的總產(chǎn)量約12 000 t/年,單位產(chǎn)量最高達(dá)到91.0 t/(hm2·年)[2]。我國(guó)的螺旋藻養(yǎng)殖企業(yè)有60余家,年總產(chǎn)量占全球產(chǎn)量的80%,約9 600 t[4];養(yǎng)殖面積約為750 hm2[5],單位產(chǎn)量?jī)H約13 t/(hm2·年),螺旋藻的養(yǎng)殖及管理水平還亟待提高。本文主要對(duì)螺旋藻養(yǎng)殖、采收、干燥過程中的影響因素,以及螺旋藻的營(yíng)養(yǎng)特性與安全性的研究進(jìn)展進(jìn)行綜述,旨在為螺旋藻產(chǎn)業(yè)及食品工業(yè)提供一個(gè)全面的信息。
1 螺旋藻養(yǎng)殖及影響因素
螺旋藻約有38種,人工養(yǎng)殖的螺旋藻主要是鈍頂螺旋藻(S. platensis)和極大螺旋藻(S. maxima)2種[6-7]。在生長(zhǎng)發(fā)育過程中,螺旋藻形態(tài)易因環(huán)境脅迫而發(fā)生改變,同時(shí)伴隨著生理學(xué)、營(yíng)養(yǎng)學(xué)、遺傳學(xué)、蛋白質(zhì)組學(xué)等方面的變化[8]。
1.1 螺旋藻的培養(yǎng)基組成
螺旋藻作為一種可人工大規(guī)模養(yǎng)殖的微藻,其營(yíng)養(yǎng)成分與培養(yǎng)基的組成緊密相關(guān)。在實(shí)際生產(chǎn)中,常用的有扎魯克(Zarrouk)培養(yǎng)基[1-2]、改良Zarrouk培養(yǎng)基[1]、Rao培養(yǎng)基、Oferr培養(yǎng)基[2],也可以使用其他簡(jiǎn)易培養(yǎng)基進(jìn)行養(yǎng)殖[9]。螺旋藻傳統(tǒng)養(yǎng)殖過程中的NaHCO3用量很大,一方面是提供足量的碳源,另一方面是使培養(yǎng)基pH值呈堿性,有利于螺旋藻的生長(zhǎng)。在擴(kuò)藻期,培養(yǎng)基中NaHCO3的濃度一般為8~10 g/L,正常養(yǎng)殖期間NaHCO3可降低到2.5~4.0 g/L。Olguín等曾于1998—2001年將海水與淡水以體積比1 ∶ 4混合并加入2%(體積分?jǐn)?shù))豬糞厭氧發(fā)酵后的上清液作為培養(yǎng)基養(yǎng)殖螺旋藻,同時(shí)在第0、3、5天向養(yǎng)殖池中補(bǔ)充2 g/L的NaHCO3,保持水體的pH值為9.5,螺旋藻在夏天的平均產(chǎn)量達(dá)到 14.4 g/(m2·d)(池水深為0.15 m)和 15.1 g/(m2·d)(池水深為0.20 m);養(yǎng)殖水體中的氨基態(tài)氮利用率為84%~96%,磷的利用率為 72%~87%[10]。
螺旋藻培養(yǎng)基的組成應(yīng)基于養(yǎng)殖用水的水源品質(zhì)進(jìn)行,為了避免其他藻類的生長(zhǎng)與污染,以及螺旋藻的品質(zhì),養(yǎng)殖用水必須達(dá)標(biāo),城市管網(wǎng)用水是一個(gè)便捷的選擇。養(yǎng)殖后的水體在重復(fù)利用前需進(jìn)行適當(dāng)處理,其中反滲透處理的水對(duì)螺旋藻的生長(zhǎng)影響最小,也能夠保證螺旋藻品質(zhì)的穩(wěn)定性。
養(yǎng)殖批次間增補(bǔ)的培養(yǎng)基主要是硝酸鈉或尿素,尿素和硝酸根離子能夠供給螺旋藻足夠的氮,但高濃度會(huì)致毒。螺旋藻可以在僅含硝酸根或尿素的培養(yǎng)液中生長(zhǎng),但復(fù)合使用2種氮源對(duì)螺旋藻的生長(zhǎng)有好處。磷酸鹽、Mg2+和Ca2+的添加量需要控制。K+可以適當(dāng)增加,以不超過Na+濃度的5倍為宜[2],可以基于實(shí)際生長(zhǎng)條件確定培養(yǎng)基組成。
藻類與陸生植物類似,可以通過光合作用固定二氧化碳(CO2),理論表明,1 hm2的微藻可以利用12.6%的太陽能產(chǎn)生280 t/年的干物質(zhì),相當(dāng)于生物轉(zhuǎn)化513 t CO2[11-12],Sydney等發(fā)現(xiàn),鈍頂螺旋藻(S. platensis LEB-52)的CO2生物轉(zhuǎn)化能力為318.61 mg/(L·d)[13]。有機(jī)胺作為一類CO2捕集吸附劑,固碳效率高。Da Rosa等采用CO2替代Zarrouk培養(yǎng)基中的NaHCO3作為碳源,CO2的供給量是每天每毫升培養(yǎng)液中通入0.36 mL CO2,然后在光照時(shí)間內(nèi),每小時(shí)通氣2 min,最終得到的鈍頂螺旋藻粉(Spirulina sp. LEB 18)的蛋白質(zhì)含量為60.8%,碳水化合物含量為14.4%,脂肪含量為100%[14];為了延長(zhǎng)CO2在培養(yǎng)液中的保留時(shí)間,在培養(yǎng)液中添加0.2 mmol/L乙醇胺(Ethanolamine,簡(jiǎn)稱MEA),所得螺旋藻粉的蛋白質(zhì)含量為44.4%,碳水化合物含量為282%,脂肪含量為8.3%;螺旋藻產(chǎn)量提高31.4%。但添加乙醇胺影響了螺旋藻對(duì)氮元素的生物轉(zhuǎn)化,從而螺旋藻粉中含有更多的碳水化合物。王兆印等比較乙醇胺、二乙醇胺、三乙醇胺和N-甲基-二乙醇胺對(duì)螺旋藻生長(zhǎng)和固碳的效果,發(fā)現(xiàn)三乙醇胺能夠顯著促進(jìn)螺旋藻對(duì)CO2的生物轉(zhuǎn)化,增加螺旋藻的產(chǎn)量,提高固碳速率[15];但與da Rosa等研究結(jié)果[14]相似的是螺旋藻中多糖含量增加而蛋白質(zhì)含量減少。有機(jī)胺具有一定的毒性,其用于食用螺旋藻養(yǎng)殖時(shí)存在安全風(fēng)險(xiǎn)。
1.2 螺旋藻養(yǎng)殖的影響因素
螺旋藻的生長(zhǎng)不僅取決于培養(yǎng)基組成和CO2供應(yīng),還與藻種、養(yǎng)殖池、養(yǎng)殖場(chǎng)所處地理位置、養(yǎng)殖季節(jié)(溫度、光照)、其他因素(pH值、蟲害)等密切相關(guān)。
1.2.1 藻種 鈍頂螺旋藻與極大螺旋藻的生長(zhǎng)速率不一致,在相同培養(yǎng)條件下,鈍頂螺旋藻比極大螺旋藻的生長(zhǎng)速度快。螺旋藻不同藻株的光合速率和呼吸速率不同,來源于非洲乍得湖的鈍頂螺旋藻和墨西哥Texcoco湖的極大螺旋藻的光合速率遠(yuǎn)大于來源于內(nèi)蒙古鄂爾多斯沙區(qū)堿湖(察罕淖爾湖)的鈍頂螺旋藻[16]。螺旋藻的光合速率日變化表明,螺旋藻在每日13:00時(shí)光合速率達(dá)到最大,早于或晚于這一時(shí)間點(diǎn)的光合速率都有所下降。螺旋藻的呼吸速率與生長(zhǎng)速度負(fù)相關(guān),且隨溫度的升高而增大。
1.2.2 養(yǎng)殖池 螺旋藻的養(yǎng)殖分為異養(yǎng)培養(yǎng)和自養(yǎng)培養(yǎng),大規(guī)模的養(yǎng)殖都屬于自養(yǎng)培養(yǎng),形式包括開放養(yǎng)殖系統(tǒng)(開放池、跑道池、圓型池)、封閉養(yǎng)殖系統(tǒng)(光生物反應(yīng)器)和復(fù)合系統(tǒng)等。Soni等從空間需求、面積/體積比、蒸發(fā)量、水分損失、CO2損失、溫度、氣候依賴性、過程控制、可清潔性、生物量質(zhì)量、生物量密度、采收效率、采收成本、光利用率、成本最高的工序、污染控制、投資額、產(chǎn)量、水動(dòng)力對(duì)螺旋藻的壓力等指標(biāo)對(duì)不同螺旋藻養(yǎng)殖系統(tǒng)進(jìn)行了比較[2,17]。
開放養(yǎng)殖系統(tǒng)包括天然湖泊、瀕海湖、池塘、人工池塘或者容器等,最常見的是人工開挖的狹長(zhǎng)型大池、圓形池和跑道池。開放養(yǎng)殖系統(tǒng)的建設(shè)和操作比較簡(jiǎn)單,但存在產(chǎn)量相對(duì)較低、光利用率低下、蒸發(fā)損失、CO2逸散損失、占地面積大且容易污染(包括動(dòng)物和其他異養(yǎng)生物)等缺點(diǎn)。
封閉養(yǎng)殖系統(tǒng)的光生反應(yīng)器分為直柱型、盤式、管式、板式等多種類型,光源有自然光源,也有人工光源,便于生物量聚集,污染可以做到最小,反應(yīng)系統(tǒng)的材質(zhì)有玻璃、聚酯塑料等多種,但系統(tǒng)清洗以及大規(guī)模養(yǎng)殖還有待進(jìn)一步的技術(shù)提升。
復(fù)合系統(tǒng)主要是讓光生反應(yīng)器類似于開放池以便降低運(yùn)營(yíng)成本,有2種類型:一種是將開放池覆蓋隔斷外界污染,另一種將光生反應(yīng)器的管道直徑盡可能擴(kuò)大到類似于開放池[18],這樣的復(fù)合系統(tǒng)綜合了開放池和光生反應(yīng)器的優(yōu)點(diǎn),從而在保證最小污染的同時(shí),具有最大產(chǎn)量、最小CO2逸散損失的特點(diǎn),但還需要大量的陸地面積和技術(shù)攻關(guān)。
為了提高螺旋藻的生物采收量,生物膜貼壁培養(yǎng)法成為研究開發(fā)的重點(diǎn)[19]。中國(guó)科學(xué)院青島生物能源與過程研究所劉天中團(tuán)隊(duì)建立的生物膜貼壁培養(yǎng)技術(shù),以CO2為碳源,螺旋藻的產(chǎn)量達(dá)到 38 g/(m2·d),CO2的利用率為75.1%,螺旋藻粉的蛋白質(zhì)含量超過60%,但整個(gè)中試系統(tǒng)的建設(shè)成本達(dá)到200美元/m2,較傳統(tǒng)開放池高出許多。以CO2為碳源進(jìn)行螺旋藻養(yǎng)殖是提升螺旋藻養(yǎng)殖的環(huán)境效應(yīng),同時(shí)也是降低養(yǎng)殖成本的重要途徑,已成為微藻養(yǎng)殖技術(shù)發(fā)展的趨勢(shì),但如何提高CO2的利用率,降低補(bǔ)碳成本需要進(jìn)一步科技攻關(guān)[20]。
1.2.3 溫度 溫度是螺旋藻生長(zhǎng)的重要影響因素之一,螺旋藻可以在低于45 ℃的條件下生長(zhǎng),溫度低于17 ℃和高于38 ℃時(shí),螺旋藻的生長(zhǎng)會(huì)受到抑制,但不會(huì)死亡。螺旋藻的最適生長(zhǎng)溫度是29~35 ℃。溫度對(duì)螺旋藻生長(zhǎng)的影響在蛋白和碳水化合物的組成上顯著,但對(duì)脂肪和γ-亞麻酸的影響不顯著[21]。
1.2.4 光照 光源質(zhì)量、光照度以及光照時(shí)長(zhǎng)是影響藻類生長(zhǎng)的重要因素[10]。在實(shí)際養(yǎng)殖螺旋藻時(shí),推薦30%的陽光通量,但在養(yǎng)殖池水溫需要快速升溫的早晨除外。螺旋藻的生長(zhǎng)僅在有光照的情況下發(fā)生,但螺旋藻需要在沒有光照的間隙合成蛋白質(zhì)和色素,故不推薦24 h/d的長(zhǎng)時(shí)間光照。
Bezerra等將螺旋藻養(yǎng)殖過程中的光照度(光合光子通量密度)從36 μmol/(m2·s)提高到 72 μmol/(m2·s) 時(shí),最大細(xì)胞濃度從5 200 mg/L提高到5 800 mg/L,當(dāng)進(jìn)一步將光照度提高到 108 μmol/(m2·s) 時(shí),最大細(xì)胞濃度的獲得時(shí)間從8 d降到6 d[22]。這說明低光照度更適合新生態(tài)藻絲體的生長(zhǎng),而高光照度能夠縮短螺旋藻的生長(zhǎng)周期[23]。2004年,Danesi等也得到類似的結(jié)論[24],使用尿素作為螺旋藻的氮源,光照度在2 000~5 000 lx 時(shí),通過快速光合作用產(chǎn)生的ATP和NADPH能加速細(xì)胞生長(zhǎng),但當(dāng)細(xì)胞濃度達(dá)到 5 800 mg/L 時(shí),細(xì)胞生長(zhǎng)由于光通量密度的飽和而停止。
1.2.5 pH值 螺旋藻養(yǎng)殖的最適pH值為9.0~11.0,堿性pH值既可以防止其他藻株的污染,又可以影響螺旋藻中色素和蛋白質(zhì)的富集。當(dāng)pH值高于11時(shí),螺旋藻藻絲體會(huì)結(jié)塊、變短,發(fā)生細(xì)胞裂解,胞內(nèi)物流出,養(yǎng)殖池的顏色逐漸變成黃綠色,最終發(fā)生藻體死亡的結(jié)果[2]。鈍頂螺旋藻的色澤、生長(zhǎng)速率隨pH值的變化有顯著差異,在pH值為 8.5~9.5時(shí),螺旋藻的生長(zhǎng)速率隨著pH值的升高而升高,但在pH值為9.5~11.0時(shí),螺旋藻的生長(zhǎng)速率隨著pH值的升高而逐漸降低;在培養(yǎng)8 d時(shí),螺旋藻的細(xì)胞干質(zhì)量隨著pH值的增加而降低[25]。
1.2.6 攪拌混合和通氣量 螺旋藻的規(guī)模化養(yǎng)殖目前均采用液體懸浮法培養(yǎng),養(yǎng)殖過程中對(duì)培養(yǎng)液進(jìn)行周期性攪拌,以便保證營(yíng)養(yǎng)液的均一性及螺旋藻藻絲體接受光照度的一致性。攪拌混合和通氣對(duì)生產(chǎn)高密度的藻絲體和高質(zhì)量的螺旋藻產(chǎn)品非常必要。攪拌混合和通氣(空氣)能夠讓培養(yǎng)池中的螺旋藻藻絲體具有均一的光照量,同時(shí)有助于二氧化碳?xì)怏w的分布及除去螺旋藻的生長(zhǎng)抑制因子——溶解氧。在跑道池中,多采用5~60 cm/s的攪拌混合速度,過低的攪拌混合速度將在跑道池的拐角處產(chǎn)生死角(將跑道池的拐角設(shè)置成弧形可規(guī)避死角的產(chǎn)生),而過高的攪拌混合速度需要更高的能耗,其所產(chǎn)生的剪切力將增加藻絲體的斷裂。在無NaHCO3的Zarrouk培養(yǎng)液中,螺旋藻的最適參數(shù)是光照度低于200 μmol/(m2·s),含0.5%二氧化碳的通氣速度是0.0056 m/s[26]。
不同實(shí)驗(yàn)室規(guī)模養(yǎng)殖下,養(yǎng)殖參數(shù)的變化對(duì)螺旋藻蛋白質(zhì)含量的變化見表2[27]。
1.2.7 蟲害 目前,在螺旋藻的養(yǎng)殖過程中經(jīng)常出現(xiàn)輪蟲(Brachionus Plicatilis)危害,嚴(yán)重時(shí)輪蟲大量吞食螺旋藻而導(dǎo)致絕收,造成災(zāi)害性損失。防治螺旋藻培養(yǎng)液中的輪蟲,主要有物理過濾(250目以上濾網(wǎng))去除輪蟲成蟲法和化學(xué)防治等2種方法。化學(xué)防治是利用漂白粉、硫酸銅、高錳酸鉀等強(qiáng)氧化劑或毒物將螺旋藻和輪蟲一起殺死,然后清洗培養(yǎng)池重新擴(kuò)種培養(yǎng)。物理防治的方法過濾不徹底,部分成蟲、幼蟲和幾乎全部蟲卵隨著濾液返回培養(yǎng)池,需要再次過濾,且隨著過濾次數(shù)的增加,產(chǎn)生危害間隔的天數(shù)越來越少。化學(xué)防治雖然能較長(zhǎng)時(shí)間控制危害,但由于一次性的將螺旋藻也殺死,造成一定的經(jīng)濟(jì)損失,同時(shí)重新擴(kuò)種又浪費(fèi)了時(shí)間和資金,導(dǎo)致生產(chǎn)成本增加。另外,阿維菌素與尿素的交替使用可以降低輪蟲的抗藥性[28-29]。
螺旋藻養(yǎng)殖過程中還可遇見點(diǎn)滴變形蟲、半眉蟲、原生動(dòng)物和水蠅等蟲害。用40目以上濾網(wǎng)可以除去/減少藻泥中水蠅(幼蟲和蛹)的數(shù)量和其他雜質(zhì),降低藻粉中昆蟲碎片的數(shù)量[30]。
2 螺旋藻的采收和干燥
2.1 螺旋藻的采收
理論而言,螺旋藻的采收需選擇在藻絲體中的蛋白質(zhì)達(dá)到最高濃度時(shí)進(jìn)行,但在實(shí)際操作過程中,一般對(duì)含螺旋藻的養(yǎng)殖水體進(jìn)行吸光度測(cè)定,當(dāng)560 nm波長(zhǎng)下的吸光度>1.0時(shí),便著手采收[31],也有選用680 nm波長(zhǎng)下的吸光度>0.8時(shí)采收的報(bào)道[32]。
螺旋藻采收一般經(jīng)歷三大步驟,即螺旋藻藻絲體(藻細(xì)胞)采集分離、螺旋藻聚集物(即藻泥)清洗、螺旋藻干燥。螺旋藻藻絲體(藻細(xì)胞)采集所用的技術(shù)包括過濾法、絮凝沉淀法、離心沉淀法等,清洗工序包括漂洗、離子交換、電滲析、超聲波清洗等,干燥包括自然曬干、冷凍干燥、噴霧干燥、滾筒干燥和炒干等。改進(jìn)螺旋藻藻絲體的采集方法、提高采集效率、降低生產(chǎn)成本仍是業(yè)界努力的方向。
螺旋藻采收時(shí)使用的過濾網(wǎng)或?yàn)V布的網(wǎng)孔密度一般低于50 μm,以便將螺旋藻藻絲體從培養(yǎng)液基質(zhì)中有效分離出來。常用的過濾篩有傾斜篩和震動(dòng)篩2種,傾斜篩的篩網(wǎng)面積為2~4 m2,篩網(wǎng)孔徑為380~500目,能夠過濾10~18 m3/h的螺旋藻培養(yǎng)液[33]。在相同采收效率的前提下,震動(dòng)篩需要的篩網(wǎng)面積約為固定傾斜篩篩網(wǎng)面積的1/3,但震動(dòng)篩并不適用于大規(guī)模采收,震動(dòng)導(dǎo)致的螺旋藻藻絲體變形和斷裂反而降低了螺旋藻的產(chǎn)率。盡管新鮮的螺旋藻能夠被直接消費(fèi),但鮮螺旋藻不宜久存,可食用的保質(zhì)期僅為6 h[2],干燥后的螺旋藻粉可以儲(chǔ)存1年以上。
利用Ca2+的絮凝作用能夠?qū)⒙菪蹇焖傩跄恋恚跄齽┯昧看螅跄弩w的鹽含量大,后續(xù)處理困難。而傳統(tǒng)過濾也存在效率過低,損失嚴(yán)重等缺陷,需要進(jìn)行改進(jìn)。Lai等使用殼聚糖和雞蛋殼作為生物絮凝劑對(duì)螺旋藻進(jìn)行采收時(shí)發(fā)現(xiàn),325目的雞蛋殼粉溶于鹽酸溶液后,在4 g/L、pH值為4的條件下絮凝8 min,最高效率達(dá)到97.2%,而殼聚糖溶于鹽酸后,在50 mg/L、pH值為8的條件下絮凝50 min,最高效率達(dá)到80%[34]。盡管雞蛋殼的得率較高,但從營(yíng)養(yǎng)液的重復(fù)利用方面考慮,殼聚糖絮凝劑更貼近于實(shí)際生產(chǎn)。
2.2 螺旋藻的干燥
Nouri等對(duì)比研究了自然干燥、陰干、微波干燥、冷凍干燥、真空干燥、傳統(tǒng)熱風(fēng)干燥等對(duì)螺旋藻理化成分和抗氧化性的影響[35]。真空干燥有助于螺旋藻粉抗氧化活性和總酚物質(zhì)的保留,噴霧干燥和冷凍干燥有助于保留螺旋藻中的不飽和脂肪酸,而冷凍干燥對(duì)鈉、鉀、鎂、錳、鈣、磷的流失比較顯著,其他干燥方式對(duì)金屬元素的影響不顯著。
使用φ=80 μm孔徑的支撐物有助于螺旋藻的快速干燥(熱風(fēng)對(duì)流干燥),規(guī)格為80 mm×80 mm ×3 mm的螺旋藻藻泥餅的干燥時(shí)間可降低30%,擠壓的螺旋藻藻泥條(φ=3 mm×120 mm)間隔10、20 mm,可降低干燥時(shí)間35%[36]。
企業(yè)總是試圖在干燥工序成本可控的前提下,減少螺旋藻營(yíng)養(yǎng)成分的損失并得到最大純度的產(chǎn)品。由于螺旋藻的細(xì)胞壁特別薄且易碎,自然曬干作為最原始、最傳統(tǒng)的干燥方式曾被廣為使用,但自然曬干必須非常快速,否則葉綠素被破壞,干燥的產(chǎn)品變成藍(lán)色。盡管冷凍干燥被認(rèn)為是最適合螺旋藻干燥的方式,但高昂的成本和復(fù)雜的工序,使其應(yīng)用相對(duì)較低。噴霧干燥是實(shí)際生產(chǎn)中最常用的螺旋藻干燥方式。不同螺旋藻干燥工藝對(duì)螺旋藻營(yíng)養(yǎng)成分的損失程度見表3。
3 螺旋藻的營(yíng)養(yǎng)及安全
3.1 螺旋藻的營(yíng)養(yǎng)
螺旋藻的營(yíng)養(yǎng)價(jià)值很高,蛋白質(zhì)含量占干質(zhì)量的60%~70%,且富含植物中不常見的維生素B12和鐵元素, 其中維生素B12含量是肝臟中維生素B12含量的2~4倍,鐵元素濃度是常見植物鐵元素的 8~12倍。螺旋藻還含有抗腫瘤作用的藻藍(lán)素,被宣稱為未來的最佳食品[45],2003年,聯(lián)合國(guó)成立了一個(gè)“聯(lián)合國(guó)利用微藻類螺旋藻抗擊營(yíng)養(yǎng)不良政府間機(jī)構(gòu)”(the Intergovernmental Institution for the Use of Micro-algae Spirulina Against Malnutrition,簡(jiǎn)稱IIMSAM)以便在發(fā)展中國(guó)家推動(dòng)開發(fā)螺旋藻用于消除饑餓和營(yíng)養(yǎng)不良[2]。
不同企業(yè)的螺旋藻產(chǎn)品各功能成分含量并不一致,這種差異不僅與藻種相關(guān),也因溫度、pH值、培養(yǎng)基、光照等養(yǎng)殖條件的不一致而存在差異。以蛋白質(zhì)為例,螺旋藻的蛋白質(zhì)含量在17%~73%(干質(zhì)量)之間變動(dòng)[30],部分市售螺旋藻產(chǎn)品的氨基酸組成如表4所示[33,46-48]。
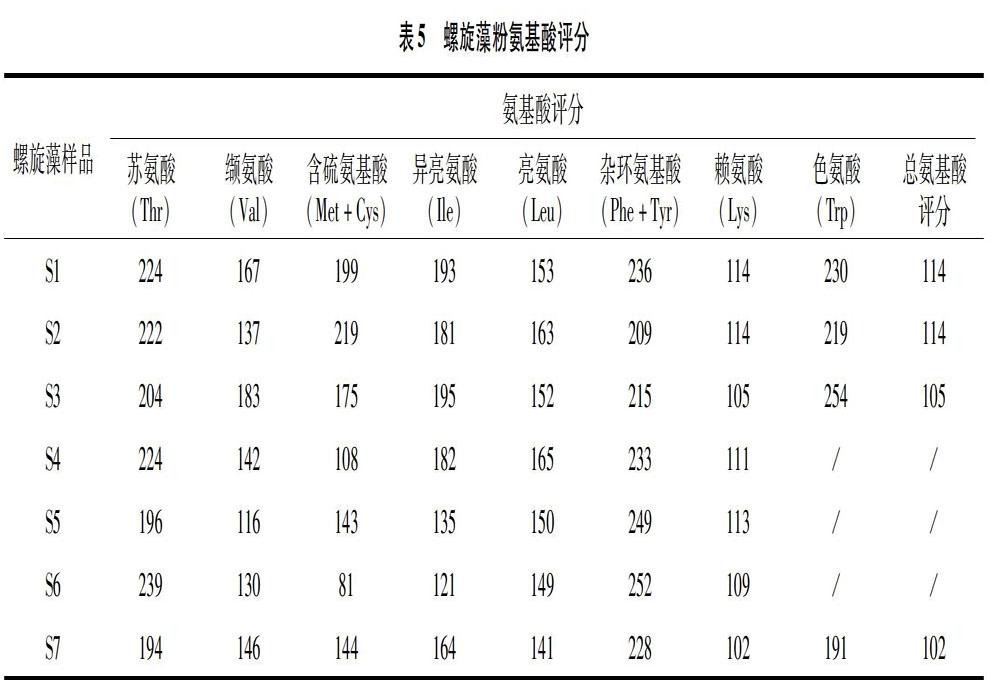
氨基酸評(píng)分法是蛋白質(zhì)質(zhì)量評(píng)價(jià)中廣泛采用的方法之一。基于成人的必需氨基酸需求[50],不同螺旋藻樣品的必需氨基酸評(píng)分見表5。由表5可知,螺旋藻蛋白與谷物蛋白類似,限制性氨基酸均為賴氨酸,但不同產(chǎn)地、品牌螺旋藻產(chǎn)品的氨基酸評(píng)分均大于100,所以螺旋藻是一個(gè)優(yōu)質(zhì)蛋白,滿足人體所有必需氨基酸的需求, 因此螺旋藻的消化率成為螺旋藻氨基酸評(píng)分的第一限制因素[50],從而螺旋藻的消化率修正氨基酸評(píng)分等于螺旋藻的消化率。
螺旋藻的細(xì)胞壁類似于革蘭氏陰性菌的肽聚糖細(xì)胞壁,非常易于消化。據(jù)報(bào)道,螺旋藻的平均體外消化吸收率為61%[51],其蛋白質(zhì)的消化吸收率為70%~85%[52],螺旋藻細(xì)胞壁多糖的生物利用度達(dá)到86%[53]。但不同研究者采用的消化吸收測(cè)試方法不一致,數(shù)據(jù)間的可比較性相對(duì)較差。不可忽視的是,加工工藝可以改變螺旋藻的體外消化吸收率[54],滾筒干燥與自然曬干的螺旋藻的體外消化吸收率分別為84%、76%。
3.2 螺旋藻的安全性
同大多數(shù)微藻一樣,螺旋藻可以吸附培養(yǎng)液中的農(nóng)藥殘留滴滴涕(DDT)[55],重金屬(Cr3+、Cd2+、Cu2+、Zn2+、As、Hg等)[56-59],石油烷烴[60]和雌激素(17α-乙炔基雌二醇、17β-雌二醇)[61]等,因而螺旋藻也被認(rèn)為是用于污水處理的熱點(diǎn)材料[62]。在食用螺旋藻生產(chǎn)中,其不安全因素主要集中于養(yǎng)殖過程的重金屬(鉛、砷等)、生物毒素等的污染影響,還包括干燥加工過程的熱源污染(如多環(huán)芳烴), 硝酸鹽/亞硝酸鹽、亞硫酸鹽殘留和輻照劑量殘留等污染。
3.2.1 重金屬 目前我國(guó)南方企業(yè)生產(chǎn)的螺旋藻粉普遍存在鉛含量超標(biāo)的問題,而北方(主要是內(nèi)蒙古自治區(qū))企業(yè)生產(chǎn)的螺旋藻粉存在砷含量偏高的現(xiàn)象。在2012年,曾因?yàn)槌毯:廴荆ㄣU超標(biāo))媒體對(duì)我國(guó)螺旋藻養(yǎng)殖業(yè)、螺旋藻產(chǎn)品進(jìn)行了長(zhǎng)篇累牘地報(bào)道,對(duì)螺旋藻品質(zhì)產(chǎn)生了懷疑。螺旋藻產(chǎn)品中的重金屬組成及含量與養(yǎng)殖水體緊密相關(guān),也與養(yǎng)殖過程中培養(yǎng)基(碳酸鈉或碳酸氫鈉等原料)中的重金屬殘留有關(guān)。GB 2762—2017《食品安全國(guó)家標(biāo)準(zhǔn) 食品中污染物限量》中規(guī)定螺旋藻及其制品中的鉛含量上限為2.0 mg/kg(干質(zhì)量計(jì))。歐盟對(duì)膳食補(bǔ)充劑中的鉛殘留設(shè)定為3.0 mg/kg,但有報(bào)道說螺旋藻中的鉛殘留在0.1~15.0 mg/kg之間變化[63-64]。趙楠發(fā)現(xiàn),國(guó)內(nèi)螺旋藻原粉中的鉛殘留為0.03~1.71 mg/kg,但筆者團(tuán)隊(duì)對(duì)部分市售螺旋藻粉樣品的檢測(cè)發(fā)現(xiàn),有個(gè)別樣品的鉛含量超過2.0 mg/kg。鉛殘留仍是螺旋藻養(yǎng)殖過程中亟待解決的問題之一[65]。
砷是一種準(zhǔn)金屬物質(zhì),以各種形態(tài)分布于土壤、石頭、河流等環(huán)境中,在組成地殼的92種元素中,含量排名為第20位。天然砷礦在自然風(fēng)化及雨水沖刷等活動(dòng)過程中進(jìn)入水體,常以亞砷酸鹽和砷酸鹽的形態(tài)存在。砷可分為有機(jī)砷與無機(jī)砷2種,無機(jī)砷又分為砷元素、三價(jià)砷和五價(jià)砷3種形式,其中三價(jià)砷的毒性最高,而有機(jī)砷對(duì)人體的毒性較小。水產(chǎn)品中常見的砷酸甜菜堿和砷酸膽堿等有機(jī)砷化合物對(duì)人體沒有毒性,且容易排出體外。螺旋藻具有富集砷的特性,當(dāng)螺旋藻養(yǎng)殖水體中的砷濃度達(dá)到0.04 mg/L時(shí),乍得湖鈍頂螺旋藻藻粉中的砷含量超過1.0 mg/kg[66]。我國(guó)螺旋藻原粉中的砷殘留為0.01~0.41 mg/kg[65],但筆者團(tuán)隊(duì)對(duì)部分市售螺旋藻藻粉樣品的檢測(cè)發(fā)現(xiàn),很多樣品的砷含量超過固體營(yíng)養(yǎng)補(bǔ)充食品的砷殘留限量標(biāo)準(zhǔn)(0.5 mg/kg,GB 2762—2017《食品安全國(guó)家標(biāo)準(zhǔn) 食品中污染物限量》),但無機(jī)砷均小于0.02 mg/kg。建議我國(guó)GB/T 16919—1997《食用螺旋藻粉》和NY/T 1709—2011《綠色食品 藻類及其制品》在后續(xù)修訂時(shí),將有關(guān)砷的指標(biāo)明確為無機(jī)砷。
鉛具有神經(jīng)毒性,鉛暴露會(huì)損傷兒童發(fā)育期的學(xué)習(xí)記憶。鉛鎘聯(lián)合暴露的神經(jīng)毒性較鉛鎘單獨(dú)暴露的神經(jīng)毒性強(qiáng)[67],歐盟對(duì)膳食補(bǔ)充劑中的鎘殘留限量設(shè)定為1.0 mg/kg。Muys等曾發(fā)現(xiàn),螺旋藻中的鎘殘留為0.01~0.17 mg/kg,我國(guó)螺旋藻粉的鎘殘留為0.003~0.123 mg/kg,所有報(bào)道數(shù)據(jù)均在鎘殘留方面比較理想[27]。歐盟對(duì)膳食補(bǔ)充劑中的汞殘留設(shè)定為0.1 mg/kg;未對(duì)鎳殘留作出限定,Muys等發(fā)現(xiàn),螺旋藻樣品中的汞殘留為0.02~0.11 mg/kg,鎳殘留為1.1~3.4 mg/kg[27]。
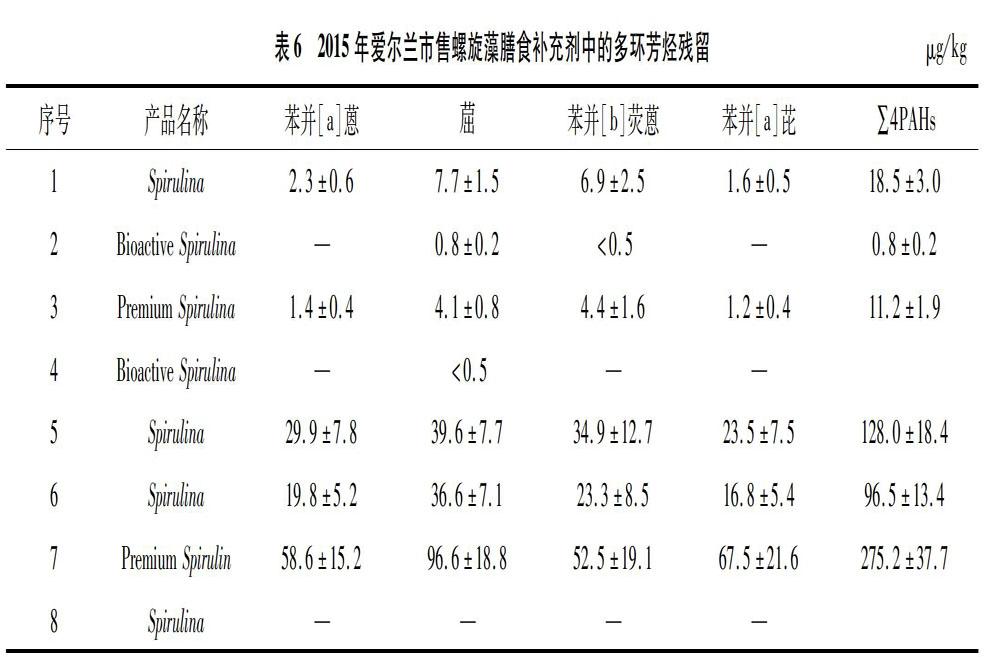
3.2.2 多環(huán)芳烴 多環(huán)芳烴來源于天然和人類生產(chǎn)活動(dòng),最主要來源是有機(jī)物的不完全燃燒。螺旋藻在干燥工序方面,根據(jù)熱源(煤、有機(jī)質(zhì)、天然氣)、加熱方式(直接接觸、非直接接觸)和加熱溫度的不同,可能存在多環(huán)芳烴的污染。2015年10月27日,歐盟(EU)2015/1933對(duì)(EU)No 1881/2006食品中多環(huán)芳烴的限值進(jìn)行增補(bǔ)。歐盟對(duì)含有螺旋藻及其制品的膳食補(bǔ)充劑中多環(huán)芳烴的殘留標(biāo)準(zhǔn)是苯并[a]芘≤10 μg/kg;苯并[a]蒽(BaA)、(CHR)、苯并[b]熒蒽(BbF)和苯并[a]芘(BaP)等4種多環(huán)芳烴之和為≤50 μg/kg[68]。我國(guó)暫時(shí)尚未對(duì)螺旋藻及其制品中的多環(huán)芳烴殘留進(jìn)行規(guī)定。Zelinkova等曾對(duì)愛爾蘭市售螺旋藻膳食補(bǔ)充劑的多環(huán)芳烴殘留進(jìn)行檢測(cè)[69],結(jié)果見表6。總體而言,當(dāng)苯并[a]芘超標(biāo)時(shí),4種多環(huán)芳烴之和也超標(biāo)。
3.2.3 其他安全因素 Muys等檢測(cè)螺旋藻樣品中的硝酸鹽濃度在8~368 mg/kg之間,盡管這些數(shù)據(jù)對(duì)原料總氮的貢獻(xiàn)有限,過高的硝酸鹽殘留可能是由于養(yǎng)殖過程中使用硝酸鹽作為氮源引起的[27];在螺旋藻后續(xù)加工清洗充分的前提下,亞硝酸鹽的高低反映了加工過程中原料腐敗變質(zhì)的程度。果蔬汁標(biāo)準(zhǔn)中,亞硝酸鹽的殘留控制標(biāo)準(zhǔn)是4 mg/kg,而硝酸鹽的日允許攝入量(allowable daily intake,簡(jiǎn)稱ADI)是3.7 mg/kg體質(zhì)量。
食品行業(yè)所說的亞硫酸鹽包括二氧化硫、亞硫酸氫鈉、亞硫酸鈉、低亞硫酸鈉、焦亞硫酸鈉、焦亞硫酸鉀等在內(nèi)的一系列物質(zhì)。由于食物原料的腐敗發(fā)酵能夠產(chǎn)生亞硫酸鹽,且有報(bào)道說亞硫酸鹽具有生殖毒性[70]且能引發(fā)哮喘的過敏反應(yīng)[71],所以部分國(guó)家對(duì)螺旋藻中的亞硫酸鹽進(jìn)行嚴(yán)格控制以便溯源螺旋藻加工過程中螺旋藻原料的腐敗變質(zhì)情況。歐盟和美國(guó)均要求食品中二氧化硫和亞硫酸鹽(以SO2計(jì))大于10 mg/kg時(shí)需要標(biāo)注。2019年8月6日,德國(guó)對(duì)我國(guó)臺(tái)灣一批次的食品補(bǔ)充劑因含未申報(bào)的過敏原——亞硫酸鹽(22 mg/kg)而通報(bào)不合格。
螺旋藻中報(bào)道較多的藻毒素主要為微囊藻毒素(mycrocystins,簡(jiǎn)稱MC),MC作為藍(lán)藻毒素的一種,是目前暴露頻率最高、污染范圍最廣、危害最為嚴(yán)重的肝毒性藻毒素[72],具有致畸、致癌、致突變的“三致”作用,也是目前發(fā)現(xiàn)的最強(qiáng)肝臟腫瘤促進(jìn)劑。MC具有約100種結(jié)構(gòu)變體,其中被列為2B類致癌物的微囊藻毒素LR(MC-LR)的毒性最大[73]。2002年,徐海濱等對(duì)市售的19種71份螺旋藻產(chǎn)品進(jìn)行微囊藻毒素的檢測(cè)時(shí)發(fā)現(xiàn),平均污染水平為317.2 ng/g,其中錠片和膠囊中微囊藻毒素污染的平均水平分別為142.7、222.6 ng/g[74]。而在2001年Draisci等報(bào)道了從羅馬供應(yīng)商處收集的5個(gè)不同品牌的螺旋藻片和膠囊樣品,有3個(gè)樣品不僅含有高達(dá)10 μg/g的二氫同型魚腥藻毒素-a(dyhydrohomoanatoxin-a)——一種神經(jīng)毒素,其中2個(gè)還含有環(huán)氧魚腥藻毒素-a異構(gòu)體(含量分別為18、19 μg/g)[75]。
2018年11月28日,日本厚生勞動(dòng)省發(fā)布藥生食輸發(fā)1128第3號(hào)文:修訂輻射照射食品檢測(cè)方法附錄Ⅱ、Ⅲ、Ⅳ-ⅶ,分別涉及畜牧及漁業(yè)產(chǎn)品、農(nóng)產(chǎn)品等,同時(shí)增加附錄“Ⅳ-ⅶ 放射線照射”,追加對(duì)螺旋藻的輻照檢查,檢查件數(shù)為10件[76]。
3.3 螺旋藻標(biāo)準(zhǔn)
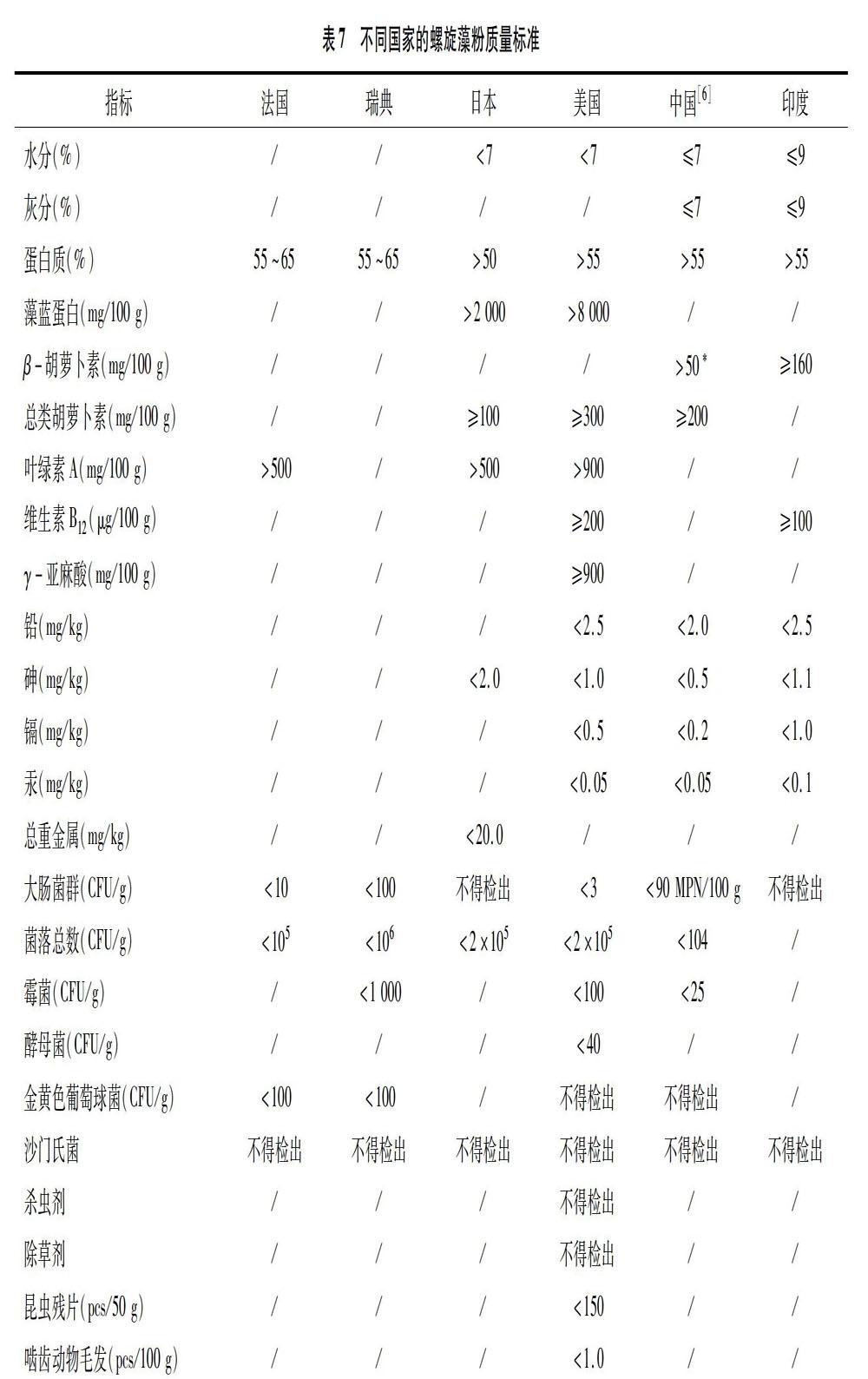
螺旋藻粉在不同國(guó)家和地區(qū)的質(zhì)量標(biāo)準(zhǔn)見表7[65,77]。
由表7可知,螺旋藻的質(zhì)量標(biāo)準(zhǔn)更多地關(guān)注了產(chǎn)品本身的質(zhì)量和微生物安全,對(duì)可能存在的生物污染和化學(xué)污染尚未列為控制標(biāo)準(zhǔn)。但基于90%以上的螺旋藻均是作為膳食補(bǔ)充劑為人類消費(fèi),需要對(duì)可能存在的影響螺旋藻產(chǎn)品安全性的因素,特別是養(yǎng)殖用水可能存在的污染指標(biāo)進(jìn)行監(jiān)控。
4 結(jié)論與討論
螺旋藻是一種優(yōu)質(zhì)的微生物蛋白源,其產(chǎn)業(yè)鏈由養(yǎng)殖、初加工(藻粉)、深加工(藻片、螺旋藻提取物和其他成品)、成品應(yīng)用4個(gè)環(huán)節(jié)組成。本文對(duì)螺旋藻產(chǎn)業(yè)鏈上游的養(yǎng)殖、采收、初加工等環(huán)節(jié)進(jìn)行了總結(jié)。螺旋藻養(yǎng)殖和加工過程對(duì)生產(chǎn)要求極其嚴(yán)格,螺旋藻的養(yǎng)殖受外界環(huán)境影響較大,適宜養(yǎng)殖的水質(zhì)必須高堿、高溫、高光照,養(yǎng)殖過程需防止其他藻類或者微生物的污染。螺旋藻的采收和粗加工需要經(jīng)過抽水、沖洗、過濾、干燥等工序,干燥的及時(shí)與否將嚴(yán)重影響螺旋藻粉的質(zhì)量。養(yǎng)殖用水的污染使我國(guó)螺旋藻產(chǎn)業(yè)鏈上游面臨挑戰(zhàn),產(chǎn)品質(zhì)量標(biāo)準(zhǔn)(重金屬等)需要進(jìn)一步提升。業(yè)界需要從水源、生產(chǎn)原料、藻種培養(yǎng)、規(guī)模化養(yǎng)殖、采收、干燥、加工、包裝以及養(yǎng)殖廢水處理等方面制定一個(gè)操作或加工指南。螺旋藻的生產(chǎn)成本仍滿足不了市場(chǎng)的需求,還需要通過技術(shù)創(chuàng)新和規(guī)模化養(yǎng)殖進(jìn)行破解;減少生產(chǎn)加工過程中的營(yíng)養(yǎng)成分損失或者結(jié)合快速發(fā)展的物聯(lián)網(wǎng)產(chǎn)業(yè),實(shí)現(xiàn)生鮮宅配是螺旋藻產(chǎn)業(yè)鏈發(fā)展延伸的另一方向。
參考文獻(xiàn):
[1]王志忠. 鄂爾多斯高原堿湖鈍頂螺旋藻生產(chǎn)加工關(guān)鍵因子研究[D]. 呼和浩特:內(nèi)蒙古農(nóng)業(yè)大學(xué),2015.
[2]Soni R A,Sudhakar K,Rana R S. Spirulina-from growth to nutritional product:a review[J]. Trends in Food Science and Technology,2017,69:157-171.
[3]Henrikson R. Earth food Spirulina[M]. 6th ed. Hawaii:Ronore Enterprises,Inc.,2009:18.
[4]Chen J,Wang Y,Benemann J R,et al. Microalgal industry in China:challenges and prospects[J]. Journal of Applied Phycology,2016,28(2):715-725.
[5]張學(xué)成,薛命雄. 我國(guó)螺旋藻產(chǎn)業(yè)的現(xiàn)狀和發(fā)展?jié)摿J]. 生物產(chǎn)業(yè)技術(shù),2012(2):47-53.
[6]衛(wèi)生部. 中華人民共和國(guó)衛(wèi)生部公告2004年第17號(hào)[J]. 中國(guó)食品衛(wèi)生雜志,2004,16(6):570.
[7]國(guó)家技術(shù)監(jiān)督局.食用螺旋藻粉:GB/T 16919—1997[S]. 北京:中國(guó)標(biāo)準(zhǔn)出版社,1997.
[8]王福雙,董世瑞,王素英. 螺旋藻形態(tài)建成研究進(jìn)展[J]. 生物技術(shù)通報(bào),2016,32(8):28-33.
[9]喬 辰,栗淑媛. 鄂爾多斯高原堿湖螺旋藻[M]. 北京:科學(xué)出版社, 2013(3):332-337.
[10]Olguín E J,Galicia S,Mercado G,et al. Annual productivity of Spirulina(Arthrospira) and nutrient removal in a pig wastewater recycling process under tropical conditions[J]. Journal of Applied Phycology,2003,15(2/3):249-257.
[11]Bilanovic D,Andargatchew A,Kroeger T,et al. Freshwater and marine microalgae sequestering of CO2 at different C and N concentrations-response surface methodology analysis[J]. Energy Conversion and Management,2009,50(2):262-267.
[12]Ceullar-Bermudez S P,Garcia-Perez J S,Rittmann B E,et al. Photosynthetic bioenergy utilizing CO2:an approach on flue gases utilization for third generation biofuels[J]. Journal of Cleaner Production,2015,98:53-65.
[13]Sydney E B,Sturm W,de Carvalho J C,et al. Potential carbon dioxide fixation by industrially important microalgae[J]. Bioresource Technology,2010,101(15):5892-5896.
[14]da Rosa G M,Moraes L,Cardias B B,et al. Chemical absorption and CO2 biofixation via the cultivation of Spirulina in semicontinuous mode with nutrient recycle[J]. Bioresource Technology,2015,192:321-327.
[15]王兆印,李一鋒,張 旭,等. 有機(jī)胺對(duì)螺旋藻生長(zhǎng)及固碳效果的影響[J]. 高校化學(xué)工程學(xué)報(bào),2017,31(2):377-386.
[16]劉 華. 螺旋藻光合生理的比較研究[D]. 呼和浩特:內(nèi)蒙古農(nóng)業(yè)大學(xué), 2002.
[17]Pires J C M,Alvim-Ferraz M C M,Martins F G,et al. Carbon dioxide capture from flue gases using microalgae:engineering aspects and biorefinery concept[J]. Renewable and Sustainable Energy Reviews,2012,16(5):3043-3053.
[18]Zittelli G C,Biondi N,Rodolfi L,et al. Photobioreactors for mass production of microalgae[M]//Handbook of microalgal culture:applied phycology and biotechnology. Oxford:Blackwell Publishing,2013:225-266.
[19]張?zhí)m蘭. 螺旋藻(Spirulina platensis)和紫球藻(Porphyridium cruentum)貼壁培養(yǎng)與工藝條件優(yōu)化[D]. 青島:中國(guó)海洋大學(xué),2015.
[20]Wang J F,Cheng W T,Liu W,et al. Field study on attached cultivation of Arthrospira(Spirulina) with carbon dioxide as carbon source[J]. Bioresource Technology,2019,283:270-276.
[21]de Oliveira M A C L,Monteiro M P C,Robbs P G,et al. Growth and chemical composition of Spirulina maxima and Spirulina platensis biomass at different temperatures[J]. Aquaculture International,1999,7(4):261-275.
[22]Bezerra R P,Montoya E Y O,Sato S,et al. Effects of light intensity and dilution rate on the semicontinuous cultivation of Arthrospira(Spirulina) platensis. akinetic Monod-type approach[J]. Bioresource Technology,2011,102(3):3215-3219.
[23]尤 珊,鄭必勝,郭祀遠(yuǎn). 光照對(duì)螺旋藻形態(tài)及胞外多糖的影響和機(jī)理[J]. 海湖鹽與化工,2003,33(1):23-26.
[24]Danesi E D G,Rangel-Yagui C O,Carvalho J C M,et al. Effect of reducing the light intensity on the growth and production of chlorophyll by Spirulina platensis[J]. Biomass and Bioenergy,2004,26(4):329-335.
[25]馬成浩,于麗娟,彭奇均. pH值對(duì)鈍頂螺旋藻生長(zhǎng)的影響[J]. 中國(guó)食品添加劑,2004(4):69-71,68.
[26]Zhang L L,Chen L,Wang J F,et al. Attached cultivation for improving the biomass productivity of Spirulina platensis[J]. Bioresource Technology,2015,181:136-142.
[27]Muys M,Sui Y,Schwaiger B,et al. High variability in nutritional value and safety of commercially available Chlorella and Spirulina biomass indicates the need for smart production strategies[J]. Bioresource Technology,2019,275:247-257.
[28]張克勤,陳玉梅. 螺旋藻(Spirulina)培養(yǎng)液中輪蟲的防治方法[J]. 水產(chǎn)科學(xué)情報(bào),2008,35(1):18-20.
[29]趙素芬,黃益叁,官武林. 藥物殺除極大螺旋藻培養(yǎng)液中輪蟲的初步研究[J]. 福建水產(chǎn),2007,31(5):1-3,16.
[30]馮偉民,汪 廷,方光如,等. 螺旋藻養(yǎng)殖中害蟲防治[J]. 植物保護(hù),1999,25(6):48-49.
[31]薛祥武. 螺旋藻高產(chǎn)養(yǎng)殖技術(shù)[J]. 福建水產(chǎn),2004(4):59-60.
[32]Güroy B,Karadal O,Manto gˇlu S,et al. Effect of different drying methods on C-phycocyanin content of Spirulina platensis powder[J]. Ege Journal of Fisheries and Aquatic Sciences,2017,34(2):129-132.
[33]楊衛(wèi)杰. 螺旋藻腸內(nèi)營(yíng)養(yǎng)制劑干預(yù)Ⅱ型糖尿病實(shí)驗(yàn)動(dòng)物代謝特性的研究[D]. 上海:上海海洋大學(xué),2018.
[34]Lai Y H,Azmi F H M,F(xiàn)atehah N A,et al. Efficiency of chitosan and eggshell on harvesting of Spirulina sp. in a bioflocculation process[J]. Malaysian Journal of Microbiology,2019,15(3):188-194.
[35]Nouri E,Abbasi H. Effect of different processing methods on phytochemical compounds and antioxidant activity of Spirulina platensis[J]. Applied Food Biotechnology,2018,5(4):221-232.
[36]Ghnimi T,Hassini L,Bagane M. Intensification of the convective drying process of Arthrospira(Spirulina) platensis by capillary draining:effect of the draining support[J]. Journal of Applied Phycology,2019,31:2921-2931.
[37]Desmorieux H,Hernandez F. Biochemical and physical criteria of Spirulina after different drying processes[C]// Proceedings of the 14th International Drying Symposium(IDS 2004),Sào Paulo,August 22-25,2004:900-907.
[38]Larrosa A P Q,Comitre A A,Vaz L B,et al. Influence of air temperature on physical characteristics and bioactive compounds in vacuum drying of Arthrospira Spirulina[J]. Journal of Food Process Engineering,2017,40:e12359.
[39]Papadaki S,Kyriakopoulou K,Stramarkou M,et al. Environmental assessment of industrially applied drying technologies for the treatment of Spirulina platensis[J]. IOSR Journal of Environmental Science,Toxicology and Food Technology,2017,11:41-46.
[40]Oliveira E G,Duarte J H,Moraes K,et al. Optimisation of Spirulina platensis convective drying:evaluation of phycocyanin loss and lipid oxidation[J]. International Journal of Food Science & Technology,2010,45(8):1572-1578.
[41]Oliveira E G,Rosa G S,Moraes M A,et al. Phycocyanin content of Spirulina platensis dried in spouted bed and thin layer[J]. Journal of Food Process Engineering,2008,31(1):34-50.
[42]Sarada R,Pillai M G,Ravishankar G A. Phycocyanin from Spirulina sp.:influence of processing of biomass on phycocyanin yield,analysis of efficacy of extraction methods and stability studies on phycocyanin[J]. Process Biochemistry,1999,34(8):795-801.
[43]Agustini T W,Suzery M,Sutrisnanto D,et al. Comparative study of bioactive substances extracted from fresh and dried Spirulina sp.[J]. Procedia Environmental Sciences,2015,23:282-289.
[44]Seshadri C V,Uuesh B V,Manoharan R. Beta-carotene studies in Spirulina[J]. Bioresource Technology,1991,38(2/3):111-113.
[45]Pulz M O,Gross W. Valuable products from biotechnology of microalgae[J]. Applied Microbiology Biotechnology,2004,65(6):635-648.
[46]包國(guó)良,王 茵. 螺旋藻中氨基酸含量水平測(cè)定及其營(yíng)養(yǎng)保健價(jià)值[J]. 中國(guó)衛(wèi)生檢驗(yàn)雜志,2012,22(7):1571-1572,1575.
[47]王大志,朱友芳,李少菁,等. 七種微藻蛋白質(zhì)含量和氨基酸組成的比較[J]. 臺(tái)灣海峽,1999,18(3):297-302.
[48]肖 涵,申 亮,繆德仁,等. 滇產(chǎn)螺旋藻片營(yíng)養(yǎng)組成評(píng)估[J]. 中國(guó)衛(wèi)生檢驗(yàn)雜志, 2014,24(5):664-667.
[49]Bashir S,Sharif M K,Butt M S,et al. Functional properties and amino acid profile of Spirulina platensis protein isolates[J]. Pakistan Journal of Scientific and Industrial Research Series B:Biological Sciences,2016,59(1):12-19.
[50]WHO Technical Report Series 935,Protein and amino acid requirements in human nutrition:report of a joint WHO/FAO/UNU expert consultation[R]. Geneva:World Health Organization Press,2007:113.
[51]Tibbetts S M,Milley J E,Lall S P. Chemical composition and nutritional properties of freshwater and marine microalgal biomass cultured in photobioreactors[J]. Journal of Applied Phycology,2015,27(3):1109-1119.
[52]Devi M A,Subbulakshmí G,Devi K M,et al. Studies on the proteins of mass-cultivated,blue-green-alga(Spirulina platensis)[J]. Journal of Agricultural and Food Chemistry,1981,29(3):522-525.
[53]Sjors V I,Alessandro F. Algae based biofuels,applications and coproducts[C]// Environment and natural resources management working paper. Environment climate change. Bioenergy monitoring and assessment. 2010.
[54]Becker E W. Micro-algae as a source of protein[J]. Biotechnology Advances,2007,25(2):207-210.
[55]Kurashvili M,Varazi T,Khatisashvili G,et al. Blue-green alga Spirulina as a tool against water pollution by 1,1′-(2,2,2-trichloroethane-1,1-diyl)bis(4-chlorobenzene)(DDT)[J]. Annals of Agrarian Science,2018,16(4):405-409.
[56]Rangsayatorn N,Upatham E S,Kruatrachue M,et al. Phytoremediation potential of Spirulina(Arthrospira) platensis:biosorption and toxicity studies of cadmium[J]. Environmental Pollution,2002,119(1):45-53.
[57]Chojnacka K,Chojnacki A,Górecka H. Biosorption of Cr3+,Cd2+ and Cu2+ ions by blue-green algae Spirulina sp.:kinetics,equilibrium and the mechanism of the process[J]. Chemosphere,2005,59:75-84.
[58]Ahmad A,Ghufran R,Wahid Z A. Cd,As,Cu,and Zn transfer through dry to rehydrated biomass of Spirulina platensis from wastewater[J]. Polish Journal of Environmental Studies,2010,19:887-893.
[59]Zinicovscaia I,Cepoi L,Chiriac T,et al. Application of Arthrospira(Spirulina) platensis biomass for silver removal from aqueous solutions[J]. International Journal of Phytoremediation,2017,19:1053-1058.
[60]Jacques N R,Mcmartin D W. Evaluation of algal phytoremediation of light extractable petroleum hydrocarbons in subarctic climates[J]. Remediation,2009,20(1):119-132.
[61]Shi W,Wang L,Rousseau D P L,et al. Removal of estrone,17α-ethinylestradiol,and 17β-estradiol in algae and duckweed-based wastewater treatment systems[J]. Environmental Science and Pollution Research,2010,17(4):824-833.
[62]Phang S M,Chu W L,Rabiei R. Phycoremediation[M]Netherlands:The Algae World,Springer,2015:357-389.
[63]Al-Dhabi N A. Heavy metal analysis in commercial Spirulina products for human consumption[J]. Saudi Journal of Biological Sciences,2013,20(4):383-389.
[64]Al-Homaidan A A. Heavy metal levels in Saudi Arabian Spirulina[J]. Pakistan Journal of Biological Sciences,2006,9(14):2693-2695.
[65]趙 楠. 螺旋藻原粉的質(zhì)量分析研究[D]. 曲阜:曲阜師范大學(xué),2013:15-23.
[66]王志忠,劉果厚,鞏東輝,等. 不同來源鈍頂螺旋藻砷富集特性[J]. 科技導(dǎo)報(bào),2014(32):37-40.
[67]趙 靜. 鉛鎘聯(lián)合暴露導(dǎo)致的神經(jīng)毒性及HDAC2在其中的調(diào)控作用[D]. 合肥:合肥工業(yè)大學(xué),2019:41-44.
[68]Wenzl T,Zelinkova Z. Polycyclic aromatic hydrocarbons in food and feed[M]. Encyclopedia of Food Chemistry,2019:455-469.
[69]Zelinkova Z,Wenzl T. EU marker polycyclic aromatic hydrocarbons in food supplements:analytical approach and occurrence[J]. Food Additives and Contaminants:Part A,2015,32(11):1914-1926.
[70]Chemicals known to the state to cause cancer of reproductive toxicity;California environmental protection agency:Sacramento,CA 1012. http://www.Oehha.ca.gov/prop65/prop65_list/Newlist.html.
[71]Vally H,de Klerk N,Thompson P J. Alcoholic drinks:important triggers for asthma[J]. Journal of Allergy Clinical Immunology,2000,105(3):462-467.
[72]陳 露,馬 良,譚紅霞,等. 食物中藻類毒素污染及暴露風(fēng)險(xiǎn)研究進(jìn)展[J]. 食品與發(fā)酵工業(yè),2019,45(12):272-278.
[73]何 丹,劉 媛,李先保,等. 微囊藻毒素LR免疫原及包被抗原的合成與鑒定[J]. 江蘇農(nóng)業(yè)科學(xué),2019,47(9):226-230.
[74]徐海濱,陳 艷,李 芳,等. 螺旋藻類保健食品生產(chǎn)原料及產(chǎn)品中微囊藻毒素污染現(xiàn)狀調(diào)查[J]. 衛(wèi)生研究,2003,32(4):339-343.
[75]Draisci R,F(xiàn)erretti E,Palleschi L,et al. Identification of anatoxins in blue-green algae food supplements using liquid chromatography-tandem mass spectrometry[J]. Food Additives and Contaminants,2001,18(6):525-531.
[76]日本醫(yī)藥生活衛(wèi)生局食品監(jiān)視安全科. 關(guān)于“平成30年進(jìn)口食品監(jiān)測(cè)計(jì)劃”的實(shí)施(藥生食發(fā)1128第3號(hào))[EB/OL].(2018-11-28)[2019-12-13].https://www.mhlw.go.jp/content/11130500/000415019.pdf.
[77]Ma Z L,Ahmed F,Yuan B,et al. Fresh living Arthrospira as dietary supplements:current status and challenges[J]. Trends in Food Science and Technology,2019,88:439-444.李夢(mèng)桐,王 楠,瑪依拉·吐爾地別克,等. 羊肚菌栽培及富硒控制技術(shù)研究進(jìn)展[J]. 江蘇農(nóng)業(yè)科學(xué),2021,49(6):20-27.

