H 型高血壓伴急性腦梗死患者血壓晝夜節律性與 LP-PLA2、RDW、UA 的相關性分析
陳妮萍,郝潔
H型高血壓是指伴血同型半胱氨酸(Hcy)升高(Hcy≥10 mol/L)的高血壓,過高的Hcy 水平可加重血管內皮細胞及動脈管壁的受損程度,增加血小板黏附性,造成脂質出現過氧化反應,加快平滑肌細胞死亡,形成粥樣硬化斑塊,進一步增加腦梗死的發生風險[1]。H 型高血壓伴急性腦梗死常伴有血壓晝夜節律異常現象,而血壓晝夜節律紊亂是誘發腎臟損傷、左室肥厚等器官受損的主要危險因素。已有研究證實,高血壓患者血壓晝夜節律與血管內皮功能、炎癥因子、動脈硬化等密切相關[2]。本研究選擇杓型組、非杓型組H 型高血壓伴急性腦梗死患者及健康者,分析人血漿脂蛋白磷脂酶A2(LP-PLA2)、紅細胞分布寬度(RDW)、血尿酸(UA)與血壓晝夜節律性的相關性,報道如下。
1 資料與方法
1.1 一般資料 選擇 2018 年 3 月至2020 年 6 月于寧波大學附屬人民醫院醫共體白鶴分院就診的H型高血壓伴急性腦梗死患者98 例,按照夜間血壓下降率分為杓型組和非杓型組。杓型組 52例,其中男 32 例,女 20 例;年齡 49 ~ 73歲,平均(62.6±5.1)歲;體質量指數(22.98±2.16)kg/m2;高血壓病程(13.25±3.91)年;腦梗死部位:基底節區30 例,小腦及腦干13 例,外側腦葉9 例。非杓型組 46 例,其中男 29 例,女 17 例;年齡45 ~ 78 歲,平均(63.3±4.7)歲;體質量指數(23.28±2.06)kg/m2;高血壓病程(12.95±4.02)年;腦梗死部位:基底節區29 例,小腦及腦干12 例,外側腦葉5 例。另選同期體檢的健康者50 例為健康組,其中男 31 例,女 19 例;年齡 48 ~ 76 歲,平均(61.8±5.0)歲;體質量指數(23.16±2.05)kg/m2。3 組上述資料差異均無統計學意義(均 P > 0.05)。
1.2 納入及排除標準 (1)納入標準:符合H 型高血壓的診斷標準[3],急性腦梗死的診斷標準[4],且腦梗死病情經MRI、CTA、CT等影像學明確;發病至就診時間<24 h;簽署知情同意書。(2)排除標準:繼發性高血壓;凝血功能障礙;高血壓腦出血;顱內腫瘤、動脈瘤破裂;糖尿病、惡性腫瘤、原發性心肌病、心肌梗死、血液系統疾病及免疫系統疾病;精神疾病、阿爾茨海默病;急慢性肝腎功能不全;近3 個月內服用他汀類藥物、-受體阻滯劑等藥物治療。
1.3 方法 (1)使用全自動無創性便攜式24 h動態血壓監測儀(型號:Spacelabs 90207 型,生產廠家:美國Spacelabs 醫療公司)測定入選者的24 h 動態血壓,將袖帶固定于患者的右肘上方5 cm處,有效血壓≥總測量次數的80%,舒張壓(DBP)40 ~ 130 mmHg(1 mmHg≈0.133 kPa),收縮壓(SBP)70 ~ 220 mmHg。血壓監測時間為24 h,白天(06:00 ~ 22:00)測定頻率為 30 min/次,夜間(22:00 ~ 06:00)測定頻率為 60 min/次。血壓晝夜節律以夜間血壓下降率表示,夜間血壓下降率=(白晝收縮壓均值-夜間收縮壓均值)/白晝收縮壓均值×100%。(2)于患者入院后第2 天清晨(健康者為體檢當日)采集空腹靜脈血3 ml,離心10 min(離心條件:半徑6 cm,轉速3 000 r/min),取血清,采用酶聯免疫吸附法測定LP-PLA2 水平,采用全自動生化分析儀(型號:BS-480,生產廠家:邁瑞醫療)測定RDW、UA 水平。
1.4 統計方法 采用SPSS 22.0 統計軟件進行處理,計量資料以均數±標準差表示,多組間比較采用單因素方差分析,多重比較采用LSD-t 檢驗;相關性分析采用Pearson 分析。P <0.05 為差異有統計學意義。
2 結果
2.1 3 組24 h 動態血壓及夜間血壓下降率比較 非杓型組24 h 動態血壓各指標均高于杓型組和健康組,夜間血壓下降低于杓型組和健康組(均P<0.05)。見表1。
2.2 3 組 LP-PLA2、RDW、UA 水平比較 非杓型組 LP-PLA2、RDW、UA 均高于杓型組和健康組(均P<0.05),見表2。
2.3 血壓晝夜節律性與LP-PLA2、RDW、UA相關性 夜間血壓下降率與LP-PLA2、RDW、UA 均呈負相關(r=- 0.722、- 0.423、- 0.593,均 P < 0.05)。
3 討論
健康狀態下的動脈血壓會呈雙峰雙谷或雙峰一谷的晝夜波動,即夜間血壓比白天降低的杓型改變。正常的血壓晝夜節律變化在維持各器官適應機體活動、功能及保護血管結構中具有重要意義;若遭到破壞則會進一步加劇各器官功能的受損程度。因此,積極探討影響血壓晝夜節律的相關指標,并采取針對性預防措施,對降低心、腦、腎等重要臟器功能損傷程度尤為關鍵。
本研究非杓型組RDW 高于杓型組和健康組,且夜間血壓下降率與RDW呈負相關。這可能是非杓型患者的血壓晝夜節律變化改變血管壁切力,破壞內皮細胞,造成血管內皮合成,釋放的舒縮血管活性物質失衡,加重高血壓病情及自主神經失衡,損傷心腦腎等靶器官,導致血壓晝夜節律消失,加劇氧化應激及炎癥反應過程,降低紅細胞生存率,提升RDW 水平;此外,高血壓可通過激活RAAS系統途徑對RDW產生影響[5]。LPPLA2 可通過催化 ox-LDL 的氧化卵磷脂Sn-2 位酰基鏈的水解,而產生游離氧化脂肪酸、溶血磷脂酰膽堿等強促炎物質,在二者刺激下可誘發黏附因子及細胞因子產生,形成級聯反應,活化單核細胞,并使其大量聚集于血管內膜,誘發血管內皮損傷,形成動脈粥樣硬化。本研究非杓型組 LP-PLA2 高于杓型組和健康組,且與夜間血壓下降率呈負相關。可見 LP-PLA2 可能通過炎癥反應等途徑參與血壓晝夜節律的改變過程中,且是造成非杓型組患者靶器官損傷較重的機制之一;但關于其作用于血壓晝夜節律的機制尚未明確,后期仍需進一步探討。UA可作為早期微血管損傷的反映指標,且與H型高血壓伴急性腦梗死的動脈粥樣硬化斑塊厚度呈正相關[6]。本研究非杓型組UA 高于杓型組和健康組,且夜間血壓下降率與UA 呈負相關。這可能是非杓型組患者夜間血壓持續升高可加重心血管系統的負荷,減少腎血流,增加腎內血管阻力,大量丟失白蛋白,降低UA 水平,誘發彌散性微血管病變。
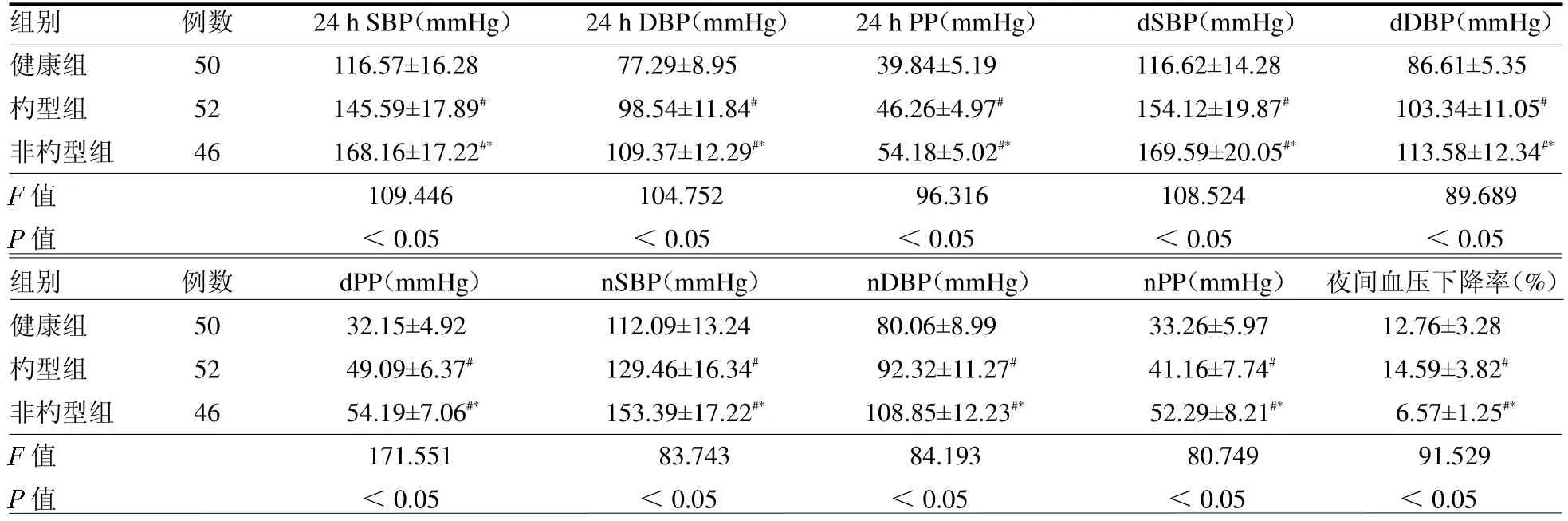
表1 3 組24 h 動態血壓及夜間血壓下降率比較
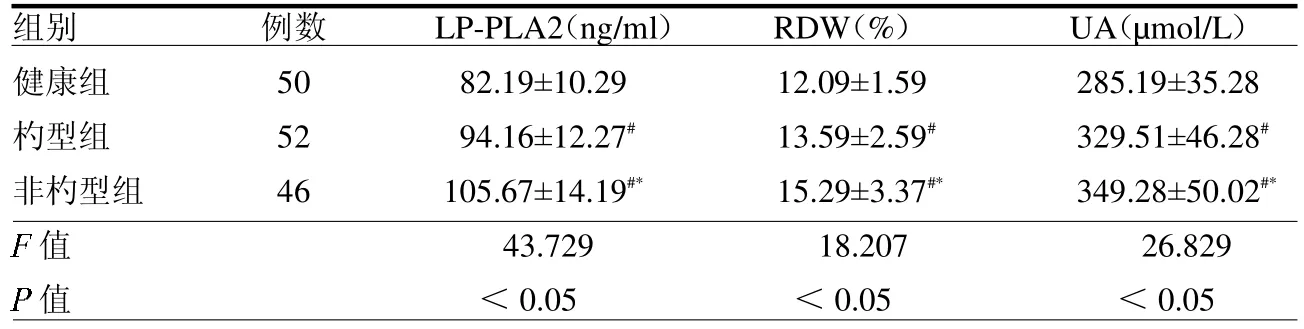
表23 組 LP-PLA2、RDW、UA 水平比較
綜上所述,H 型高血壓伴急性腦梗死患者的血壓晝夜節律性與 LP-PLA2、RDW、UA水平呈負相關,非杓型H型損傷更嚴重。

