二甲雙胍在抗癌領域的研究進展 *
熊惠娟,王宇靜,李向華,胡春弟,王小波
(湖北科技學院藥學院,湖北 咸寧 437100)
1922年,Werner等[1]合成了二甲雙胍及相關的雙胍類化合物,為二甲雙胍的廣泛應用奠定了基礎。二甲雙胍作為小分子藥物,它具有廉價、安全、容易被吸收等特點。多項研究表明,二甲雙胍可通過激活腺苷活化蛋白激酶(AMPK),抑制mTOR信號通路和胰島素樣生長因子信號轉導來阻礙腫瘤細胞增殖[2-4],能活化抑癌基因p53來阻滯腫瘤細胞周期以及誘導細胞凋亡,還可以通過調節細胞線粒體中的能量供需平衡來達到抑制腫瘤的效果[5-6],這些功能使二甲雙胍能夠降低由2型糖尿病引起的肝癌、胰腺癌、子宮內膜癌、結腸癌、乳腺癌和膀胱癌等癌癥的風險[7]。Bowker等[8]的研究結果表明,接受二甲雙胍治療的糖尿病患者的相關癌癥死亡率明顯比接受磺脲類降糖藥物或胰島素患者的相關癌癥死亡率低。種種實驗跡象表明,二甲雙胍在降低多種癌癥死亡率、延長生存期等方面具有不可磨滅的貢獻,目前,對于二甲雙胍抗癌活性的作用機制有了一定的認識,但是綜合來看,依然只是可見一斑。本文主要從近些年單獨使用二甲雙胍、與其他藥物聯合以及結合其他治療方法在抗癌領域的一些代表性研究成果進行綜述。
1 單獨使用二甲雙胍
在現有的相關試驗中[9]已經證明了二甲雙胍在對卵巢癌、胰腺癌、大腸癌、急性早幼粒細胞白血病、肝癌、乳腺癌等相關癌癥中具有出乎意料的抗癌效果。
1.1 卵巢癌
Hart等[10]通過一系列體外試驗證明,二甲雙胍可以調節鞘脂變阻器,從而減輕由鞘氨醇-1-磷酸(S1P)引起的卵巢癌吞噬。S1P是鞘氨醇的一種生物活性代謝產物,它可以增強細胞增殖,并在TYKNU和CAOV3卵巢癌細胞中表達,本實驗使用qRT-PCR技術、免疫印跡法、MTT檢測和集落形成試驗證明二甲雙胍可以抑制S1P的蛋白表達,并發現S1P變阻器是二甲雙胍在卵巢癌中的新靶點,其中SPHK1是鞘氨醇激酶(SPHK)的一種脂質介質,催化鞘氨醇形成S1P,SPHK1水平升高可以增加對二甲雙胍的敏感性,SPHK1的水平降低可以增強對二甲雙胍的耐藥性,對于缺氧誘導的SPHK1尤其敏感,這對于將高度表達的SPHK1作為預測生物標志物也具有重大意義。
1.2 胰腺癌
Boukalova等[11]設計合成了一種線粒體靶向二甲雙胍MitoMet(見圖1)和它的類似物NorMitoMet,用結晶紫染色法測定了他們對不同胰腺癌細胞株的活力影響。實驗結果顯示MitoMet比二甲雙胍殺死胰腺癌細胞的效率要高四個數量級,而NorMitoMet的IC50值比MitoMet約高20倍,該團隊通過高分辨率呼吸測量發現MitoMet和NorMitoMet均通過靶向線粒體復合物I(CI)抑制細胞呼吸,細胞的呼吸頻率越高,糖酵解的速度越低,那么胰腺癌細胞對MitoMet和NorMitoMet的敏感性就越高,因此,這是一類十分具有研究價值的抗癌藥物,可以大大提高胰腺癌細胞的死亡率,節約成本。
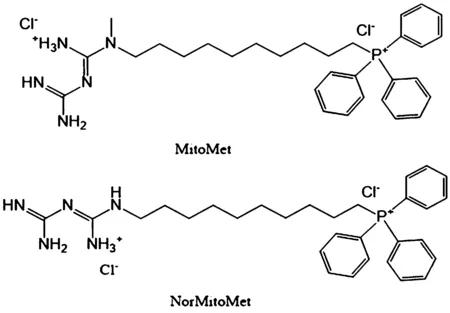
圖1 MitoMet和NorMitoMet的分子結構
1.3 結直腸癌
Nguyen等[12]在一項藥理性抑制研究中表明,二甲雙胍可以通過抑制NADPH氧化酶活性抑制石膽酸(LCA)誘導的活性氧(ROS)產生,從而降低轉錄因子NF-κB活性,以調控由LCA刺激引起的白細胞介素-8(IL-8)上調,阻止大腸癌細胞(CRC)的增殖和血管生成。LCA已經被證明是CRC的啟動子,LCA通過產生ROS破壞胃腸道上皮襯里、誘導癌癥干細胞增殖、幫助癌細胞逃過免疫系統的侵襲。該團隊在最新的研究中發現,LCA可以誘導CRC細胞中IL-8的表達,使大腸癌細胞增殖和生成血管。該團隊對二甲雙胍的研究加深了我們對它的抗癌作用的理解,為二甲雙胍在CRC治療中提供了新的思路。
1.4 急性早幼粒細胞白血病細胞
懷磊等[13]設計了一項針對二甲雙胍對急性早幼粒細胞白血病細胞系NB4細胞的影響和作用機制的體外試驗,使用MTT比色法檢測NB4細胞的增殖能力,Western blot檢測細胞外信號調節激酶(ERK)磷酸化水平,以此判斷細胞凋亡率和粘附力能力的大小。該實驗結果表明,二甲雙胍以濃度和時間依耐性降低NB4細胞的增殖和分化,加速細胞凋亡,增強細胞與細胞間的粘附能力,防止腫瘤細胞進一步擴散至其他正常細胞和組織中。該團隊在探討二甲雙胍這種影響的作用機制中發現,二甲雙胍可能通過MEK/ERK信號通路、LKB1/AMPK信號通路、激活caspase-3蛋白酶等方式抑制NB4細胞增殖和分化,促使腫瘤細胞的凋亡和粘附。
1.5 肝癌
Shankaraiah等[14]構建了一種肝硬化背景下CCl4誘導肝癌小鼠模型,旨在探討二甲雙胍與肝腫瘤之間的關聯。該小組通過轉氨酶分析測定二甲雙胍干預的小鼠肝臟的谷丙轉氨酶(AST)和谷草轉氨酶(ALT)水平,用超聲波監測小鼠肝臟的結節生長情況,Western blot分析二甲雙胍給藥前后影響小鼠肝臟中纖維化的a-SMA蛋白水平,用肝臟組織病理學觀察肝細胞中影響肝硬化的指標:脂滴積累。最終研究結果顯示,二甲雙胍能有效抑制肝星狀細胞(HSC)激活,減少肝臟纖維化及肝硬化,預防肝腫瘤發生。此外,該團隊還發現二甲雙胍對肝癌細胞的抑制作用是通過激活LKB1介導的AMPK通道實現的。
1.6 乳腺癌
Yang等[15]進行了一項關于二甲雙胍對乳腺癌細胞作用機制的細胞試驗,該團隊應用了MTT法、RT-PCR法、免疫印跡分析、熒光素酶報告基因檢測以及染色質免疫沉淀分析等常規技術手段驗證了二甲雙胍對乳腺癌細胞增殖具有顯著的抑制作用,降低癌細胞中高遷移率族蛋白2(HMGA2)的啟動子、mRNA和蛋白質水平,HMGA2在癌細胞中能促進癌細胞的增殖和擴散,常在乳腺癌、結腸癌或肺癌細胞中表達。該小組研究人員還發現HMGA2啟動子的激活可能與轉錄因子SP1有關,而二甲雙胍則通過下調轉錄因子SP1的數量以達到滅活HMGA2的目的。
2 二甲雙胍聯合其他抗癌藥物
目前臨床上用于治療癌癥的主要是一些天然的抗癌活性物質和鉑類化合物,它們通常抑制癌細胞的有絲分裂和線粒體呼吸[16],降低線粒體膜電位水平[17],促進細胞色素c釋放[18],使細胞產生ROS來阻礙腫瘤生成,誘導凋亡[19]。但這些藥物具有毒性大、敏感性差、細胞易耐藥等副作用[20],限制它們的臨床作用,聯合二甲雙胍卻能有效降低這些副作用。
2.1 聯合紫杉醇
Zhao等[21]為了評價二甲雙胍和紫杉醇(PTX)聯合使用對前列腺癌(PCa)細胞的影響,采用MTT法和顯微鏡觀察二甲雙胍和PTX聯合應用后PCa細胞的增殖情況,Annexin V和碘化丙啶染色法對PCa凋亡細胞進行流式細胞術檢測,并以單獨使用MET作為對照組。結果顯示,MET和PTX以劑量和時間依賴的方式抑制PCa細胞的生長并增加了PTX對腫瘤細胞的敏感性,方便PTX更好地殺死癌細胞。該團隊在對該作用的機制研究中發現,MET和PTX聯合可顯著提高引起細胞凋亡的蛋白酶caspase-3/7的活性,降低抗細胞凋亡蛋白Bcl-2的表達,促進PCa細胞產生ROS,降低細胞內線粒體膜電位和ATP水平,加快PCa細胞死亡并抑制它的生長,該團隊接下來的研究將重點放在雄激素是否會對PCa細胞的ROS水平產生影響。
2.2 聯合奧沙利鉑
Huang等[22]在探究二甲雙胍在奧沙利鉑(OXA)治療結直腸癌(CRC)的作用中發現,二甲雙胍可通過降低癌細胞高遷移率族蛋白1(HMGB1)mRNA的表達加強OXA對結直腸癌細胞的毒性,抑制其生長,OXA以劑量依賴性的方式誘導高遷移率族蛋白1(HMGB1)mRNA在細胞中的表達,HMGB1是一種高度保守的核蛋白,它可以在細胞核中結合各種轉錄因子,修復損傷的DNA雙鏈,增加細胞核DNA的復制、轉錄和修復過程,還可以增加癌細胞對OXA的耐藥性,抑制促進細胞凋亡的蛋白酶caspase-3/7的活性,HMGB1的各種影響阻礙了OXA對CRC患者的治療。其次,該團隊發現,二甲雙胍通過抑制ERK和AKT的信號通路和NF-κB活性減弱癌細胞對OXA的抗藥性,這個發現對二甲雙胍輔助治療CRC患者和化療具有重要影響。
2.3 聯合順鉑
Moro等[23]設計研究了幾項關于二甲雙胍聯合順鉑(MC)對非小細胞肺癌(NSCLC)細胞KRAS/LKB1基因共突變的影響的體內體外試驗,KRAS是一種鼠類肉瘤毒癌基因,它的異常會導致細胞快速增殖,LKB1基因也參與調控生命體的多種基本活動。在體外試驗中,該團隊將共突變KRAS/LKB1中的CD133細胞作為腫瘤干細胞(CSC)的標志物,通過檢測MC組和單獨使用順鉑組的CD133富集程度來判斷他們的凋亡情況,結果表明,MC相對于順鉑顯著降低了CSC水平。接下來該團隊為了證明二甲雙胍在共突變KRAS/LKB1的NSCLC細胞中的抗腫瘤作用,應用了兩種異種移植物(PDXs)模型,分別檢測不同劑量的二甲雙胍及聯合順鉑后對腫瘤大小的影響,試驗結果顯示二甲雙胍可以降低核抗原Ki-67的表達,增加凋亡因子蛋白酶caspase-3的表達,從而抑制腫瘤生長。而且,二甲雙胍對于加強順鉑對共突變KRAS/LKB1 NSCLC細胞的敏感性具有不可磨滅的作用。
2.4 聯合多柔比星
袁瑩瑩等[24]發現,二甲雙胍以劑量和時間依賴性的方式聯合蒽環類抗生素多柔比星比單獨使用二甲雙胍更能顯著抑制急性早幼粒細胞白血病細胞系NB4細胞生長,促進癌細胞凋亡,降低凋亡因子蛋白酶caspase-3和caspase-9的活性;其次,該團隊發現二甲雙胍可以增強NB4細胞在化療過程中對多柔比星的敏感性,減輕NB4細胞對多柔比星的抗藥性。這在懷磊等[13]的研究基礎上更進一步加強了二甲雙胍對NB4細胞作用影響的認識,針對二甲雙胍的這種特性,越來越多的研究人員將目光放在二甲雙胍在惡性腫瘤臨床中的輔助治療。
3 二甲雙胍聯合其他抗癌療法
化療、間歇性禁食等是治療惡性腫瘤晚期的方法,但化療給病人帶來極大的痛苦,如骨髓抑制和惡心、嘔吐等胃腸道副作用[25],限制了它的臨床應用,二甲雙胍可以減輕由化療帶來的某些副作用且它在血糖低的環境中活性更大。
3.1 聯合化療
Nanni等[26]探討了一項針對于二甲雙胍聯合化療與單獨化療對乳腺癌(metastatic breast cancer,MBC)治療效果的臨床試驗,以112名MBC患者為試驗對象,將胰島素抵抗患者指標(homeostasis model assessment,HOMA≥2.5)作為評價患者是否胰島素抵抗的指標,用無進展生存(PFS)和總生存率(OS)來判斷化療后二甲雙胍對腫瘤的影響。該團隊的試驗結果表明,與化療相比,二甲雙胍聯合化療并沒有表現出對乳腺癌細胞的協同抑制效應,因此,沒有臨床研究價值,但顯著的降低了腫瘤的中性粒細胞數量,二甲雙胍通過激活腺苷活化蛋白激酶(AMPK)以調節細胞線粒體能量代謝可使患者胰島素敏感,該團隊正在進行另外一項隨機試驗旨在明確二甲雙胍引起的胰島素敏感變化是否朝著對臨床有益的方向進行。
3.2 聯合間歇性禁食
Elgendy等[27]在研究二甲雙胍協同間歇性禁食對惡性腫瘤影響的在體試驗中發現,二甲雙胍在接種了人結腸癌細胞并禁食處于低血糖狀態下的小鼠中,通過抑制蛋白磷酸酶(PP2A)的癌癥抑制因子(CIP2A)和上調催化亞基B56D來活化糖原合成酶激酶3β(GSK3β),減少了抗凋亡蛋白(MCL-1)的表達,誘導癌細胞凋亡,達到抑制腫瘤的目的。該團隊認為,在確定該方法的安全性和有效性的前提下,PP2A-GSK3β-MCL-1信號傳導通路可以作為二甲雙胍治療癌癥的新靶點,并進行下一步的臨床試驗。
4 展 望
本文綜述了二甲雙胍近幾年在抗腫瘤方面的最新研究進展,總體來說,二甲雙胍具有一定的癌癥研究價值,但大多研究都指向高劑量的二甲雙胍的活性要遠大于低劑量的二甲雙胍活性,高劑量的二甲雙胍在生物體內易累積中毒,如乳酸中毒,胃腸道反應,嚴重的引起維生素B12缺乏且伴有神經性疾病[28-29]。針對這種現象,近期又有人提出了靶向藥物療法,旨在通過二甲雙胍聯合單克隆抗體或小分子抑制劑靶向進入癌細胞,促進癌細胞凋亡,增強細胞敏感性[30]。近期的新冠狀病毒(2019-nCoV)爆發之際,有人提出了宿主導向治療2019-nCoV感染,二甲雙胍的其中一個作用機制是激活腺苷活化蛋白激酶(AMPK)抑制細胞生長提高人體免疫力,這使得一些研究人員認為二甲雙胍也許可以通過提高宿主免疫力來預防2019-nCoV感染,對二甲雙胍這個“神奇小分子”來說,無疑又將面臨著新的機遇和挑戰[31]。

