快速升溫下皮革珊瑚及真葉珊瑚共生蟲黃藻與共生細菌的豐度與多樣性
李長青,陸 昊,蓋如新,周 洋,王沛政,李衛東
(1.海南三亞國家級珊瑚礁自然保護區管理處,海南 三亞,572000;2.海南熱帶海洋學院 生態環境學院 海南 三亞,572022;3.海南大學 生態環境學院,海口 570228)
0 引言
珊瑚礁是世界上生物多樣性最豐富的生態系統之一。20世紀珊瑚白化已經造成世界各地珊瑚大量死亡,對海洋生態系統造成了嚴重影響[1]。由于全球氣候變暖,世界各地珊瑚礁白化頻率和程度在增加,珊瑚礁覆蓋大幅下降[2]。中國南海經常發生由于溫度變化原因導致的珊瑚白化事件[3],在過去40年間,中國南海北部東沙環礁水溫升高2 ℃導致40%的珊瑚以前所未有的速度白化[4]。
珊瑚共生體包括珊瑚宿主、珊瑚內共生蟲黃藻和微生物,微生物包括細菌、真菌、古細菌和病毒等;內共生生物與宿主之間相互作用和溝通機制對宿主健康發揮著重要作用[5-6]。蟲黃藻是珊瑚體內重要的、能進行光合作用的內共生生物[7]15667。如今珊瑚共生蟲黃藻受到全球海面溫度升高的威脅,這種溫度帶來的壓力通常會導致珊瑚體內蟲黃藻釋放,最終致珊瑚白化和死亡[8]。當環境發生變化時,蟲黃藻能夠通過改變其在珊瑚宿主內的群體結構從而適應宿主體[9-10]。
珊瑚和蟲黃藻共生體適應不斷變化的環境條件的能力取決于宿主和共生體群體的穩定性[7]15668。Berkelmans等[11]認為珊瑚對溫度的耐受性與其體內共生的蟲黃藻類型有關。共生蟲黃藻優勢種群與地理隔離和環境變化有關系[12]。在共生蟲黃藻多樣性研究中,科學家對其形態與超微結構進行了長期探索和研究[13],但是由于蟲黃藻種類繁多,其形態學特征還不能完全解決蟲黃藻分類問題[14]。相比傳統的形態學分類,使用 DNA 序列進行蟲黃藻分類分析則顯得更為高效與方便[15]。通過分子學方法研究蟲黃藻多樣性發現,蟲黃藻具有極高的多樣性[16],其種類也可由A-I的9個主要系群細分為上百個種[17]。如今ITS2(the internal transcribed spacer 2)區域仍然是學者們區分蟲黃藻種類最為有效的DNA標記方法之一[18]866。
除蟲黃藻外,珊瑚內共生細菌對珊瑚健康狀態也有著直接影響[19],珊瑚共生細菌主要集中在其黏液和體內,對維護珊瑚健康和抵抗疾病有著非常重要的保護作用[20]355,[21]。隨著高通量技術的快速發展,結合高通量技術分析細菌多樣性方法已經在珊瑚內共生細菌種群研究中得到很好的應用。Sunagawa等[22]利用高通量技術測序方法測序細菌16s rRNA基因,分析Montastraeafaveolata珊瑚內共生細菌多樣性。Bayer等[23]利用高通量方法,分析紅海Stylophorapistillata珊瑚內共生細菌多樣性,發現Endozoicomonas在這種珊瑚內胚層組織中非常豐富,這種細菌與珊瑚有著密切聯系。當環境發生變化時,如溫度升高,珊瑚共生菌在珊瑚體內可以產生有益化合物或抗體等來應對這種來自環境的壓力,來維持整個珊瑚的穩定性[20]357。Kushmaro等[24]研究發現海水溫度升高只是一個誘導因素,當海水溫度升高時,珊瑚自身抵抗力會下降并增加細菌毒性。在關于珊瑚病原體研究中發現珊瑚白化和弧菌有著直接關系[25-27]。羅尼氏弧菌Vibrioshilonii會產生胞外毒素進而抑制蟲黃藻光合作用,使蟲黃藻溶解導致珊瑚白化,且不同蟲黃藻對羅尼氏弧菌Vibrioshilonii毒素響應是不同的[28]。Serratia會導致珊瑚白痘病發生,最后影響珊瑚健康并造成珊瑚大面積死亡[29-30]。
綜上所述,共生藻和共生菌平衡對珊瑚的穩定和健康非常重要,當這種平衡由外界環境改變打破后,整個珊瑚共生藻與細菌共生系統的聯系斷裂,使得珊瑚白化或者感染疾病死亡。本研究通過2種珊瑚在熱刺激后短暫時間內,利用高通量測序方法來研究它們體內共生蟲黃藻和細菌多樣性及總量的變化情況,以期在全球氣候逐漸變暖的情況下為珊瑚礁生態系統保護和修復工作提供參考依據。
1 材料與方法
1.1材料
所有實驗樣品均從中國海南萬寧市外海采集,實驗采集軟珊瑚皮革珊瑚(Sarcophytontrocheliophorum)和石珊瑚腎形真葉珊瑚(Euphylliaancora)各5個個體,并將所有皮革珊瑚和腎形真葉珊瑚分割成約10 cm2的小個體,并將其附著在陶瓷基座上。于本實驗室珊瑚館暫養2周,珊瑚缸水體量為60 L,溫度為26 ℃,鹽度為35,pH為8.2,光暗比為12 h∶12 h,2周后待2種珊瑚所有個體恢復正常,觸手正常伸展后進行實驗。
1.2 方法
1.2.1 急性升溫應激
隨機挑選10個皮革珊瑚與10個腎形真葉珊瑚個體,分別放置于2個水族缸中(溫度:26 ℃,鹽度:35,pH:8.2,光暗比12 h∶12 h,體積:70 cm×50 cm×60 cm)。在24 h內調節加熱棒緩慢升高水族缸水溫(每隔4 h升高1 ℃),當水溫升高至32 ℃后維持12 h,其他環境條件不變。實驗結束,剪取對照組中5個皮革珊瑚個體的觸手各0.2 g,混合命名S-1;對照組腎形真葉珊瑚各0.2 g,混合命名E-1;處理組皮革珊瑚命名S-2與腎形真葉珊瑚命名E-2。
1.2.2 DNA提取、擴增和測序
使用海洋生物基因組DNA提取試劑盒(擎科,廣州,中國)提取珊瑚共生體樣本基因組。嚴格遵循試劑盒說明書步驟操作,所提 DNA 經過質量檢測后存放于-80 ℃冷凍保存備用。
對細菌16s rRNA基因的V3-V4可變區進行 PCR 擴增,高通量測序接頭序列均用下劃線標注。ITS引物和16s rRNA引物反應體系與PCR擴增程序參照文獻[31]方法。根據Illumina MiSeq平臺的標準操作規程構建 PE2×300庫,最后于Illumina Miseq PE300平臺測序(Majorbio)。
以DNA為模板,ITS2正向引物:
5-TACACGACGCTCTTCCGATCTACTGGAATTGCAGAACTCCGTG - 3
ITS2-reverse反向引物:
5-GAGTTCCTTGGCACCCGAGAATTCCAACTAGGGGATCCATATGCTTAAGTTCAGCGGGT - 3
對蟲黃藻ITS2 rDNA基因進行 PCR 擴增。
使用正向引物341F:
5′-CCCTACACGACGCTCTTCCGATCTGCCTACGGGNGGCWGCAG -3′
反向引物805R:
5′-GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHVGGGTATCTAATCC-3′對細菌16s rRNA基因的V3-V4可變區進行 PCR 擴增。
1.2.3 序列信息學分析
參照Liang等[32]的方法,使用Trimmomatic軟件平臺剔除低質量分數(<20)序列。將所有樣本序列按照序列間的距離進行聚類,序列按97%相似度標準分成不同OTU(Operational Taxonomic Units)。基于OTU聚類分析結果,使用軟件Motuur對樣本聚類結果進行阿爾法多樣性指數分析得到單樣本的多樣性(Alpha多樣性),通過 Good’s物種覆蓋度(Coverage)、群落豐富度(Ace)和群落多樣性(Shannon)指數反映微生物群落的覆蓋率、豐度和多樣性。
1.2.4 蟲黃藻ITS2序列分析
根據NCBI中的Genbank含有的蟲黃藻ITS2數據庫對所有樣本進行blastn比對分析,篩選出OTU序列的最佳比對結果,并對比對結果進行過濾,默認滿足相似度>90%且coverage>90%的序列被用來后續分類,不滿足條件的序列則被歸為unclassified[17]。最后在每種珊瑚測序結果中選取豐度較大且具有代表性的OTUs使用Maximum parsimony來構建進化樹。
使用QIIME進行network分析。選取豐度排序在前100位的OTU信息,繪圖時選取具有顯著聯系 (weight≥100) 的節點,采用kamada kawai算法進行繪圖。樣本以矩形為標識,不同樣本顏色不同,OTU或物種分類以餅圖為標識,面積大小代表整體豐度大小,餅圖中的不同色塊代表不同樣本在該OTU或物種分類上的豐度大小。
1.2.5 細菌16s序列分析
2 結果
2.1 蟲黃藻多樣性分析
蟲黃藻引物ITS2測序結果共獲得234 547個Raw num,然后按照barcode標簽序列識別并區分樣品得到各樣本數據(表1)。最后處理過濾和去除嵌合體與非特異性擴增序列后總共得到233 991個有效序列(S-1:44 091;S-2:55 356;E-1:38 039;E-2:96 505)。每個樣品獲得的OTUs進行多樣性指數分析(表2)。從Chao指數和Ace指數可以看出,在熱處理后,2種珊瑚的共生蟲黃藻測序數據總數明顯增多。在升溫后,腎形真葉珊瑚的Shannon指數降低,但皮革珊瑚Shannon指數幾乎不變,Simpson指數分析可以得到相同結果。升溫前后來看Shannon指數和Simpson指數均表明蟲黃藻多樣性方面腎形真葉珊瑚顯著高于皮革珊瑚。
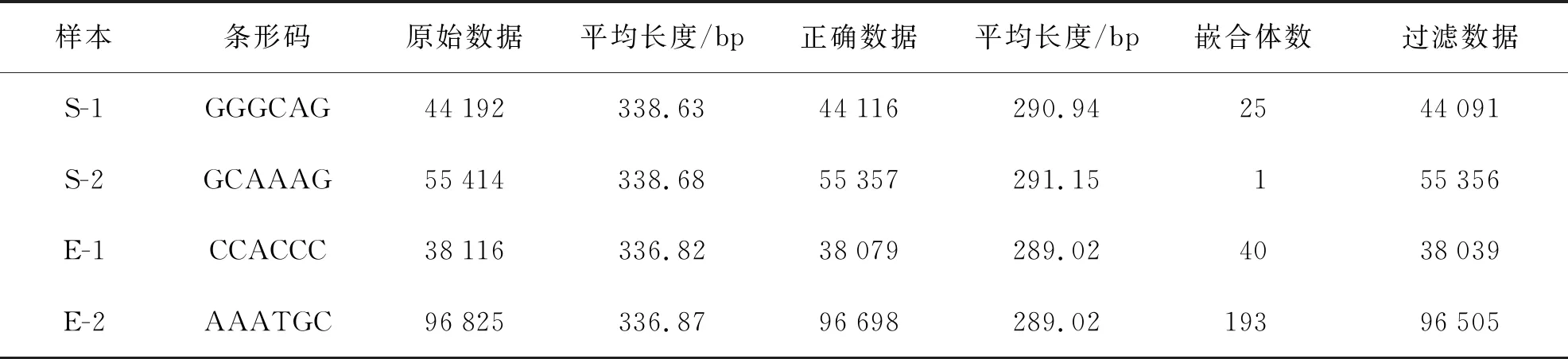
表1 蟲黃藻ITS2序列測序數據信息統計
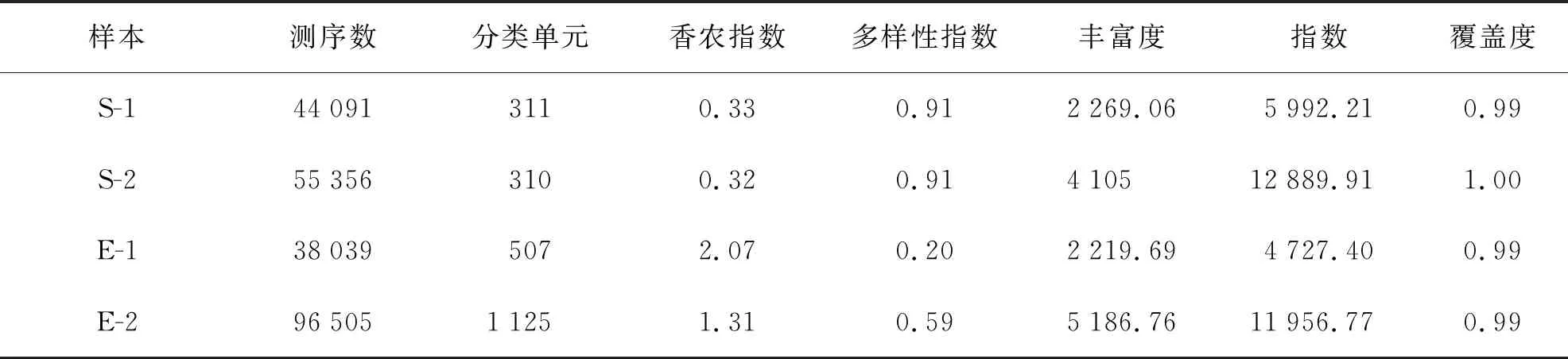
表2 Alpha多樣性指數統計
將每個樣品的OTUs與Genbank含有的蟲黃藻ITS2數據庫進行blastn比對分析,最后選取豐度較高的OTUs使用Maximum parsimony來構建進化樹(圖1)。結果顯示,在皮革珊瑚中存在Clade C和Clade D兩個系群蟲黃藻,其中:Clade C系群為皮革珊瑚優勢種群,在腎形真葉珊瑚中同樣有Clade C和Clade D兩種蟲黃藻,但Clade D為優勢種群。選取豐度排序在前100位的OTU信息,選取具有顯著聯系 (weight≥100) 的節點最后進行network分析并繪圖,結果如圖2。
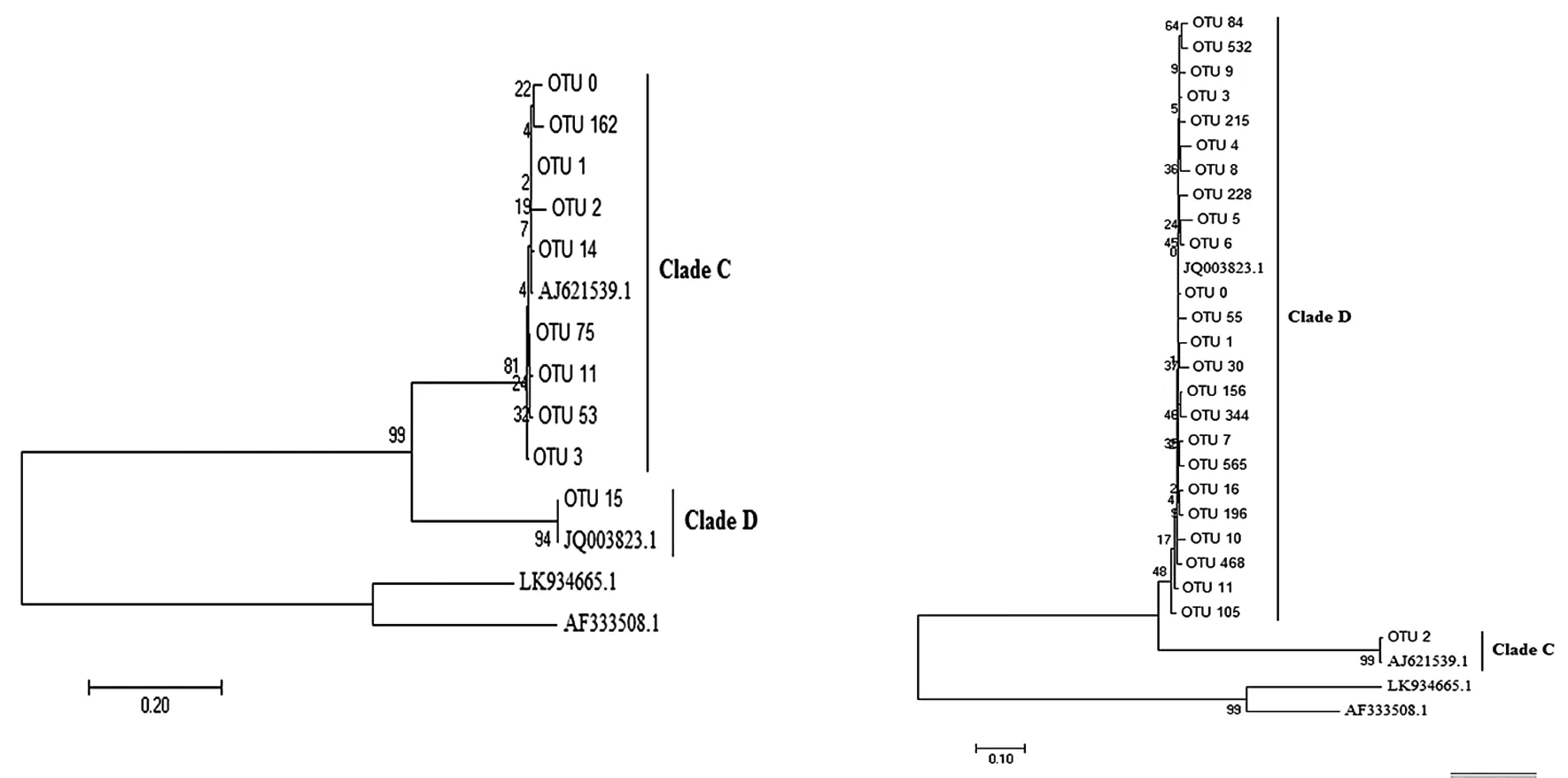
(a)皮革珊瑚 (b)腎形真葉珊瑚圖1 基于不同OTUs的ITS2基因序列構建系統進化樹
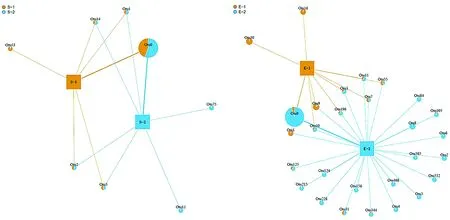
(a)皮革珊瑚 (b)腎形真葉珊瑚圖2 皮革珊瑚和腎形珊瑚的network分析結果注2:兩種珊瑚的圖中矩形代表樣本,不同樣本顏色不同;OTU以餅圖為標識,面積大小代表整體豐度大小,餅圖中的不同色塊代表不同樣本在該OTU分類上的豐度大小。
2.2 細菌多樣性
基于細菌16s rDNA基因的測序結果,經處理過濾和去除嵌合體與非特異性擴增序列后,共計得到115 692個有效序列(表3)。將所有樣本序列按照序列間距離進行聚類,再根據序列之間的相似性將序列分成不同的操作分類單元 (OTU),把每個樣品獲得的OTUs進行多樣性指數分析,結果見表4。從Chao指數和Ace指數可以看出,在熱處理后,2種珊瑚的內共生細菌的總數均出現下降。熱處理后,2種珊瑚的Shannon指數和Simpson指數呈現出明顯的差異,皮革珊瑚的內共生細菌多樣性明顯下降,而腎形真葉珊瑚的內共生細菌多樣性明顯增加。
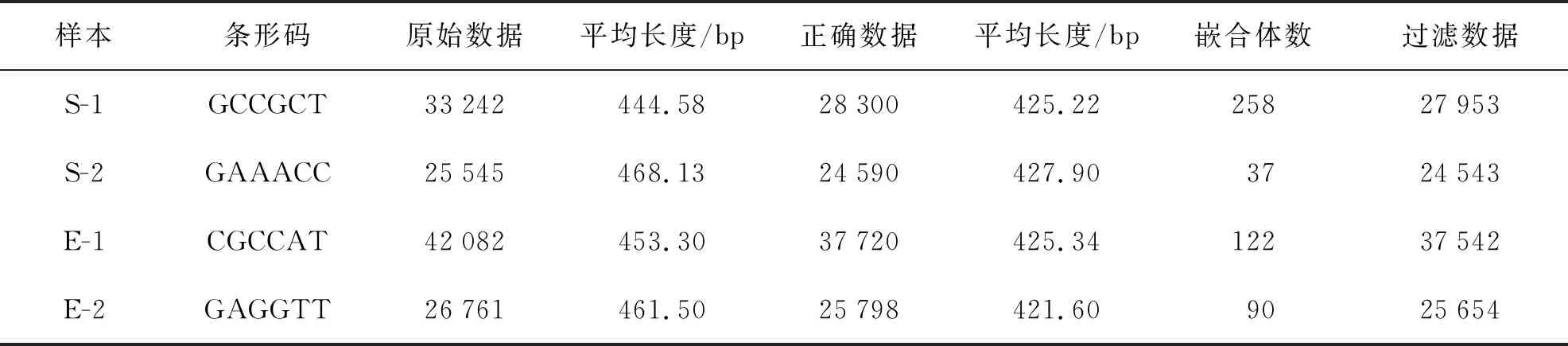
表3 基于細菌16s rDNA基因各樣本數據信息
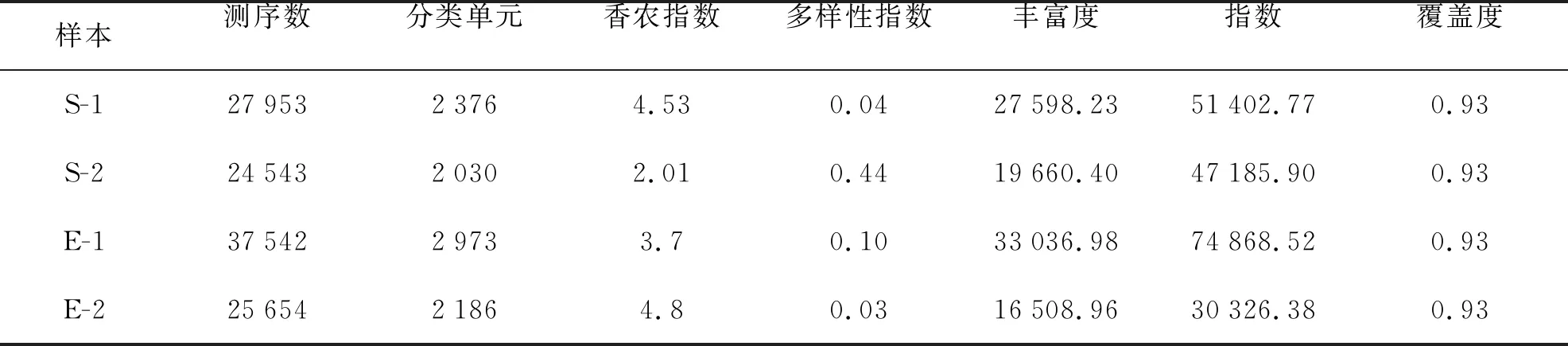
表4 Alpha多樣性指數
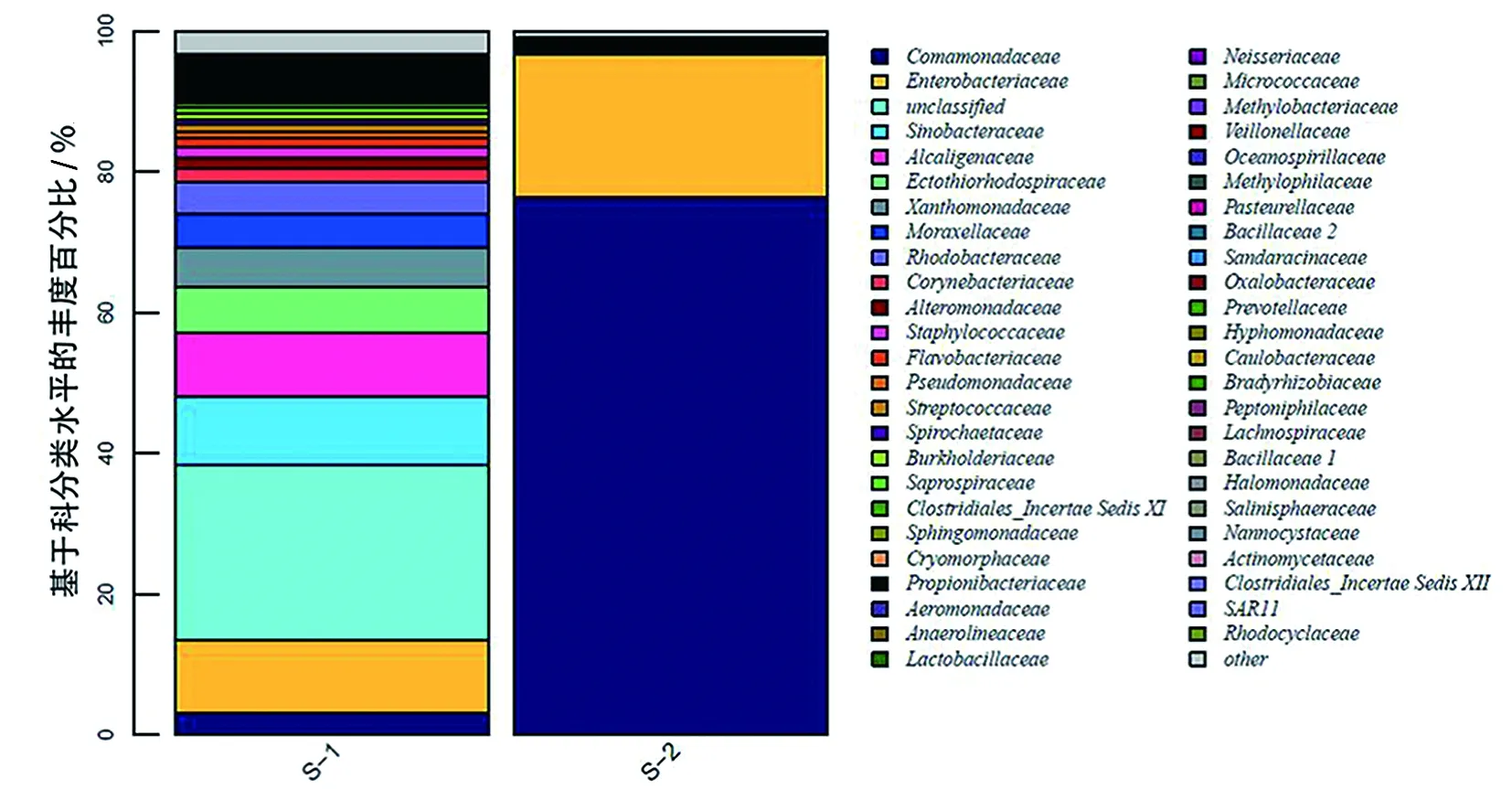
對每個樣品獲得的OTUs基于RDP數據庫進行物種分類,獲得在屬水平上群落結構分布柱狀圖(圖3)。皮革珊瑚在升溫前Spongiibacter、Achromobacter、Solimonas、Stenotrophomonas、Oceanococcus和Citrobacter為優勢種群,升溫后細菌多樣性下降明顯,Delftia和Serratia上升為優勢種群(圖4),與對照組差異顯著(P<0.01)(圖5a)。腎形真葉珊瑚珊瑚升溫前優勢種群為Oceanococcus(Ectothiorhodospiraceae科)、Solimonas(Sinobacteraceae科)、Marivita(Rhodobacteraceae科)、Citrobacter(Enterobacteriaceae科)和Stenotrophomonas(Xanthomonadaceae科),升溫后腎形真葉珊瑚細菌多樣性增加,優勢種群成為Alcanivorax(Alcanivoracaceae科)、Loktanella(Rhodobacteraceae科)、Neptuniibacter(Oceanospirillaceae科)、Leisingera(Rhodobacteraceae科)和Achromobacter(Alcaligenaceae科),其中Oceanococcus、Spongiibacter、Marivita和Solimonas的數量顯著下降(圖5b)。
(a)皮革珊瑚
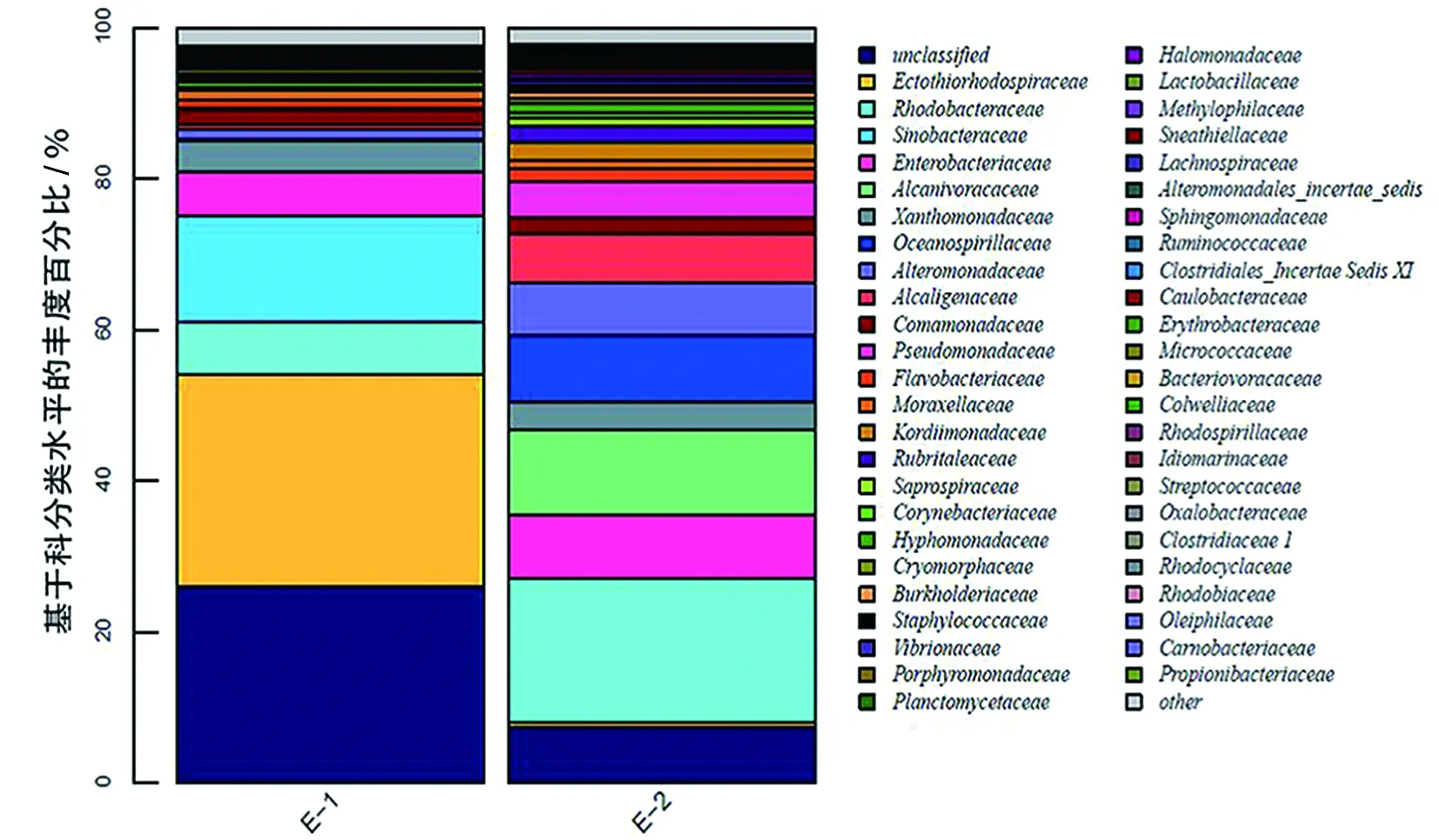
(b)腎形真葉珊瑚圖3 皮革珊瑚和腎形真葉珊瑚在熱處理前后內共生的細菌群落多樣性變化
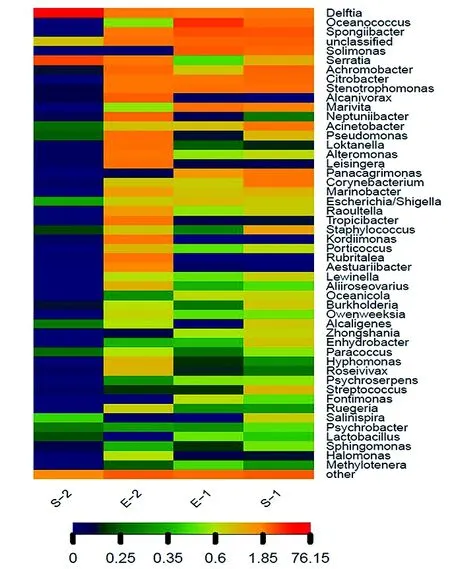
圖4 其生細菌各屬分類水平豐度熱圖
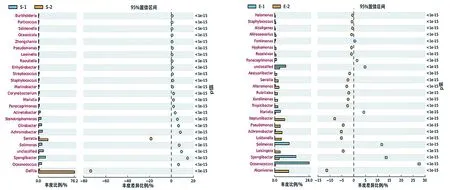
(a)皮革珊瑚 (b)腎形真葉珊瑚圖5 熱處理前后菌群豐度差異分析
3 討論
本研究利用高通量測序技術初步研究了急性熱刺激對中國南海2種珊瑚內共生蟲黃藻及細菌的響應。基于高通量測序技術OTUs框架,利用ITS2 rDNA引物擴增來研究珊瑚共生蟲黃藻的多樣性方法已被很多的研究者認可和使用[33-35]。Chen等[36]曾報道中國南海的腎形真葉珊瑚的共生藻都為Clade C,而本研究高通量測序結果表明腎形真葉珊瑚共生藻優勢系群為Clade D,皮革珊瑚內共生蟲黃藻優勢系群為Clade C。2種珊瑚在經過熱刺激處理后,內共生蟲黃藻優勢系群并沒有發生改變,這與Stat等[37]研究一致。本研究的2種珊瑚在熱刺激后短暫時間內蟲黃藻的總數增加,而 Strychar等[38]認為珊瑚在受到外界熱環境影響后導致蟲黃藻逃逸,這可能由于珊瑚熱處理后珊瑚組織失水導致;在熱刺激后皮革珊瑚內共生蟲黃藻多樣性變化不明顯,可能和皮革珊瑚對溫度的耐受性較強有關[39],而在熱處理后腎形真葉珊瑚蟲黃藻多樣性下降。
在熱刺激后2種珊瑚內共生細菌總數都下降,這可能和細菌本身對溫度的耐熱性有關,耐熱性低的細菌會在升溫后死亡。皮革珊瑚在升溫后內共生細菌多樣性降低,內共生細菌Delftia(Comamonadaceae科—Burkholderiales目)和Serratia(Enterobacteriaceae科—Enterobacteriales目)成為優勢種群。其原因可能為Delftia是好氧菌(aerobic),在熱刺激后珊瑚代謝增強,蟲黃藻總量增加,光合作用釋放了更多的氧氣,導致好氧菌Delftiasp數量增加成為優勢菌所致。Ritchie[40]研究發現珊瑚共生細菌能夠分泌具有抗生素能力的黏液來抵抗Serratia,升溫破壞了珊瑚的這種抵抗能力。Chiu[41]對Euphyllia glabrescens的共生細菌分布研究發現Alphaproteobacteria經常分布在黏液和表皮之間,而Gammaproteobacteria在胃腸道中檢測到,并且在黏液和表皮中很少觀察到。腎形真葉珊瑚在熱刺激前,Gammaproteobacteria(Oceanococcus、Solimonas、Citrobacter、Stenotrophomonas)和Alphaproteobacteria(Marivita)為優勢種群,這和Chiu[41]的研究結果一致。腎形真葉珊瑚在熱刺激后其內共生細菌多樣性變高,Alcanivorax(Alcanivoracaceae科)、Loktanella(Rhodobacteraceae科)、Neptuniibacter(Oceanospirillaceae科)、Leisingera(Rhodobacteraceae科)和Achromobacter(Alcaligenaceae科)變為優勢菌,常見的珊瑚病原菌Vibrio、Cyanobacteria和Serratia等變化不明顯。

