遺忘型輕度認(rèn)知功能障礙患者齒狀核靜息態(tài)功能連接改變及其與認(rèn)知功能的相關(guān)性
湯凡宇, 林興建, 祝東林, 馬文穎, 石靜萍
(南京醫(yī)科大學(xué)附屬腦科醫(yī)院神經(jīng)內(nèi)科, 江蘇 南京 210029)
遺忘型輕度認(rèn)知功能障礙(amnesic mild cognitive impairment ,aMCI)是阿爾茨海默病(Alzheimer′s disease,AD)的臨床前期階段,患者表現(xiàn)為認(rèn)知功能輕度下降,但日常生活并不受影響[1-3]。目前我國(guó)60歲及以上人群中大約有1 507萬人患有癡呆,其中AD約為983萬[4]。美國(guó)老年及衰老協(xié)會(huì)指南推薦,宜對(duì)AD患者進(jìn)行早期診斷和早期干預(yù),aMCI階段是延緩病情發(fā)展和治療的關(guān)鍵時(shí)期[2]。小腦對(duì)大腦認(rèn)知功能網(wǎng)絡(luò)有一定的影響,而齒狀核作為最大的小腦核團(tuán)在小腦與大腦網(wǎng)絡(luò)連接中起著中繼站的重要作用[5]。目前,關(guān)于aMCI的影像學(xué)研究主要針對(duì)海馬、內(nèi)側(cè)顳葉、雙側(cè)扣帶后皮質(zhì)、楔前葉和顳頂外側(cè)葉等大腦皮層區(qū)域,而小腦齒狀核和大腦之間的功能連接差異特征尚不清楚。因此,本研究運(yùn)用靜息態(tài)功能磁共振成像(resting-state functional magnetic resonance imaging, rs-fMRI)技術(shù)探究aMCI患者雙側(cè)齒狀核功能連接改變特征及其與認(rèn)知功能的相關(guān)性。
1 病例與方法
1.1 研究對(duì)象
選擇2018年1月至2020年12月就診于南京腦科醫(yī)院神經(jīng)內(nèi)科34例aMCI患者作為觀察組,所有患者符合美國(guó)國(guó)家衰老研究所及阿爾茨海默病協(xié)會(huì)(National Institute on Aging-Alzheimer′s Association,NIA-AA)聯(lián)合推出的MCI臨床診斷標(biāo)準(zhǔn)[2]。納入標(biāo)準(zhǔn):患者主訴為記憶力下降并由家屬或知情者證實(shí);認(rèn)知功能減退呈單域或多域;正常的日常生活不受影響;臨床癡呆評(píng)定表(CDR)分值0.5。另選擇同期與觀察組年齡、性別、學(xué)歷匹配的34例健康者作為對(duì)照組。納入標(biāo)準(zhǔn):無其他嚴(yán)重神經(jīng)系統(tǒng)或精神疾病;體格檢查未見神經(jīng)系統(tǒng)異常體征;無記憶力下降主訴;CDR分值0。排除標(biāo)準(zhǔn):排除其他原因所致癡呆,如路易體癡呆、額顳葉癡呆、血管性癡呆、嚴(yán)重精神類疾病、腦血管病、腫瘤、中毒和代謝感染疾病等;MRI檢查禁忌證(幽閉恐懼癥、心臟起搏器植入等)。所有受試者均給予研究解釋并簽署知情同意書。
1.2 神經(jīng)心理學(xué)量表評(píng)估
所有受試者均接受專業(yè)的認(rèn)知評(píng)估,包括簡(jiǎn)易智能精神狀態(tài)量表(MMSE),蒙特利爾認(rèn)知評(píng)估量表(MOCA)評(píng)估總體認(rèn)知情況,聽覺詞語學(xué)習(xí)測(cè)驗(yàn)(AVLT)評(píng)估記憶功能,畫鐘試驗(yàn)評(píng)估視空間能力,數(shù)字符號(hào)轉(zhuǎn)換測(cè)試(SDMT)、數(shù)字廣度測(cè)試(DST)用來評(píng)估注意力,波士頓命名測(cè)試(BNT)檢測(cè)詞語命名能力,言語流暢性測(cè)試(VFT)評(píng)估言語流暢性,連線測(cè)試用來檢測(cè)執(zhí)行力及注意力。
1.3 腦脊液生物標(biāo)志物檢測(cè)
腦脊液中的β-淀粉樣蛋白(amyloid β-protein, Aβ1-42、Aβ1-40)、總tau蛋白(total tau, t-tau)和磷酸化tau蛋白(phosphorylated tau, p-tau)采用INNO-BIA AlzBio3免疫分析試劑盒(比利時(shí)根特公司)測(cè)定。研究中,34例aMCI受試者采集腦脊液樣本,由于腰椎穿刺術(shù)是一種侵入性操作,對(duì)照組未采集腦脊液樣本。
1.4 磁共振數(shù)據(jù)采集
采用西門子3.0 T singer掃描儀(德國(guó)西門子公司)與8通道射頻線圈采集掃描相關(guān)數(shù)據(jù)。受試者取仰臥位,頭部用專用海綿襯墊固定以減少頭部活動(dòng),戴上耳塞以減小噪音干擾。受試者盡可能地保持靜止,閉上雙眼,保持清醒,盡量不要思考。三維T1加權(quán)圖像在矢狀方向采用3D-SPGR序列獲得,參數(shù)如下:重復(fù)時(shí)間=3 ms;回聲時(shí)間=2 530 ms;翻轉(zhuǎn)角=7°;128個(gè)時(shí)間點(diǎn);1.3 mm層厚;視野=256 mm×256 mm。rs-fMRI采集應(yīng)用單次回波激發(fā)成像。掃描參數(shù):240個(gè)時(shí)間點(diǎn);重復(fù)時(shí)間=30 ms;回聲時(shí)間=2 000 ms;視野=240 mm×240 mm;矩陣=64×64;翻轉(zhuǎn)角=90°;36個(gè)軸向片;3.0 mm厚度;切片間隙=0 mm。每個(gè)受試者的成像時(shí)間約為14 min。
1.5 數(shù)據(jù)圖像預(yù)處理
rs-fMRI的數(shù)據(jù)預(yù)處理使用軟件DPARSF(http://www.est.restfmri.net)[6]。首先,去除每個(gè)數(shù)據(jù)前10個(gè)時(shí)間點(diǎn),將剩余圖像進(jìn)行時(shí)間層及運(yùn)動(dòng)校正(所有受試者頭動(dòng)最大位移<3 mm,每個(gè)軸的旋轉(zhuǎn)角度<3°),接著進(jìn)行配準(zhǔn),圖像分割,使用蒙特利爾神經(jīng)研究所(Montreal Neurological Institute, MNI)回波平面成像模板將圖像進(jìn)行空間標(biāo)準(zhǔn)化,重采樣成3 mm×3 mm×3 mm空間分辨率,并用4 mm半高全寬平滑核進(jìn)行空間平滑處理。然后對(duì)fMRI數(shù)據(jù)進(jìn)行時(shí)間帶通濾波(0.01~0.08 Hz),以去除低頻漂移和生理高頻噪聲。為進(jìn)一步減少混雜因素的影響,采用線性回歸方法從數(shù)據(jù)中剔除線性漂移、6個(gè)運(yùn)動(dòng)參數(shù)和全腦內(nèi)所有白質(zhì)和腦脊液信號(hào)的平均時(shí)間序列。
1.6 全腦數(shù)據(jù)功能連接分析
由WFU Pick Atlas (http://www.ansir.wfubmc.edu)提取雙側(cè)齒狀核作為感興趣區(qū),并重新配準(zhǔn)到MNI空間。提取感興趣區(qū)內(nèi)的血氧水平依賴性時(shí)間序列,生成每個(gè)感興趣區(qū)的參考時(shí)間序列,利用體素-體素的方式通過計(jì)算每個(gè)感興趣區(qū)時(shí)間序列與全腦其他腦區(qū)體素的時(shí)間序列之間的相關(guān)系數(shù),之后利用Fisherz轉(zhuǎn)換得到相關(guān)系數(shù),來提高其正態(tài)性。所有受試者得到2個(gè)z值圖,即2個(gè)齒狀核的靜息態(tài)功能連接圖。如圖1。
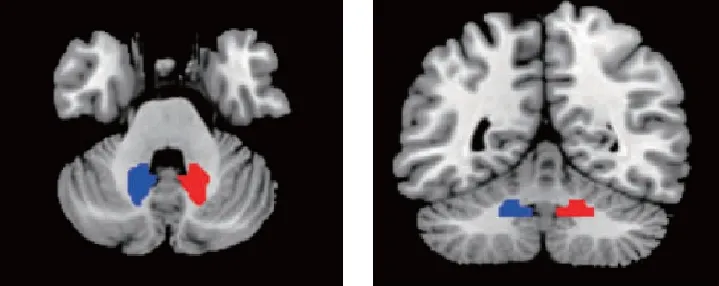
藍(lán)色為右側(cè)齒狀核,紅色為左側(cè)齒狀核圖1 WFU Pick Atlas軟件提取感興趣區(qū)
1.7 統(tǒng)計(jì)學(xué)方法
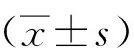
2 結(jié)果
2.1 人口學(xué)資料和臨床量表評(píng)估
兩組間神經(jīng)心理學(xué)量表及年齡、性別、受教育程度等比較,差異均無統(tǒng)計(jì)學(xué)意義(P> 0.05 )。觀察組量表得分均明顯低于對(duì)照組(P均< 0.05)。見表1。
表1 兩組受試者人口學(xué)特征和神經(jīng)心理學(xué)量表評(píng)分比較
2.2 兩組齒狀核與全腦功能連接差異
與對(duì)照組相比,觀察組左側(cè)齒狀核與左側(cè)顳下回、右側(cè)丘腦功能連接增強(qiáng),右側(cè)齒狀核與左額葉、左顳上回均有功能連接顯著增強(qiáng),此外,在右側(cè)齒狀核和同側(cè)小腦后葉之間有一個(gè)功能連接增強(qiáng)區(qū)域。見表2。圖2顯示左側(cè)和右側(cè)齒狀核顯著變化的功能連接區(qū)域。
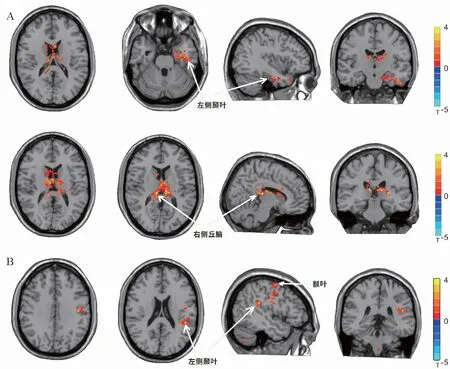
A:左側(cè)齒狀核功能連接差異圖;B:右側(cè)齒狀核功能連接差異圖;紅色表示觀察組齒狀核-腦功能連接性較對(duì)照組增強(qiáng)區(qū)域,藍(lán)色表示觀察組齒狀-腦功能連接性較對(duì)照組減弱區(qū)域,經(jīng)AlphaSim校正,P<0.05圖2 觀察組和對(duì)照組相比齒狀核功能連接差異圖
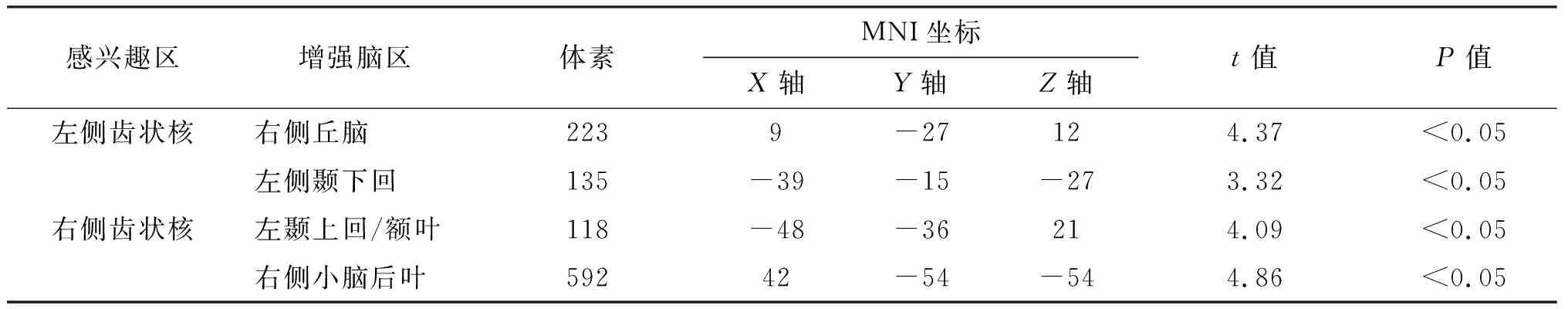
表2 觀察組雙側(cè)齒狀核功能連接顯著差異的區(qū)域
2.3 神經(jīng)心理學(xué)量表評(píng)分及腦脊液生物標(biāo)志物與功能連接差異區(qū)域的相關(guān)性
如圖3所示,MMSE評(píng)分與觀察組左側(cè)齒狀核和右側(cè)丘腦之間的功能連接值呈正相關(guān)(r=0.399,P=0.026),AVLT-再認(rèn)評(píng)分與右側(cè)齒狀核和左側(cè)顳上回之間的功能連接值呈負(fù)相關(guān)(r=-0.552,P=0.001)。VFT評(píng)分與觀察組左側(cè)齒狀核和右側(cè)丘腦的功能連接值呈正相關(guān)(r=0.383,P=0.025)。p-tau值與觀察組右側(cè)齒狀核和左側(cè)顳上回之間的功能連接值呈正相關(guān)(r=0.357,P=0.045),而Aβ1-42、Aβ1-40、t-tau值與功能連接差異腦區(qū)未發(fā)現(xiàn)顯著相關(guān)性(P均>0.05)。
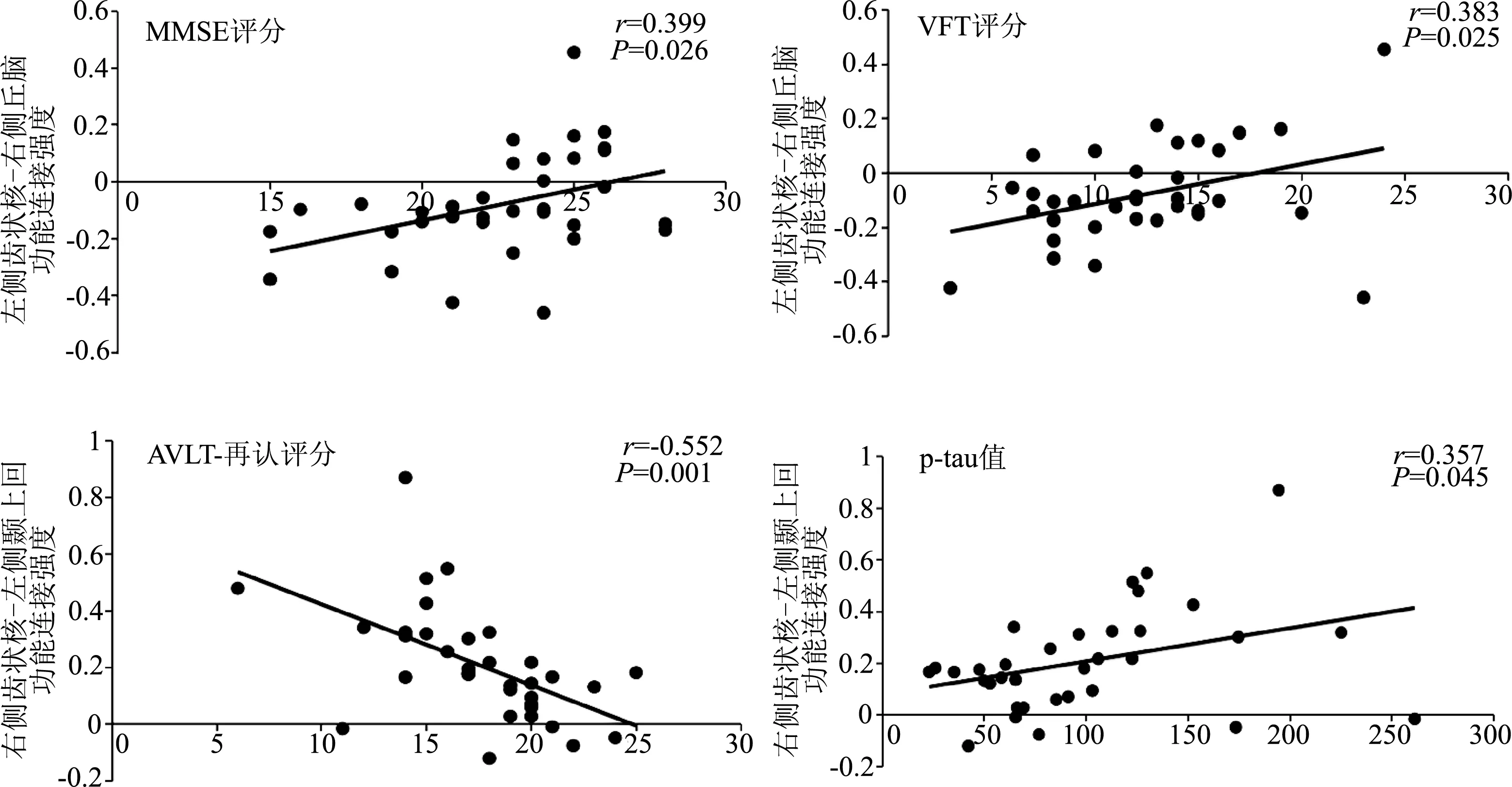
圖3 aMCI患者齒狀核功能連接差異腦區(qū)與認(rèn)知功能評(píng)分及生物標(biāo)志物水平之間的相關(guān)性
3 討論
AD是一種常見的神經(jīng)退行性疾病,以情景記憶障礙為最突出的臨床表現(xiàn),先前的研究主要在最易受到損傷內(nèi)側(cè)顳葉系統(tǒng)[7]。最近幾項(xiàng)關(guān)于AD小腦改變的神經(jīng)病理學(xué)和MRI研究發(fā)現(xiàn),小腦廣泛參與調(diào)節(jié)高級(jí)認(rèn)知功能[8-11]。齒狀核是最大的小腦核團(tuán),是位于小腦半球深層白質(zhì)中的一組興奮性神經(jīng)元,也是小腦與大腦進(jìn)行信息輸出的主要通道之一[12]。本研究結(jié)果發(fā)現(xiàn),相比于對(duì)照組,aMCI患者齒狀核功能連接存在異常增高,包括顳葉、丘腦和小腦后葉,且相關(guān)分析證實(shí)功能連接增強(qiáng)與認(rèn)知功能評(píng)分相關(guān)。
既往對(duì)于AD患者的齒狀核進(jìn)行功能連接特征的研究發(fā)現(xiàn),齒狀核與對(duì)側(cè)顳葉及枕葉區(qū)域存在選擇性功能連接增高特征[13],本研究結(jié)果與其一致;不同的是,本研究發(fā)現(xiàn)齒狀核與丘腦之間的功能連接也有增強(qiáng)現(xiàn)象。小腦與大腦之間的連接主要通過兩個(gè)環(huán)路,分別是小腦-丘腦-大腦環(huán)路以及小腦-腦橋-大腦環(huán)路[14],而齒狀核是兩條環(huán)路的重要位置,由此猜測(cè),齒狀核與丘腦之間的功能連接增強(qiáng)可能是一種代償機(jī)制。由于大腦神經(jīng)元損傷導(dǎo)致的連接減弱,小腦為代償激活了大腦-小腦環(huán)路以在AD患者臨床前期盡量維持其認(rèn)知水平。隨著疾病的發(fā)展,AD階段齒狀核與大腦功能連接增強(qiáng)區(qū)域較aMCI區(qū)域增多,這可能與疾病進(jìn)展有一定的關(guān)系。AD患者中最早受影響也是最嚴(yán)重的區(qū)域?yàn)閮?nèi)側(cè)顳葉系統(tǒng),隨著病情加重,皮層受累范圍更廣,aMCI階段萎縮不明顯,但海馬/內(nèi)嗅區(qū)與涉及記憶處理和大腦的特定新皮質(zhì)/皮質(zhì)下區(qū)域出現(xiàn)高連通性[15-16]。
小腦萎縮是散發(fā)性AD的另一個(gè)特征,最初影響與默認(rèn)模式網(wǎng)絡(luò)相連的部分小腦區(qū)域;默認(rèn)模式網(wǎng)絡(luò)是一組與認(rèn)知有關(guān)的高度相互作用的腦區(qū)(包括角回、顳中回、楔前和額背內(nèi)側(cè)前額葉皮質(zhì)),并受到神經(jīng)變性的廣泛影響[17-18],但在aMCI階段萎縮速度較AD緩慢[19]。人類小腦存在認(rèn)知控制的功能處理層次結(jié)構(gòu),自身包含一個(gè)平行但獨(dú)立的層級(jí)組織,特別是其后葉與背外側(cè)前額葉皮層共同支持復(fù)雜的認(rèn)知過程[20]。而AD小腦萎縮相對(duì)大腦稍晚,也具有與腦灰質(zhì)相一致的萎縮模式[10,21-22]。小腦后葉相對(duì)較早受累[8],這也與AD由認(rèn)知相關(guān)區(qū)域向非認(rèn)知相關(guān)區(qū)域萎縮模式相一致。本研究結(jié)果發(fā)現(xiàn),aMCI患者齒狀核與同側(cè)小腦后葉的功能連接較對(duì)照組增強(qiáng),可能代表一種針對(duì)認(rèn)知障礙發(fā)展的代償機(jī)制。
此外,本研究結(jié)果顯示,兩組間齒狀核和丘腦功能連接增強(qiáng)區(qū)域與MMSE評(píng)分及VFT評(píng)分呈弱相關(guān),可能原因首先是顳上回相較于丘腦,與高級(jí)認(rèn)知功能的關(guān)系更密切,其次可能因?yàn)檠芯繉?duì)象數(shù)量較少,存在部分混雜因素,有待于進(jìn)一步收集數(shù)據(jù)進(jìn)行分析。本研究結(jié)果證實(shí),齒狀核和丘腦的功能連接顯著差異區(qū)域與言語流暢性測(cè)試呈一定相關(guān)性。既往研究對(duì)健康者進(jìn)行言語任務(wù)態(tài)測(cè)試顯示,小腦后葉對(duì)言語有提取和序列的預(yù)測(cè)能力[23]。特別是小腦小葉Ⅵ/CRUⅠ,是言語工作記憶的關(guān)鍵調(diào)節(jié)部位[24]。不僅如此,小腦還在言語短期記憶、詞匯生成中起到不同的作用[25]。結(jié)合研究結(jié)果,本研究發(fā)現(xiàn)齒狀核功能連接顯著增強(qiáng)區(qū)域與患者記憶評(píng)分AVLT之間呈一定相關(guān)性,進(jìn)一步證明功能性過度連接是齒狀核和顳葉大腦區(qū)域之間功能相互作用改變的病理表現(xiàn),并且與認(rèn)知能力密切相關(guān)。
AD病理生理學(xué)沉積的兩種主要蛋白質(zhì)為淀粉樣蛋白(Aβ42,Aβ40)和tau蛋白,tau蛋白在內(nèi)側(cè)顳葉中的聚集是AD的第一階段,可以在Aβ存在下轉(zhuǎn)化和擴(kuò)散,與大腦萎縮、代謝不足和認(rèn)知損傷有關(guān)[26]。前期研究表明,AD臨床前階段的功能障礙主要發(fā)生在AD易感區(qū)域(如海馬、小腦Ⅵ/CRUⅠ、視皮層、額葉),后扣帶回皮質(zhì)與小腦之間的耦聯(lián)增強(qiáng)是功能代償?shù)膬?nèi)在機(jī)制,并且BA39-BA19的中心性與p-tau/Aβ42比值呈負(fù)相關(guān),與整個(gè)AD連續(xù)病程的記憶功能損害有關(guān)[7, 27]。本研究結(jié)果發(fā)現(xiàn),齒狀核功能連接區(qū)域增強(qiáng)與p-tau呈正相關(guān),進(jìn)一步證實(shí)AD臨床前期病理生理中功能補(bǔ)償?shù)纳窠?jīng)機(jī)制,但為弱相關(guān),后續(xù)將繼續(xù)擴(kuò)大樣本量以進(jìn)一步驗(yàn)證。
本研究有一定的局限性,首先只單獨(dú)分析了齒狀核功能連接的差異,未全面探究齒狀核在AD中的神經(jīng)影像學(xué)特征,后續(xù)將通過多模態(tài)神經(jīng)組學(xué)研究方法進(jìn)一步探究。其次,本研究采用橫斷面設(shè)計(jì),后期需要進(jìn)行縱向跟蹤以觀察aMCI進(jìn)展為AD過程中的腦網(wǎng)絡(luò)變化特征。
綜上所述,本研究應(yīng)用rs-fMRI 技術(shù)探究aMCI患者小腦齒狀核功能連接特征,主要表現(xiàn)在顳葉、丘腦及小腦后葉的連接增強(qiáng),并且功能連接改變與記憶及言語功能具有一定相關(guān)性,證實(shí)小腦參與aMCI患者的認(rèn)知調(diào)節(jié)過程,并具有一定的代償能力。此外,差異腦區(qū)功能連接強(qiáng)度與腦脊液生物標(biāo)志物中p-tau值具有一定相關(guān)性也表明小腦參與AD病程進(jìn)展。

