釓塞酸二鈉MRI增強預測HCC病理分級可行性的探討
唐晨程,王 鵬,劉有德,蔣 銳
肝細胞肝癌(hepatocellular carcinoma,HCC)是我國最好發的惡性腫瘤之一,其腫瘤進展快,惡性程度高,其發病率僅次于肺癌,病死率位居世界第一[2],男性發病率高于女性,由于該病早期缺乏相關體征,大多數人發現時已處于進展期,因此,對于該病的早期排查、治療對預后極為重要[3],近年來,隨著磁共振的普及和技術飛速的發展,已經成為了診斷HCC最重要的手段之一,釓塞酸二鈉(普美顯)成為常規造影劑之一,目前大部分學者將普美顯運用于病灶的鑒別診斷,少有人將其用于病理分級預測,本研究回顧性分析西部戰區總醫院于2017年3月~2020年5月收治經手術證實HCC的62例病例,測量、計算病灶平掃(T1WI)及肝膽期灰階值及灰階比值,分析腫瘤分化程度與增強后強化程度的關系,討論普美顯對預測病理分級的參考價值。
1 資料與方法
1.1 病例資料 收集醫院于2017年3月~2020年5月經手術病理證實原發性肝癌患者62例,回顧性分析其磁共振平掃加釓塞酸二鈉增強圖像。納入標準:(1)術后經病理證實為HCC;(2)檢查前未經過任何干預治療;(3)影像資料完整。排除標準:(1)合并其他惡性腫瘤;(2)有嚴重的血管性、代謝性及肝病患者。
1.2 檢查方法 使用西門子avanto1.5T磁共振,檢查前需常規禁食4~6 h,在專業掃描工作人員指導下行呼吸訓練,取仰臥位,掃描范圍為膈頂至肝下緣,包括整個肝臟,行冠狀位、橫斷位及矢狀位掃描,增強造影劑均為釓塞酸二鈉(普美顯,拜耳公司2017年1月~2020年3月批次),進行使用高壓注射器經肘靜脈注射,10 ml/次,流率:1 ml/s;獲得動脈期、門脈期、平衡期及肝膽期四期強化圖像,掃描序列為T1加權成像(T1WI)、T2加權成像(T2WI)、脂肪抑脂序列(FS)、彌散成像(DWI),抑脂增強T1C,參數如下:層厚均為6 mm,層間距20 mm;T1WI:激勵次數2;層數20;T2WI,激勵次數1:層數20;增強T1WI,激勵次數:1;層數20;延遲30 min掃描第四期肝膽期圖像。
1.3 影像分析 由兩名對該試驗不知情的放射科主治診斷醫師單獨分析、觀察病灶信號改變,并使用PACS系統測量病灶平掃期灰階值、肝膽期灰階值,測量時避開大血管、出血及大片壞死液化區,并分別計算高分化、中分化、低分化HCC的肝膽期強化灰階比值,計算公式為:肝膽期強化灰階比值=(肝膽期期灰階值-平掃期灰階值)/肝膽期灰階值[4]。
1.4 統計學方法 應用SPSS 25.0軟件進行數據分析,計數資料用例和百分率表示,組間差異采用χ2檢驗;計量資料以均值±標準差表示,組間差異采用單因素方差分析(F檢驗)。非正態分布資料采用非參數檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 HCC分組基本資料 根據納入及排除標準最終選擇的62例病例中,樣本均衡,組間年齡、性別等無顯著差異,其中男性病例43例,占總比例69%,女性病例19例,占總比31%例,年齡為19~73(51±15)歲;根據WHO肝癌病理分級分為3組,高分化20例,占總比例32%,中分化20例,占總比例32%,低分化22例,占總比例35%,基線資料比較無顯著差異(P>0.05),見表1。

表1 基線資料
2.2 HCC在T1WI、肝膽期影像表現 62例腫瘤肝膽期強化呈不同的信號改變,低分化HCC病灶肝膽期無信號5例,低信號16例,中等信號1例,中分化HCC病灶肝膽期低信號3例,低-中等信號16例,稍高信號1例,高分化HCC病灶內夾雜不規則片狀稍高信號15例,等信號3例,稍低信號2例。
2.3 MRI普美顯增強病灶強化灰階比值與病理分級關系 采用單因素方差分析不同分化程度之間的平掃期灰階值、特異性期灰階值、造影劑攝取程度,兩組間比較采用LSD檢驗,發現高分化腫瘤的造影劑攝取程度顯著高于中分化腫瘤、低分化腫瘤。本試驗結果低分化組肝膽期強化程度為0.06±0.03,中分化組肝膽期強化程度0.10±0.06,高分化期強化程度為0.16±0.06(P<0.05),三者之間均有顯著性差異,并且高分化組>中分化組>低分化組,其中高分化組均值比中分化組高0.06,中分化組均值比低分化組高0.04,見表2、圖1。
表2 肝膽期強化程度灰階比值及病灶病理分化程度比較(?s)

表2 肝膽期強化程度灰階比值及病灶病理分化程度比較(?s)
注: 與低分化腫瘤組比較,①P < 0.05;與中分化腫瘤比較,②P < 0.05
項目 低分化腫瘤(n=22) 中分化腫瘤(n=20) 高分化腫瘤(n=20) F P平掃期灰階值 299.55±6.35 223.45±8.70? 202.40±8.77?? 1011.176 <0.001肝膽期灰階值 318.50±10.35 249.25±13.76? 242.65±11.56? 264.280 <0.001強化程度程度灰階比值 0.06±0.03 0.10±0.06? 0.16±0.06?? 25.866 <0.001
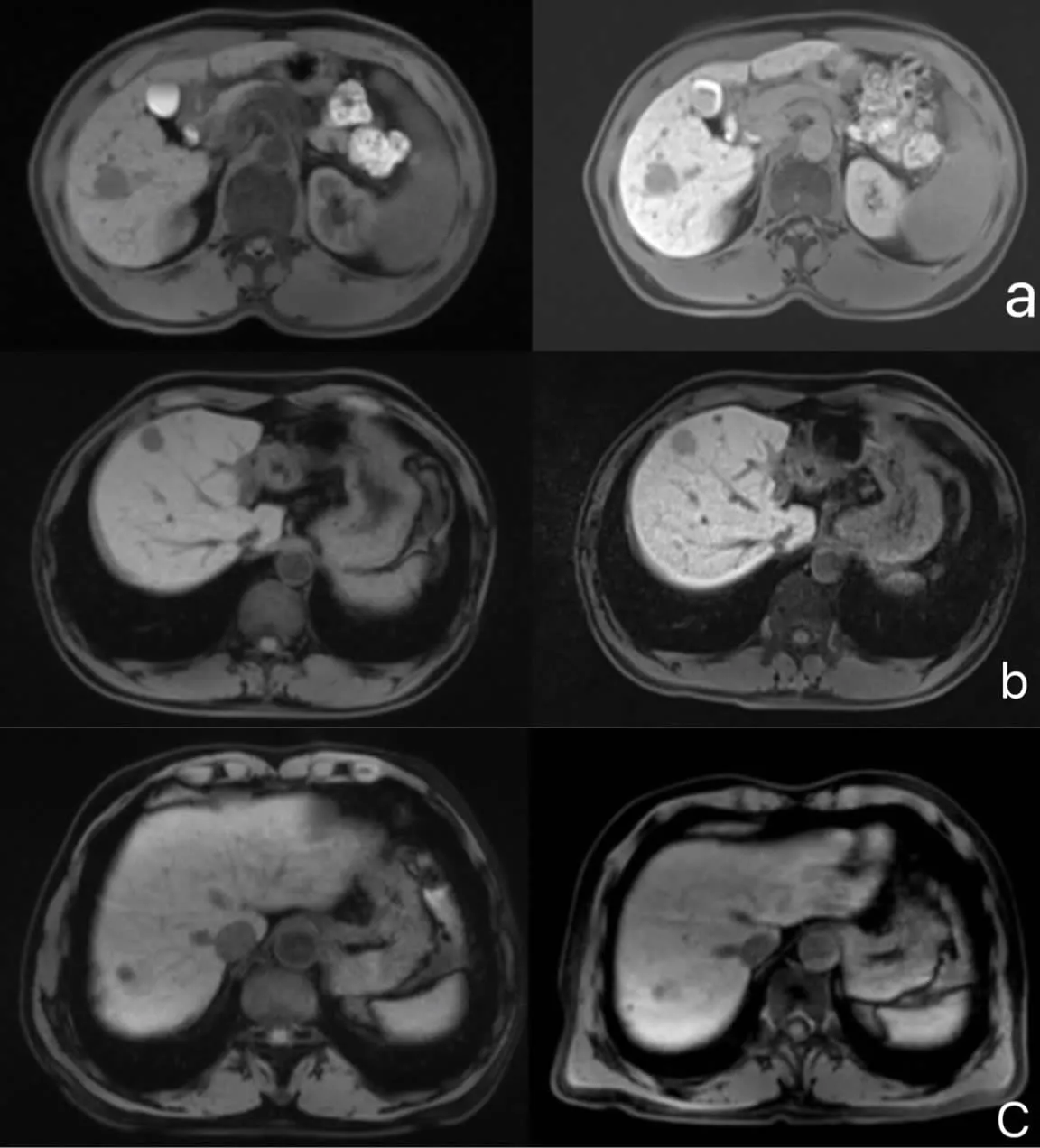
圖1 普美顯MRI典型影像
3 討論
HCC是高度惡性的腫瘤,確診方式目前依賴與穿刺及術后活檢等有創的方式,根據WHO肝臟腫瘤分級標準,即依照腫瘤細胞異型程度、HE染色切片結果等,將HCC病理分為高、中、低3級,在現階段的治療仍是以手術切除、介入等為主,但預后不佳[5],近幾年越來越多的學者開始研究以影像檢查來初步判斷腫瘤病理分級,通過影像學診斷提高預測腫瘤病理分級能力,對指導臨床治療方案有重大意義。
目前對于HCC檢查主要方法有超聲、CT及磁共振成像,磁共振的軟組織分辨率相對于CT更好,對于小肝癌的查出率更是高于CT,因此已經成為檢查HCC的重要手段之一,并可以反映組織多參數信息,包括病灶內的脂肪化、壞死、出血、囊變等都有更好的顯示,且沒有電離輻射損傷及有創傷口,可觀察腫瘤與周圍膽管、血管的細微關系,為臨床提供手術方針,本研究所使用掃描序列均為MRI基本序列,中小醫院配備的一般機器就能完成,可行性較高。
HCC肝膽期強化灰階比值代表病灶的強化程度[3],從表2結果不難看出,不同分化程度的HCC病灶肝膽期強化灰階比值存在明顯的組間差異,腫瘤分化程度越高比值越大(P<0.05),高分化組>中分化組>低分化組,也就是說,腫瘤分化程度越高,其病灶肝膽期強化程度灰階比值越高,是呈正比關系的,從統計結果看,P值均<0.05,存在明顯差異,提示對病理分級有提示作用。
使用的MRI造影劑為釓塞酸二鈉(普美顯),相對于其他肝臟造影劑來說,普美顯具有更高的特異性及更短的成像時間,以往需要近1 h才能達到造影劑最好效果,普美顯可在0.5 h左右達到顯影峰值。由于其特性及顯著的成像效果,目前其他學者大多使用該造影劑判斷其是否為HCC[6],少有人將其作為病理分級標準。
普美顯為一種特異性細胞外造影對比劑,具有較高T1馳豫效能,由于其含有EOB基團[7],由靜脈注射之后,分布在細胞間隙,由肝細胞吸收,最后經膽道排泄,因此肝膽期強化程度主要與肝細胞功能有關,肝細胞功能越接近于正常,則表現出明顯強化的高信號改變,相反,肝細胞功能明顯受損,則無法或僅能少量攝取造影劑,成低信號或無信號改變。由于腫瘤處于不同階段時,其腫瘤細胞異型不同,因此被造影劑吸收程度不一致,導致腫瘤的強化程度不同,當腫瘤處于較高分化時,其腫瘤異型性較低,部分細胞仍可攝取造影劑,因此在肝膽期有強化改變,而當腫瘤分化程度減低,細胞異型性增高,正常肝細胞的吞噬功能受損[8],導致無法攝取或僅能較少攝取造影劑,因此強化程度也隨之下降,在肝膽期上為低信號或者沒有信號改變,與郭天暢等[9]結果一致。目前,亦有部分學者從腫瘤新生血管角度研究其強化表現,當分化越低的腫瘤(低分化),其供血血管越少[10],腫瘤內部血管通透性下降[11],致使強化減低,分化較好的腫瘤則反之。本研究結果表明,分化程度越高的HCC,其后灰階比值越高,提示腫瘤強化程度越高,其結果與Tacher等[12]研究結果較為一致。
綜上所述,MRI普美顯增強T1WI及肝膽期強化程度與HCC病理分化程度存在相關性,灰階比值越高,分化程度越高,可以一定程度上預測HCC病理分級,本研究缺陷在于其相關性報道較少,現有的相關研究結果中也存在爭議,部分由于研究中納入樣本數目不多,因此,關于此項研究還需更多樣本并做更為深入的研究,為無創性評價腫瘤分化程度提供新思路及方向。

