改良有效的培養大鼠原代血管平滑肌細胞的方法
鄧惠堅 ,盧群 ,林轉娣 審校
(1.廣州市番禺區中心醫院;2.廣東藥科大學;3.廣州市番禺區中心醫院,廣州 番禺 511400)
高血壓是心腦血管疾病最重要的危險因素之一,長期的血壓升高促進動脈管壁發生彌漫性纖維性硬化,最終導致心、腦及腎等靶器官損害[1]。在動脈粥樣硬化的發生發展過程,VSMCs 參與了動脈壁生理功能和病理變化[2,3]。當血管內皮細胞功能受損后,內皮細胞合成及分泌的血管活性物質與細胞因子間的平衡會被破壞,導致白細胞黏附,誘導 VSMCs 發生表型轉化并遷移到內膜下[4]。活化的 VSMCs 大量增殖并攝取氧化型低密度脂蛋白形成泡沫細胞,大量泡沫細胞堆積會引發動脈粥樣硬化的形成及病理性內膜增厚[5,6]。高血壓、超重/肥胖和吸煙是導致AS 發生的主要三種危險因素,本實驗是利用的高血壓和導致肥胖的高脂飲食的危險因素促進AS 模型的快速構建,而動脈粥樣硬化形成的血管平滑肌細胞增強的增殖和遷移能力將有助于細胞培養。
1 材料與方法
1.1 材料
⑴實驗動物 10 周齡雄性SPF 級自發性高血壓大鼠和10 周齡的SD 大鼠各 12 只,體重(230±15)g,購自北京維通利華實驗動物技術有限公司。
⑵飼料 高脂高膽固醇飼料 (配方:4% 膽固醇,0.5% 膽酸鈉,0.2% 丙基硫氧嘧啶,10%豬油,5% 白糖,80.3% 普通飼料)。
⑶實驗儀器 超凈工作臺(SW-CJ-2F,蘇凈集團安泰公司)SHEL L/JB CO2培養箱 (Heraeus,德國)倒置熒光顯微鏡(Olympus,Tokyo,Japan)病理切片設備 全自動生化分析儀(美國亞培公司)。
⑷實驗試劑 胎牛血清(Gibco 公司) 青霉素和鏈霉素(吉諾生物有限公司)高糖培養基(Dulbecco's Modified Eagle Medium, DMEM, Gibco 公司)磷酸鹽緩沖液(Phosphate Buffered Saline, PBS) 4%多聚甲醛(廣州翔博) 4',6-二脒基-2-苯基吲哚染色液(4',6-diamidino-2-phenylindole, DAPI, 碧云天公司) 抗α 平滑肌肌動蛋白抗體 (alpha smooth muscle actin, α-SMA, Abcam) 熒光二抗 (R&D) 維生素D3 注射液 (上海通用藥業公司) 10% 水合氯醛(廣東藥科大學附屬第一醫院)
1.2 方法
⑴12 只 10 周齡自發性高血壓大鼠(雄性)。高脂高膽固醇飼料喂養3 周,在飼養開始時,每只大鼠予以 60 萬/U 維生素D3 腹腔注射,平均分 2 d注射完畢。同時SD 大鼠采取普通飼料喂養 3 周。
⑵3 周后大鼠稱重后通過用 10% 水合氯醛(300 mg/kg)腹腔注射麻醉,然后用 75% 醫用乙醇浸泡大鼠頸部以下的部位,消毒時間 2 min。接著操作者帶好無菌手套和穿好無菌隔離衣,在消毒操作臺用鑷子和剪刀采用“D”字形切口打開左側胸腔并分離出大鼠胸主動脈,立即放入含有 1%青霉素和鏈霉素的 4℃ 預冷的無菌PBS 溶液中,反復沖洗血管直至血管透亮。
⑶一部分血管用于轉移到 4% 多聚甲醛固定液中后行HE 染色后觀察血管內膜形態改變。另一部分血管放置于含20% 胎牛血清和 1% 青霉素、鏈霉素的DMEM 培養液中,用小剪刀縱向剖開血管并使內膜面朝上,用兩個眼科彎鑷背側攤平血管并輕輕搔刮血管內膜面,以便刮除血管內膜上的內皮細胞。接著,用兩個眼科彎鑷背側壓緊血管內膜面反向牽拉,使得內膜面中層組織撕裂,鑷子背側繼續輕輕剝離血管中層組織并充分剔除外膜組織。將取好的中層組織置入小離心管內,眼科小剪刀將組織剪成約1mm3的組織粒。用移液槍吸干組織粒間的水分后并將剪碎的組織塊均勻貼放于25cm2培養瓶底,組織粒間距約 0.2~0.3cm。最后把培養瓶置于直立或者倒立狀態,并向瓶內加入2~3ml 含 20% 胎牛血清和 1% 青霉素、 鏈霉素的DMEM 培養液,置于 37℃、5% CO2培養箱中,繼續保持直立或倒立狀態保持 1.5~3h,根據組織塊與瓶壁牢固貼附情況調整時間。后輕輕地翻轉培養瓶使組織塊浸沒于培養液中。
⑷培養瓶靜置培養箱 3d 后取出觀察,用含20% 胎牛血清和 1% 青霉素、鏈霉素的DMEM 培養液以保留原培養基量的 1/2~1/3 方式來換液處理。約 5~7d 后在顯微鏡下可見細胞從組織塊邊緣爬出,往后約 2d 換液 1 次,具體可以根據培養基的顏色變化調整換液時間。
⑸傳代培養: 當組織粒間的細胞生長匯合達80% 以上時可進行第一次傳代處理,在超凈工作臺中用常溫無菌的PBS 溶液沖洗組織粒使之脫落,再加入 0.125% 胰酶混合消化液 2ml。室溫下消化約1min 后置于顯微鏡下觀察,當發現細胞回縮、間隙增大并有少數細胞脫落時,直接加入 2ml的20%胎牛血清的DMEM 培養液來終止消化,移液槍吹打瓶壁細胞使之脫落混勻并制成單細胞懸液,然后將細胞懸液轉移至 5ml 的無菌離心管,離心管密封后于臺式離心機 1000r/min 的參數下離心5 min 后超凈工作臺中吸去上清液,接著加入含20% 胎牛血清的DMEM 培養液后混勻并制成單細胞懸液,以 1:3 原則接種傳代,細胞個數控制在約 1×106個/ml。將傳代的培養瓶做好標志后放入37℃、5% 的 CO2培養箱中培養,約 3 d 可長滿。建議前 3 代的平滑肌細胞培養選用含 20% 胎牛血清的DMEM 培養液,往后的細胞可選用含 10% 胎牛血清的DMEM 培養液。
⑹通過在倒置相差顯微鏡下觀察并拍照記錄平滑肌細胞的生長特點、大小、形態及排列方式等。
⑺平滑肌細胞鑒定: 本次實驗用免疫熒光化學法對第 3 代血管平滑肌細胞進行鑒定,將制好的細胞懸液注入到預先放置蓋玻片的 6 孔板中,待細胞生長匯合達 80% 以上時,吸去孔板中的培養液后加入適量的 4% 多聚甲醛,并置于室溫下固定 20~30 min,用PBS 漂洗蓋玻片 3 次,每次時間約 5 min。然后用 1 % TritonX-100 通透細胞膜處理,時間20~30 min。接著再加入山羊血清覆蓋蓋玻片并置于 37℃ 下封閉處理,時間 60 min。封閉結束后用PBS 漂洗蓋玻片 3 次,每次時間約 5 min。加入一抗(α-SMA 1:200) 稀釋液孵育并置于4℃ 冰箱過夜。隔天再用PBS 漂洗蓋玻片 3 次,每次時間約 5 min。暗室內加入FITC 標記的山羊抗鼠抗體稀釋液孵育蓋玻片,繼續置于室溫下暗室60 min。孵育結束后PBS 液繼續漂洗 3 次,每次時間 5 min。最后加入含 1 μg/ml 的 DAPI 的 PBS 稀釋液暗室下繼續孵育 10 min,用PBS 液充分沖洗蓋玻片,甘油封片后在倒置熒光顯微鏡下觀察并攝片記錄。
2 結果
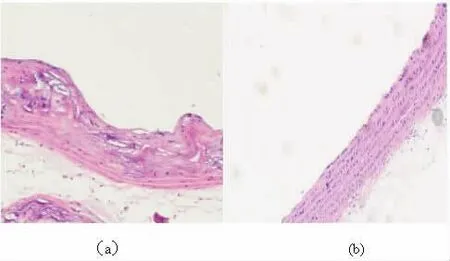
⑴圖a 中高倍顯微鏡鏡下(100 x)可見自發性高血壓大鼠胸主動脈內膜有不同程度的內皮細胞脫落,且血管中層組織可見平滑肌細胞大量增殖和遷移導致內膜動脈病理性增生。見圖 b 中高倍顯微鏡鏡下(100 x)SD 大鼠動脈內膜未見增厚,且血管內膜下內皮細胞排列整齊。
⑵原代血管平滑肌細胞的鑒定結果。低倍鏡下(40 x)可見平滑肌細胞呈典型的峰谷樣生長形態(如圖A),高倍鏡下(100 x)觀察到細胞長梭形樣的生長形態,見圖B。圖C 顯示是熒光顯微鏡下的平滑肌細胞,顯色為綠色是平滑肌細胞細胞質中的肌動蛋白,藍色的是平滑肌細胞的細胞核。本實驗成功獲取大鼠的原代血管平滑肌細胞。見圖D 顯示是本次實驗的雜細胞-血管內皮細胞。

⑶兩組大鼠原代血管平滑肌細胞的數據對比。
3 討論
在高血壓大鼠動物研究中發現,大鼠體內的動脈的內膜厚度較正常大鼠明顯增厚,其機制可能與高血壓改變血管平滑肌細胞的表型狀態有關[7,8]。本實驗選用自發性高血壓大鼠與SD 大鼠血管培養血管平滑肌細胞,結果顯示自發性高血壓大鼠實驗組大鼠組細胞生長速度更快,而且細胞生長狀態良好。內膜下的脂質沉積也是AS 的基礎病變之一,可以通過誘導大量炎性細胞浸潤促進內膜灶狀纖維化及粥樣斑塊形成[9,10]。研究發現大劑量的維生素D3 可以通過損傷血管內皮細胞促進血管鈣化從而導致動脈粥樣硬化形成[11]。本次研究我們采用腹腔注射大劑量的維生素D3 來達到損傷血管的內皮細胞,然后喂養3 周的高脂高膽固醇飼料,通過病理切片我們可以看到有效快速地建立起動脈粥樣硬化模型。本實驗結果顯示自發性高血壓大鼠血管培養出的平滑肌細胞純度更高,避免了內皮細胞的生長干預了平滑肌細胞培養。本實驗首次比較動脈粥樣硬化形成自發性高血壓大鼠與SD 大鼠胸主動脈平滑肌細胞貼壁培養的生長狀態,結果顯示選取動脈粥樣硬化形成的自發性高血壓大鼠更容易培養出純度更高的原代血管平滑肌細胞。

表1
在培養原代大鼠血管平滑肌細胞過程中往往涉及很多細節,以下總結幾點:⑴相對無菌的操作過程是成功的基礎;包括使用大鼠解剖前的消毒、器械的高壓滅菌、超凈工作臺的準備、帶有雙抗的漂洗液、 無菌手套的使用等等。⑵操作時間的控制;血管是一個離體組織,整個血管中層組織的提取時間盡量控制在30~60min 內,前期的研究基礎顯示少于30min 的時間使得細胞的成功率更高。⑶血管活性的保持; 本次實驗過程用到的漂洗液或者浸泡液要在 4℃ 冰箱預冷,操作工程盡量在預先準備好的冰袋上進行。⑷培養基的營養支持;細胞因子與活性物質是血管平滑肌細胞增殖與遷移的啟動因子。因此,培養基必須要選用好的新鮮的血清或者加入血小板源性生長因子(platelet-derived growth factor-BB, PDGF-BB)[12]。這里推薦使用新鮮的澳洲胎牛血清,血清盡量在解凍后1 月內用完,最好當天解凍后使用。⑸組織的處理;要用鑷子輕輕刮血管內膜面及充分剔除血管外膜,避免后期的雜細胞的產生;將中膜層血管組織轉移到小離心管內,可以快速充分剪碎組織粒,并且建議用微量的無菌移液槍將組織粒水分吸干以便縮短貼壁時間。⑹第一次換液的時間;培養箱中靜置培養3~4 d 后,必須行第一次換液處理,以保留原培養基 1/2~1/3 量的方式來進行換液。一方面補充損耗的營養物質,另一方面保留部分原有的血管活性物質和細胞因子。

