急性Stanford B型主動脈夾層真腔次全閉塞治療
——單中心病例系列報道
方志勇, 王 慶, 歐陽尚, 田壯博, 谷 鵬, 向 華, 向 斌
血管破裂并非急性主動脈夾層(aortic dissection,AD)唯一的致死原因,臟器灌注不良引起的高病死率同樣值得關注。早期研究表明Standford B型AD伴發截癱患者病死率為100%,伴發腦卒中患者病死率為67%,發生腎臟和腸道缺血患者病死率為50%~90%,并發下肢缺血患者病死率約為33%[1-2]。Uchida等[3]研究認為AD繼發臟器灌注不良的主要發生機制可歸納為胸腹主動脈處血管真腔受壓造成的臟器缺血(Ao型缺血),AD撕裂累及某臟器血管造成受累血管真腔被假腔所壓迫引起的缺血(Br型缺血)。Ao型缺血往往由于發病過程急驟,缺血病變范圍廣泛,側支循環代償不良等原因造成較高的致死率和致殘率。2016年1月至2019年12月湖南省人民醫院共收治39例急性B型AD真腔次全閉塞患者,現分享診療經驗如下。
1 材料與方法
1.1 一般資料
本組39例急性AD患者。男∶女為30∶9,年齡26~78歲,平均(47±21)歲,發病時間3 h至21 d。胸背部疼痛21例,胸腹痛12例,腹痛6例,伴有下肢疼痛、麻木、乏力等不同癥狀17例。既往有高血壓37例,冠心病10例,糖尿病12例。39例患者術前均接受主動脈CTA評估,近端破口均位于胸主動脈或主動脈弓部,遠端破口多位于腹主動脈區和髂動脈區,均表現為胸降主動脈真腔線樣征或閉塞。缺血灌注不良的受累臟器中雙下肢均受累8例,單側肢體受累9例;腹腔干或腸系膜上動脈受累12例,腎動脈受累18例。
1.2 手術方法
39例患者均接受主動脈覆膜支架腔內隔絕術,術中根據近端破口位置決定是否同時行左頸動脈或左鎖骨下動脈重建修復(含支架開窗、煙囪支架)[4]。主動脈覆膜支架經單側股動脈植入,根據第1枚支架植入后病變段血流恢復情況決定是否同期行胸主動脈、腹主動脈、腸系膜上動脈、腎動脈或髂動脈支架成形術。對于腸道、腎臟和下肢嚴重缺血患者,術后行二次腔內治療、血液透析,以糾正病因和預防再灌注損傷。
2 結果
39例患者共植入主動脈覆膜支架51枚(植入1枚27例,2枚12例),支架總長180~270 mm,平均(200.4±57.6)mm,支架遠端AD真腔直徑、面積放大率分別為10.4%、44.0%;同時植入腹主動脈裸支架3枚,腸系膜上動脈支架8枚,髂動脈支架12枚,頸動脈原位開窗或煙囪支架9枚,鎖骨下動脈開窗或煙囪支架枚17枚。介入治療技術成功率為100%。典型患者治療前后影像見圖1。圍手術期并發癥:腎功能不全15例(38.5%,其中2例死亡),予以連續性血濾治療;一側腎動脈完全假腔供血5例,遂接受覆膜支架開通;中重度腸道缺血表現8例(20.5%),其中6例接受二次腔內治療,1例保守治療后好轉,1例出現腹膜刺激征行開腹手術,術后死于酸中毒和多臟器衰竭。17例伴有下肢癥狀患者中共植入支架12枚(5例植入2枚)。圍手術期死亡率為7.7%(3/39),死因主要為重度腎功能不全、酸中毒和多臟器衰竭。
術后隨訪6~25個月,平均(13.6±7.6)個月。5例失訪,失訪率13.9%(5/36)。隨訪內容包括癥狀改善情況、移植物位置和形態、假腔直徑和血栓變化。完成隨訪患者隨訪期無新發死亡,無腦卒中、腸壞死、截癱和截肢等新發并發癥,10例腎功能不全指標明顯改善。影像學無新發夾層和臟器灌注不良征象,支架段假腔完全血栓化率為80.6%(25/31),其中支架段主動脈完全重塑率為68%(17/25),多數患者夾層遠端還存在不同程度的破口或假腔。
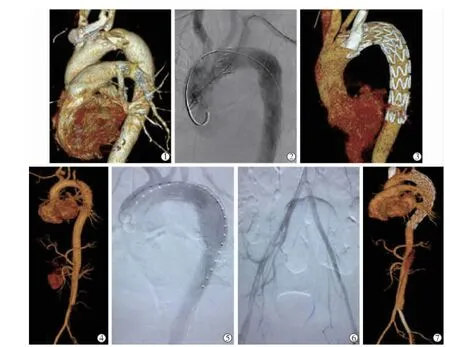
圖1 典型患者急性Standford B型AD真腔次全閉塞治療前后影像
3 討論
近年腔內技術和器材快速發展,推動了AD治療從巨創向微創轉變。伴隨著對AD認識不斷深化,粗放型治療理念正逐漸向精細化和個體化方向進步。對于復雜性AD,在治療理念和技術細節上仍存在較多爭議,臟器灌注不良的特殊病況是其中之一。本研究主要針對臟器灌注不良中的Ao型缺血,在治療時機、方案理念和技術細節等方面進行單中心經驗總結與分析。
在治療時機上,有meta分析結果提示急性Standford B型AD圍手術期病死率是慢性AD的3倍,并發癥發生率是慢性AD的2倍[5-6]。由于急性期AD患者主動脈內膜和外膜均處于炎性反應的活躍不穩定狀態,并不如慢性期纖維機化內膜層更能適應植入支架的徑向支撐力,因此部分專家推薦認為對急性AD患者適合2周后行腔內修復術,彼時病變的主動脈血流動力學更趨穩定,手術并發癥更少,術后血管重塑更佳[7-8]。但是對于真腔次全閉塞、Ao型缺血的B型AD患者,本研究與部分專家的意見相同,認為治療時間窗越短,患者預后或許會更好[9]。因為該型AD進展較為迅速,缺血臟器面積大,側支循環代償差,預后往往不良,盡快手術開通閉塞的主動脈真腔,恢復真腔和分支血管正向灌注壓,將使患者獲益最大化。
在方案理念上,B型AD經典方案,即是將支架移植物近端錨定于第1破口近心端正常管壁,遠端留置于AD動脈真腔,以達到隔絕破口、恢復真腔血流、誘導假腔血栓形成的目的。多數B型AD患者在近端植入1枚支架后,遠端真腔會恢復至幾乎正常管徑,但對于真腔次全閉塞的Ao型缺血患者,由于術前即存在假腔內灌注壓過大,甚至真腔閉塞繼發血栓等問題,即使近端長支架仍存在徑向支撐力不足的可能,支架遠端真腔開放不全和內臟器官持續灌注不良的問題依然存在。此外,急性期真腔次全閉塞AD患者近端破口一般較大,嚴重撕裂的內膜較為脆弱,且力學作用更為復雜,置于彎曲主動脈內的近端支架自身彈性回直勢能仍是不可忽視的并發癥因素。即使目前在支架設計上已考慮到血管管徑錐度的影響,但10%~15%漸細的遠端支架相對于胸主動脈遠端完全閉塞的管腔仍顯巨大,這也是造成遠端新發破口的潛在原因之一[10]。結合本研究的臨床療效,對于Ao型缺血的B型AD,尤其是超過2周患者,兩段式支架或許可作為優選策略。兩段式支架不僅能緩解被假腔過度壓縮的血管,起到加固動脈壁的作用,而且可限制支架過度擴張并降低彈性回直勢能,減少支架對脆弱內膜的損傷;同時最大限度恢復真腔管徑,也有利于降低假腔壓力并促進血管重塑[11]。當前各家中心應用兩段式支架的方案大概有兩種,一種為2枚覆膜支架,另一種是近端覆膜支架遠端裸支架[12-14]。本研究更推薦后者,原因一方面擔心遠端覆膜支架會遮擋過多肋間動脈,增加截癱風險,另一方面考慮到真腔次全閉塞的AD遠端破口多位于膈肌以下腹主動脈內臟區或髂動脈,如果降主動脈段存在遠端破口,反而可有效降低假腔壓力,不易出現假腔壓迫真腔所致次全閉塞狀況。目前部分公司已有上市或臨床試驗支架(近端覆膜支架,遠端裸支架),還有設計為遠端網孔狀覆膜支架,一定程度上解決了真腔支撐和維持肋間動脈灌注的兩難問題。
在技術細節上,針對次全閉塞的Ao型AD,要強調近端封堵全,遠端支撐足的要點。近端要封堵全,即Ao型AD往往近端破口流量較大,如果遠端未出現相應破口,假腔壓力無法得到較好釋放,真腔過度壓迫而閉塞,因此近端完全封堵第1破口是恢復遠端閉塞段壓力的關鍵。為了徹底封堵近端較大的破口,錨定區必要的延長也是不得已選擇。對早期病例,本研究甚至通常需要封堵左鎖骨下動脈,術后根據上肢和椎動脈竊血程度選擇是否二期手術。后期術中左鎖骨下動脈原位開窗或預開窗技術較好地解決了左鎖骨下動脈重建問題[15]。國產單分支支架也是一種很好選擇,但該支架系統需要在降主動脈段推送支架和左鎖骨下動脈牽張導絲的操作,會增加閉塞區內膜損傷和支架移位風險,需要較為熟練的術者配合應用。結合文獻報道,遠端真腔支撐要充足,對腹腔真腔閉塞段不能完全開通者可行腹主動脈裸支架植入,對伴有Br型內臟動脈或下肢缺血患者還需同時重建分支血管[16-17]。本研究對有些患者予一期重建,對部分患者視術后病情進展行二期重建,重建時機需根據個體化治療方案。
臨床實踐中閉塞真腔開通的難點在于如何判斷真腔。尤其是對于多發破口患者,導絲可能在髂動脈或腹主動脈即進入假腔,判斷失誤導致支架釋放于假腔將是災難性后果。無論是從AD累及側還是未受累側股動脈入路,最重要是結合術前CT、術中多次造影進行判斷,推薦在髂動脈分叉、腹主動脈內臟區、降主動脈肋間區和主動脈弓,均要用豬尾導管反復確認。此外,部分學者建議當難以逆行開通閉塞主動脈時,上肢入路順行真腔開通也是可選方案[17-18]。但事實上,面對不同患者需要考慮主動脈弓形的影響,而且由于胸段真腔近閉塞,弓部高壓血流很容易將上肢順行導絲沖入巨大的近端破口而誤入假腔。本組5例患者經鎖骨下動脈順行真腔下行至股動脈建立導絲路徑,其中2例由右鎖骨下動脈超選入AD真腔至遠端抓捕下肢入路導絲至升主動脈。
總之,真腔次全閉塞的Ao型灌注不良AD病情兇險,一旦確診應盡快手術干預,否則容易出現多發性靶臟器即時缺血受損。若超過治療時間窗,即使再次開通灌注,也面臨腎功能不全、腸壞死、酸中毒和骨筋膜室綜合征等再灌注損傷,導致功能難以恢復。腔內開通過程需要多種技巧,基于單中心經驗,部分患者兩段式支架應用有利于真腔開通,降低假腔壓力,促進血管重塑。

