基于轉錄組學探討益腎降濁湯對環孢素A腎毒性的作用及機制※
●鄭登勇 阮杏林 王建挺 丘余良 阮詩瑋▲
環孢素A(cyclosporine A,CsA)目前廣泛用于治療實體器官移植及自身免疫性疾病,顯著延長了移植器官的存活時間和患者的生命,但CsA的急慢性腎毒性制約其臨床應用[1]。急性腎毒性與CsA損傷血管內皮細胞,導致腎血管收縮,腎臟血流灌注不足,腎小球濾過率下降有關;慢性腎毒性與CsA上調轉化生長因子-β(TGF-β),引起腎小管上皮細胞轉分化、腎間質纖維化有關[2]。目前尚無肯定的可應用于臨床的減輕CsA腎毒性的藥物[3]。
中醫認為,環孢素A 腎損傷系藥毒傷腎,導致脾腎虧虛為本,濕濁血瘀為標[1,4]。益腎降濁湯系福建省名中醫阮詩瑋教授治療慢性腎功能衰竭的經驗方,臨床已使用30 余年,療效良好。益腎降濁湯“益腎健脾、降濁化瘀”之功效契合環孢素A腎損傷的病機,故課題檢測益腎降濁湯對環孢素A誘導HK-2細胞損傷細胞活力的影響。鑒于中藥復方成分復雜以及作用的多靶點,機制研究采用轉錄組測序(transcriptome sequencing,RNA-seq)技術分析益腎降濁湯治療CsA 誘導HK-2 細胞損傷的差異表達基因,探討益腎降濁湯減輕CsA腎毒性的可能靶點。
1 實驗材料
1.1 實驗細胞HK-2 細胞株(購自中國科學院細胞庫)。
1.2 益腎降濁湯益腎降濁湯由太子參15 g、生黃芪30 g、生白術15 g、茯苓15 g、槲寄生15 g、懷牛膝15 g、桑椹15 g、丹參30 g、當歸10 g、大黃9 g、六月雪15 g、車前子15 g、陳皮10 g 組成,所有中藥飲片購自福建中醫藥大學附屬人民醫院中藥房。濃煎為1.0 g/mL。YSJZT 用0.22 μm 無菌濾器過濾,分裝放置-80 ℃冰箱保存備用。
1.3 主要試劑及儀器環孢素軟膠囊(新山地明,批準文號J20140116,諾華制藥)。Cell Count Kit-8(CCK-8)試劑(Cat:M4839-500Tests,Abmole BioScience)。胎牛血清(gibco 10099-141C);DME/F12 Medium(hyclone SH30023.01B);青霉素-鏈霉素(雙抗)(100X)(hyclone SV30010);TRYPSIN 0.25%(1X)Solution(hyclone SH30042.01);TRIzol(上海生工B511311)。熒光相差倒置顯微鏡(NIKON ? ECLIPSE Ts2R-FL);二氧化碳培養箱(SANYO MCO-15AC)。
2 實驗方法
2.1 細胞培養HK-2細胞株在DME/F12培養基(含10%胎牛血清及1%雙抗)中培養,于37 ℃、5%CO2培養箱中培養。
2.2 益腎降濁湯對HK-2細胞活力的影響取對數生長期的HK-2細胞,按5×103個細胞/孔接種于96 孔板中(100 μl/孔),每組5 個復孔,放入培養箱內培養24 h 后更換培養液。給予各濃度益腎降濁湯的培養液(0.125 mg/mL、0.25 mg/mL、0.5 mg/mL、1 mg/mL、2 mg/mL、4 mg/mL),同時設置正常對照和空白對照組(僅有培養基無細胞),置于培養箱內孵育48 h。各組干預完成后,每孔分別加入10 μlCCK-8試劑,孵育2 h后酶標儀檢測450 nm處光密度值(OD值)。根據所測OD 值計算細胞活力(%)=(YSJZT 組-空白對照組)/(正常對照組-空白對照組)×100%。
2.3 CsA 對HK-2 細胞活力的影響取對數生長期的HK-2 細胞,按5×103個細胞/孔接種于96 孔板中(100 μl/孔),每組5 個復孔,放入培養箱內培養24 h后更換培養液。用環孢素A 軟膠囊CsA 原液直接稀釋在培養基,給予各濃度的CsA 培養液(4.2 μmol/L、8.4 μmol/L、12.6 μmol/L、16.8 μmol/L、21 μmol/L、42 μmol/L),同時設置正常對照和空白對照組(僅有培養基無細胞),置于培養箱內孵育24 h后更換為正常培養液繼續孵育24 h。各組干預完成后,每孔分別加入10 μlCCK-8 試劑,孵育2 h 后酶標儀檢測450 nm 處OD值。根據所測OD值計算細胞活力(%)=(CsA組-空白對照組)/(正常對照組-空白對照組)×100%。
2.4 益腎降濁湯對環孢素A誘導HK-2細胞損傷細胞活力的影響取對數生長期的HK-2細胞,按5×103個細胞/孔接種于96 孔板中(100 μl/孔),每組5 個復孔,放入培養箱內培養24 h 后更換培養液。根據CCK-8檢測各濃度YSJZT和CsA影響HK-2細胞活力的結果,選擇合理的CsA 濃度誘導HK-2 細胞損傷模型,孵育24 h后更換為正常培養液繼續孵育24 h。并選擇合理的YSJZT濃度干預CsA誘導HK-2細胞損傷模型48 h。同時設置正常對照和空白對照組(僅有培養基無細胞)。各組干預完成后,每孔分別加入10 μl CCK-8試劑,孵育2 h后酶標儀檢測450 nm處OD值。根據所測OD值計算細胞活力(%)=(CsA組或者YSJZT組-空白對照組)/(正常對照組-空白對照組)×100%。
2.5 細胞形態學改變選擇對數生長期的HK-2 細胞按105個/孔種入6孔板(2 mL/孔)。分3組:正常對照組(NC 組)、模型組(C 組,CsA 16.8 μmol/L)和治療組(T組,YSJZT 0.5 mg/mL+CsA 16.8 μmol/L),藥物濃度根據“2.3”和“2.4”CCK8 檢測結果選擇,干預措施同“2.4”。各組干預完成后,相差顯微鏡下(200×)觀察各組細胞形態改變。
2.6 轉錄組測序選擇對數生長期的HK-2 細胞按105個/孔種入6 孔板(2 mL/孔)。分為NC 組、C 組(CsA 16.8 μmol/L)和T 組(YSJZT 0.5 mg/mL+CsA 16.8 μmol/L),YSJZT對CsA誘導HK-2細胞損傷模型干預措施同“2.4”。各組干預完成后,采用Trizol 法提取HK-2 細胞總RNA,Agilent 2100 進行RNA 定量及質檢。構建單鏈環狀DNA 文庫,文庫質檢合格后通過DNBSEQ 測序平臺進行測序。由深圳華大基因股份有限公司完成。
2.7 差異表達基因篩選及交集DEG 功能富集分析采用DESeq進行比對組間顯著差異基因分析,篩選比對組間差異表達基因,顯著差異表達基因篩選條件為:|log2(fold change)|≥1;且Qvalue<0.05。利用基因本體(Gene Ontology,GO)數據庫和京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)數據庫,對交集的DEG進行GO功能與信號通路富集分析,以校正P<0.05為顯著性閾值。
2.8 統計學方法采用Graphpad prism 8.0軟件進行分析,實驗數據中的計量資料以均數±標準差(±s)表示,多組間比較采用One-Way ANOVA 分析,P<0.05表示差異有統計學意義。
3 結果
3.1 益腎降濁湯對HK-2細胞活力的影響各濃度YSJZT 處理48 h 后,0.125 mg/mL、0.25 mg/mL、0.5 mg/mL 對HK-2 細胞活力無明顯抑制,各組細胞活力分別為(103.20±1.98)%、(99.15±2.19)%、(97.42±3.58)%;1 mg/mL、2 mg/mL、4 mg/mL對HK-2細胞活力有統計學意義的抑制作用,各組細胞活力分別為(91.07±4.59)%、(89.45±1.70)%、(92.49±1.99)%。結果見圖1a。所以后續實驗選擇YSJZT 0.125 mg/mL、0.25 mg/mL、0.5 mg/mL 三個濃度。
3.2 CsA 對HK-2 細胞活力的影響經過各濃度CsA處理24 h后,撤掉CsA繼續培養24 h,4.2 μmol/L、8.4 μmol/L 對HK-2 細胞活力無抑制,各組細胞活力分別為(96.96±4.52)%、(88.36±6.24)%;12.6 μmol/L、16.8 μmol/L、21 μmol/L、42 μmol/L 對HK-2 細胞活力均有統計學意義的抑制,各組細胞活力分別為(84.18±7.36)%、(81.34±9.47)%、(28.68±13.97)%、(0.33±0.21)%。結果見圖1b。所以后續實驗選擇CsA 16.8 μmol/L誘導HK-2細胞損傷模型。
3.3 益腎降濁湯對CsA誘導HK-2細胞損傷細胞活力的影響與NC 組比較,CsA 16.8 μmol/L 模型組HK-2 細胞活力顯著降低,其細胞活力為(76.48±3.16)%;與模型組比較,YSJZT 0.125 mg/mL、0.25 mg/mL、0.5 mg/mL治療后HK-2細胞活力明顯提升,各組的細胞活力分別為(86.59±10.10)%、(87.64±5.91)%、(89.70±5.15)%。結果見圖1c。根據不同濃度YSJZT對CsA 誘導HK-2 損傷細胞活力的恢復情況,故課題后續實驗選擇YSJZT 0.5 mg/mL對模型進行干預。
3.4 益腎降濁湯對CsA誘導HK-2細胞損傷形態的影響NC 組細胞形態正常;C 組為CsA 誘導HK-2 細胞損傷模型組,相差顯微鏡下HK-2 細胞內發現大量大小不等的空泡及部分鈣化點;T 組為益腎降濁湯治療組,HK-2細胞內空泡及鈣化改善不明顯。見圖2。

圖1 益腎降濁湯對CsA誘導HK-2細胞損傷細胞活力的影響

圖2 相差顯微鏡下觀察益腎降濁湯對環孢素A誘導HK-2細胞損傷形態的影響(200×)
3.5 各比對組間差異表達基因情況RNA-seq測序結果發現,C 組與NC 組比對得到顯著差異表達基因1410個(其中上調基因812個、下調基因598個),見圖3a 和圖3b。T 組與C 組比對得到顯著差異表達基因127 個(其中上調基因71 個、下調基因56 個),見圖4a和圖4b。為明確YSJZT 減輕CsA 腎毒性的主要靶基因,將T 組比對C 組上調DEG 交集C 組比對NC 組下調DEG,得到36 個DEG;將T 組比對C 組下調DEG 交集C 組比對NC 組上調DEG,得到30 個DEG,見圖5a和圖5b。

圖3 模型組比對正常對照組差異表達基因柱狀圖及火山圖

圖4 益腎降濁湯治療組比對模型組差異表達基因柱狀圖及火山圖
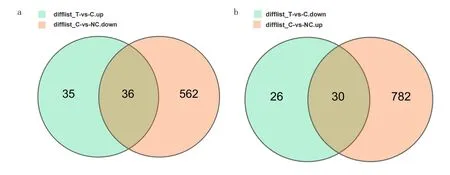
圖5 不同比對組間交集基因韋恩圖
3.6 差異表達基因GO 功能富集分析交集得到的66 個DEG 進行GO 功能富集分析,從細胞組分(cellular component)、生物過程(biological process)和分子功能(Molecular Function)三大功能類別中各選取富集最顯著的10個GO term繪制柱狀圖。通過GO功能富集分析可看出益腎降濁湯治療后顯著回調的差異基因功能主要集中在生物學過程中的雌激素代謝過程(estrogen metabolic process)、表皮生長因子受體信號通路(epidermal growth factor receptor signaling pathway,EGFR)、視黃醇代謝過程(retinol metabolic process);分子功能中的雌激素酮磺基轉移酶活性(estrone sulfotransferase activity)、粒細胞巨噬細胞集落刺激因子受體綁定(granulocyte macrophage colonystimulating factor receptor binding);細胞組分中的主要變化在細胞外間隙(extracellular space)、質膜的組成部分(integral component of plasma membrane)。見圖6。
結果發現,集落刺激因子2(Colony-Stimulating Factor 2,Csf 2)注釋到分子功能的粒細胞巨噬細胞集落刺激因子受體綁定中;磺基轉移酶1E 家族成員1(sulfotransferase family 1E member 1,Sult1E1)注釋到分子功能的雌激素酮磺基轉移酶活性及生物學過程的雌激素代謝過程中;上皮調節蛋白(epiregulin,EREG)注釋到生物學過程的EGFR信號通路中。

圖6 交集差異表達基因的GO富集分析三大功能類別柱狀圖
3.7 差異表達基因KEGG 通路富集分析差異表達基因KEGG通路富集分析以P<0.05為顯著性閾值,對交集基因進行KEGG富集分析,以最顯著變化的11個通路繪制氣泡圖,其中涉及的信號通路包括:甾類激素生物合成(Steroid hormone biosynthesis)、細胞色素P450 代謝的生物異源物質(Metabolism of xenobiotics by cytochrome P450)、藥物代謝-細胞色素P450(Drug metabolism-cytochrome P450)、視黃醇的代謝(Retinol metabolism)、ErbB 信號通路(ErbB signaling pathway)、FcεRI 信號通路(Fc epsilon RI signaling pathway)T 細胞受體信號通路(T cell receptor signaling pathway)等。見圖7。

圖7 交集差異表達基因KEGG通路富集分析氣泡圖
結果發現,Csf 2注釋到Fc epsilon RI 信號通路、T細胞受體信號通路;Sult1E1 注釋到甾類激素生物合成通路;EREG注釋到ErbB信號通路。
4 討論
環孢素A 腎損傷屬于中醫學“關格”“腰痛”等范疇[1]。環孢素A 腎損傷系藥毒傷腎,導致“脾腎虧虛”尤其是“腎精虧虛”;脾腎失運,導致濕濁內停;毒損腎絡,瘀血內阻。脾腎虧虛、濕濁血瘀是CsA 腎損傷的根本病機[1,4]。益腎降濁湯主要用于慢性腎功能衰竭“脾腎氣虛,濕濁血瘀”證。方中太子參、生黃芪、生白術、茯苓健脾益氣、利水滲濕;槲寄生、懷牛膝、桑椹益腎;丹參、當歸、懷牛膝活血化瘀;大黃、六月雪、車前子通腑降濁解毒;陳皮健脾理氣、助運降逆。諸藥共奏益腎健脾,降濁化瘀之功效。在前期的基礎研究中,益腎降濁湯[5]及其院內制劑益腎降濁沖劑治療5/6腎切除慢性腎功能衰竭大鼠,均能改善大鼠腎功能和抑制腎小管間質纖維化[6,7]。益腎降濁湯之功效契合CsA腎損傷的病機。
故課題檢測益腎降濁湯對環孢素A誘導HK-2細胞損傷細胞活力的影響。如圖1c所示,發現益腎降濁湯可回調環孢素A 引起的HK-2 細胞活性下降,因此益腎降濁湯是減輕環孢素腎毒性的有效藥物。但YSJZT 對環孢素A 誘導HK-2 細胞損傷細胞內空泡改善不明顯,可能與環孢素A撤藥后YSJZT繼續干預時間仍偏短有關。
RNA-seq測序結果發現模型組與NC組比對得到顯著差異表達基因1410 個(其中上調基因812 個、下調基因598個);YSJZT治療組與模型組比對得到顯著差異表達基因127 個(其中上調基因71 個、下調基因56 個)。為明確YSJZT 減輕CsA 腎毒性的主要靶基因,將T 組比對C 組上調DEG 交集C 組比對NC 組下調DEG,得到36 個DEG;將T 組比對C 組下調DEG 交集C 組比對NC 組上調DEG,得到30 個DEG。對交集的66 個基因進行GO 富集分析,可看出YSJZT 治療后顯著回調的差異基因功能主要集中在生物學過程中的雌激素代謝過程、表皮生長因子受體信號通路、視黃醇代謝過程,分子功能中的雌激素酮磺基轉移酶活性、粒細胞巨噬細胞集落刺激因子受體綁定。KEGG通路富集分析發現,涉及信號通路有甾類激素生物合成、ErbB 信號通路、FcεRIFc 信號通路、T 細胞受體信號通路等。提示益腎降濁湯減輕環孢素A 腎小管細胞毒性的作用機制比較廣泛。
Csf 2在GO功能分類分子功能中的粒細胞巨噬細胞集落刺激因子受體綁定和KEGG pathway 富集的Fc epsilon RI 信號通路、T 細胞受體信號通路中發揮作用。腎損傷后巨噬細胞在腎內積聚,并經歷由促炎(M1)表型向正常修復所需的選擇性激活(M2)表型的轉變。在人M1 巨噬細胞與HK-2 細胞共培養的培養基中Csf 2增加最多,Csf 2只由HK-2細胞分泌。重組人Csf 2 蛋白促進巨噬細胞由M1 向M2 表型轉化。暴露于外源性Csf 2 后,M1 巨噬細胞誘導的HK-2 細胞凋亡和活性氧釋放減弱。在盲腸結扎穿孔膿毒癥小鼠腹腔注射Csf 2 中和抗體會加重腎損傷,抑制腎小管增殖,進而降低存活率。而重組小鼠Csf 2 蛋白可以挽救膿毒癥小鼠[8]。慢性環孢素A腎毒性患兒腎活檢組織病理發現間質巨噬細胞浸潤[8],同時在慢性CsA腎毒性大鼠也發現腎間質巨噬細胞浸潤,與腎間質纖維化密切相關[10]。本研究結果發現,環孢素A 干預HK-2細胞后Csf 2顯著下調[log2(C/NC)=-2.043],益腎降濁湯治療后顯著回調[log2(T/C)=1.255],提示益腎降濁湯上調Csf 2 是其減輕環孢素A 腎毒性的可能靶點之一。
Sult1E1 在GO 分類分子功能中的雌激素酮磺基轉移酶活性、生物學過程中的雌激素代謝過程和KEGG pathway 富集的甾類激素生物合成通路中發揮作用。研究表明雌激素可以減輕小鼠急性腎損傷(Acute Kidney Injury,AKI),雌激素Sult1E1 通過磺化和失活雌激素在雌激素穩態中發揮重要作用,在小鼠急性腎缺血再灌注損傷模型,Sult1E1 基因敲除或對其藥理抑制減輕了雌雄小鼠AKI,與性激素的存在無關。Sult1E1 在AKI 的發病機制中具有新的功能[11]。本研究結果發現,環孢素A干預HK-2細胞后Sult1E1顯著上調[log2(C/NC)=3.153],益腎降濁湯治療后顯著回調[log2(T/C)=-1.177],提示益腎降濁湯抑制Sult1E1可能是其減輕環孢素A腎毒性的作用機制之一。
EREG 在GO 分類生物學過程中的EGFR 信號通路和KEGG pathway 富集的ErbB 信號通路中發揮作用。Epiregulin 與表皮生長因子(Epidermal Growth Factor,EGF)在促進腎近端小管上皮細胞(renal proximal tubular cells,RPTC)增殖和遷移方面具有相當的作用。表皮調節蛋白是RPTC的一種有效的有絲分裂原,可能通過激活EGFR 和PI3K/Akt 通路促進腎臟再生[12]。本研究結果發現,環孢素A 干預HK-2 細胞后EREG顯著下調[log2(C/NC)=-3.689],益腎降濁湯治療后顯著回調[log2(T/C)=1.653],提示益腎降濁湯上調EREG 可能是其減輕環孢素A 腎毒性的作用機制之一。但在體內過量的EGFR 和ErbB 信號激活是有害的[13],故益腎降濁湯在體內對EREG 的調控需要進一步研究,以全面了解YSJZT對EREG的調控。
綜上,益腎降濁湯通過多靶點恢復環孢素A誘導HK-2細胞損傷的細胞活力,其中調控Csf 2、Sult1E1、EREG 多個靶基因及其相關信號通路,可能是益腎降濁湯減輕環孢素A 腎毒性的作用機制。以上分析的可能靶基因仍需要體內外實驗進一步驗證。

