磁共振彌散加權成像在宮頸癌放化療療效早期評估中的應用價值
陳志深 范嬌嬌 王琢 歐健 王艷梅 趙康康 王蘊龍 申延男 趙繼紅 孫寶勝
(吉林省腫瘤醫院 1放療四科,吉林 長春 130021;2放療二科;3放療研究室;4吉林大學公共衛生學院放射生物實驗室;5吉林省腫瘤醫院放射線科)
宮頸癌好發于中老年女性,常見癥狀包括陰道不規則出血、下腹痛及腰骶部疼痛等。磁共振成像(MRI)具有較高的軟組織分辨率,在宮頸癌的診斷和分期等方面具有很高的敏感性和特異性,顯著優于CT和超聲等檢查。磁共振彌散加權成像(DWI)是唯一通過檢測活體水分子微觀運動進而成像的影像學方法,可提供形態學以外的功能生物學信息,從而對常規MRI的不足起到彌補作用〔1〕。近年,DWI在盆腔疾病診斷中的作用逐漸得到肯定。放化療是宮頸癌有效的治療手段,而個體放化療敏感性的差異與治療后的療效存在一定關系。如果能早期預測治療療效,及時調整治療方案并提供個體化的治療,將會取得最大的臨床獲益。本研究觀察DWI影像學技術在宮頸癌治療早期預測放化療療效的臨床應用價值。
1 材料與方法
1.1一般材料 回顧性分析2018年6月至2019年12月吉林省腫瘤醫院88例宮頸癌患者,中位年齡55(39~81)歲;鱗癌78例(88.64%),腺癌10例(11.36%);放化療前臨床分期ⅠB期2例(2.27%),ⅡA期4例(4.55%),ⅡB期48例(54.55%),ⅢB期34例(38.64%)。其中完全緩解(CR)者70例,部分緩解(PR)者18例。納入標準:①經臨床診斷的宮頸癌患者且計劃行同步放化療治療者;②在同步放化療前1 w內、腔內近距離放療前及放化療結束后1個月進行MRI檢查者。排除標準:①治療中斷者;②圖像偽影較大者;③MRI禁忌證者(體內有心臟起搏器、金屬植入物及幽閉恐懼癥等)。
1.2方法 患者均進行根治性同步放化療+腔內近距離放療。外照射放療采取調強/適型放療,5次/w,全盆腔總劑量45~50 Gy/25~28次,1.8~2.0 Gy/次,在外照射放療后期,所有患者進行CT引導的高劑量率腔內近距離放療,2次/w,腔內近距離放療劑量達到28~36 Gy/4~6次,6.0~7.0 Gy/次,放療期間每周進行鉑類單藥同步化療。采用3.0T磁共振掃描儀進行檢查,患者于掃描前適度充盈膀胱,采取仰臥位體位進行掃描,掃描范圍從腰4椎體水平至恥骨聯合下緣。由2名具有豐富工作經驗的放射科醫師獨立閱片并測量腫瘤組織表觀擴散系數(ADC)值,通過軸位T2WI圖像和DWI觀察病變的范圍及大小,避開病變邊緣、血管和囊變壞死區,選取腫瘤最大層面,手動勾畫興趣區(ROI)。記錄放化療前、腔內近距離放療前及放化療結束后1個月的腫瘤ADC值。計算治療前后ADC值的變化率,ADC變化率=(治療后ADC值-治療前ADC值)/治療前ADC值×100%。
1.3治療療效評估 評估患者放化療療效依據于世界衛生組織(WHO)制定的實體瘤療效評估標準(RECIST)1.1,分為CR(腫瘤病灶完全消失,無新病灶出現)、PR(腫瘤病灶最大直徑減小≥30%,至少維持4 w)、疾病穩定(SD,腫瘤病灶最大直徑減小<30%或腫瘤病灶最大直徑增大<20%)、疾病進展(PD,腫瘤病灶最大直徑增大≥20%)。
1.4統計學方法 采用SPSS21.0軟件進行秩和檢驗、獨立樣本t檢驗。
2 結 果
2.1治療過程中腫瘤ADC值比較 入組患者放化療前腫瘤ADC平均值為0.837×10-3mm2/s,腔內近距離放療前腫瘤ADC平均值為1.328×10-3mm2/s,放化療結束后1個月腫瘤ADC平均值為1.498×10-3mm2/s,兩兩比較具有統計學差異(H=210.11,P<0.001)。
2.2治療過程中兩組腫瘤ADC值比較 CR組、PR組放化療前、腔內近距離放療前、放化療結束后1個月腫瘤ADC平均值組內兩兩比較具有統計學差異(P<0.001)。CR組放化療前腫瘤ADC平均值顯著低于PR組(P=0.009),腔內近距離放療前腫瘤ADC平均值顯著高于PR組(P=0.020),而放化療結束后1個月腫瘤ADC平均值顯高于PR組,但差異無統計學意義(P=0.063)。見表1。CR組放化療前和腔內近距離放療前腫瘤ADC平均值值變化率平均值(63.57%)顯著高于PR組(41.50%)(t=7.173,P=0.008);CR組放化療前和放化療結束后1個月ADC值變化率平均值(84.97%)顯著高于PR組(60.70%)(t=5.370,P=0.022)。
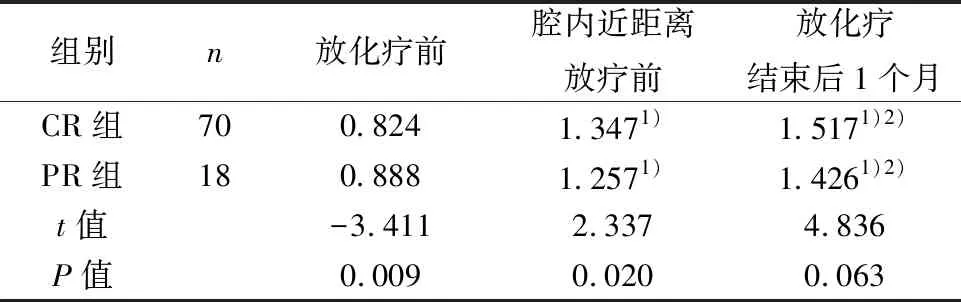
表1 兩組各檢查節點腫瘤ADC平均值比較(×10-3mm2/s)
2.3ADC值變化率在預測宮頸癌放化療療效的效能和應用價值 受試者工作特征(ROC)曲線分析結果顯示放化療前和腔內近距離放療前ADC值變化率界值為48.15%時,預測CR的敏感度為88.6%,特異性為88.9%,ROC曲線下面積(AUC)為0.949。見圖1。
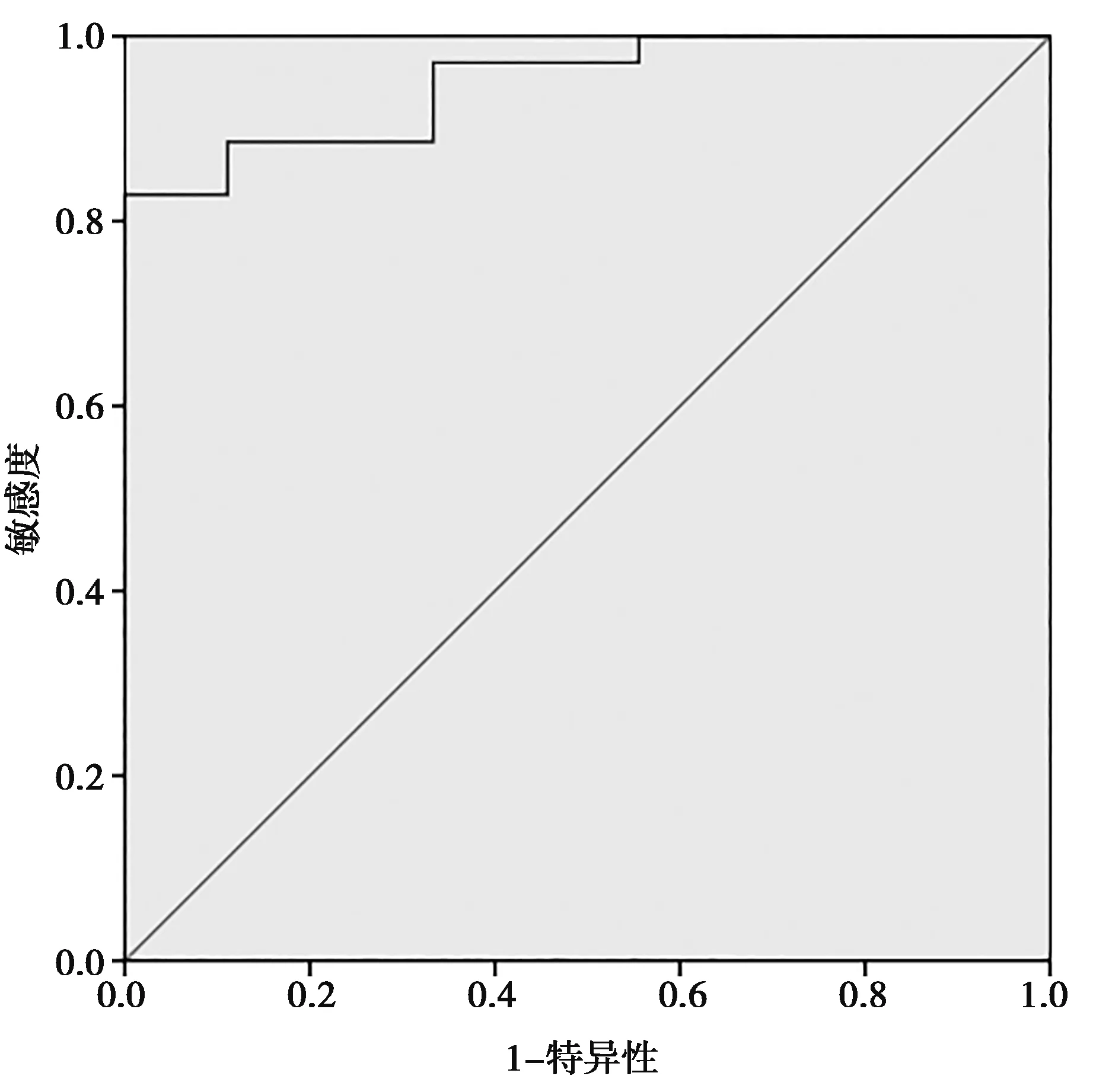
圖1 兩組放化療前和腔內近距離放療前ADC值變化率ROC曲線
3 討 論
放化療作為局部晚期宮頸癌首選的治療方法被廣泛應用于臨床。臨床上主要通過婦科檢查來判斷腫塊的位置、形態、大小,評價宮頸癌放化療后的療效,影像學檢查主要依靠MRI進一步評價宮頸癌放化療的療效。宮頸癌放化療療效存在一定個體性差異,因此在放化療早期對宮頸癌敏感性進行預測,具有十分重要的臨床意義。DWI可彌補常規MRI的不足。組織ADC用于描述 DWI 中不同方向分子擴散運動的速度和范圍,該量化指標在區分良惡性病變及判斷治療效果上具有重要意義。本研究重點觀察宮頸癌放化療后早期及治療過程中腫瘤ADC值變化情況,并通過該量化指標判斷放化療敏感性,針對不同的敏感性制定個體化的治療方案。
有研究表明,宮頸癌組織比正常宮頸組織具有較低的ADC值。郭潤財等〔2〕測得宮頸癌病灶平均ADC值為(0.827 1±0.148 6)×10-3mm2/s,正常宮頸內膜平均ADC值為(1.526 4±0.068 7)×10-3mm2/s,宮頸癌病灶ADC值明顯低于正常宮頸內膜ADC值,Park等〔3〕所測的宮頸癌組織平均ADC值為(0.89±0.10)×10-3mm2/s,陳小莉等〔4〕所測得宮頸癌組織平均ADC值為0.869×10-3mm2/s。本研究所測得治療前宮頸癌組織平均ADC值與上述研究結果相似。
治療過程中腫瘤ADC值存在一定變化,如Park等〔3〕所測的宮頸癌治療前、治療開始后4 w及治療結束后1個月ADC值分別為(0.89 ± 0.10)×10-3、(1.36 ± 0.19)×10-3和(1.57± 0.24)×10-3mm2/s。Liu等〔5〕所測的宮頸癌CR組治療前、治療開始后1個月及治療開始后2個月ADC值分別為(0.810 ± 0.015)×10-3、(1.379 ± 0.132)×10-3及(1.507± 0.132)×10-3mm2/s,PR組治療前、治療開始后1個月及治療開始后2個月ADC值分別為(0.863 ± 0.088)×10-3、(1.283 ± 0.141×10)-3及(1.425± 0.140)×10-3mm2/s。李建生等〔6〕測得的同步放化療前、外照射治療結束時、后裝內照射治療3次時及同步放化療治療結束時宮頸癌組織ADC值分別為(0.86 ±0.04)×10-3、(1.14±0.09)×10-3、(1.30±0.10)×10-3、(1.37±0.09)×10-3mm2/s,且呈上升趨勢。本研究病灶均達到CR或PR,且治療后ADC值較治療前均有不同程度提高。因患者接受治療后,導致大量腫瘤細胞出現壞死,降低了細胞密度,增大細胞外間隙,進而增加水分子擴散速度,使ADC值明顯升高,表明病灶對治療較為敏感,預示具有較好的治療效果。但治療后ADC值存在一定差異,可能與放療分割方式、化療藥物應用及測量時間節點不同有關。
既往一些研究證實治療前低ADC值患者比高ADC值患者顯示出更好的治療效果〔7~9〕。本研究發現,治療之前CR組ADC值顯著低于PR組,可能與腫瘤細胞壞死有關。腫瘤細胞壞死后細胞膜破裂,出現水分子自由擴散加強,導致ADC值升高,而腫瘤細胞壞死與乏氧、低灌注有關,這些因素常導致腫瘤細胞對放化療等治療敏感性降低〔10〕。本文發現部分病例即使是低ADC值,但其治療效果仍不理想,這可能與這部分病例雖然存在腫瘤細胞壞死,但沒有發生液化,從而導致ADC值不高,因此單純根據治療前腫瘤ADC值預測治療效果存在不確切性。
因腫瘤細胞存在異質性,提示不能應用單一指標進行臨床療效評估。基于既往研究和上述假設,本文說明ADC值變化率與治療效果具有相關性,與既往研究結果一致〔4〕。由此可見,可利用ADC值變化率評價宮頸癌放化療療效的特異性和敏感性。Liu等〔5〕通過分析33例宮頸癌患者治療過程中ADC值變化情況發現,ADC值變化率界值為35.4%時,預測CR的敏感性為100%,特異性為73.1%。可看出通過ADC值變化率預測治療效果及判斷治療敏感性均有較高的效能,但仍存在一定差異,可能與入組病例數、分析時間節點及治療方式不同有關,有待大型前瞻性實驗進一步驗證。本研究為單中心研究且樣本量相對較小,需擴大樣本量進一步研究;部分患者MRI檢查前進行了病理活檢,尚難以預測活檢對ADC值可能造成的影響;本研究尚缺乏長期隨訪數據,可繼續隨訪,通過ADC值對放化療后纖維化與病灶殘留進行鑒別診斷及預測復發等。
綜上,DWI定量參數及其變化率可在治療前預測及在治療過程中動態評估宮頸癌放化療效果。

