鹽脅迫對4 種馬鈴薯脫毒苗生長及生理特性的影響
劉 婕,梅 超,王慧杰,宋倩娜,馮瑞云
(1.山西大學生物工程學院,山西太原030006;2.山西農業大學農學院,山西太原030031)
鹽堿地在全球分布廣泛,隨著人類的活動,土壤的鹽漬化問題日益加重,造成農作物產量下降,已成為全球性的資源與環境問題。我國鹽堿地面積較大,約占可利用土地面積的5%,且呈逐年上升的趨勢。高濃度鹽會導致植物體內離子失衡、影響次級代謝物的合成[1],破壞葉綠體結構,傷害細胞膜,減弱光合能力;還造成生理干旱,各種代謝紊亂,進而影響養分運輸和分布,導致生長不良甚至死亡。植物響應鹽脅迫是一個錯綜復雜的過程。目前,植物對鹽的響應還沒有公認的機制[2],如何有效利用鹽堿地資源推廣種植耐鹽品種是解決糧食問題、平衡環境和人口壓力的重要途徑。開展耐鹽種質鑒定和篩選,并對其生長及生理生化特性及不同濃度鹽脅迫的響應研究,是我國農業研究領域的熱點之一。
馬鈴薯(Solanum tuberosumL.)是一種食用價值很高的草本植物,在我國種植面積日益增大。馬鈴薯屬鹽敏感型經濟作物[3],對鹽的抵抗能力比較弱[4],鹽脅迫會嚴重抑制馬鈴薯的生長發育,使株高降低、葉綠素含量減少、出苗遲緩,甚至死亡。李青等研究發現[5]鹽脅迫會影響馬鈴薯細胞結構以及次級代謝物的合成。
本研究通過分析不同鹽濃度脅迫下4 種馬鈴薯的農藝性狀、抗氧化酶活性以及丙二醛含量的差異,旨在為深入挖掘、篩選和培育耐鹽馬鈴薯品種提供參考。
1 材料和方法
1.1 試驗材料
馬鈴薯品種為晉薯16 號、冀張薯12 號、青薯9 號、克新1 號。無菌培養苗由山西農業大學農學院植物基因編輯實驗室提供。
1.2 試驗方法
1.2.1 農藝性狀的測定 選取4 個品種馬鈴薯脫毒苗,在超凈工作臺剪取約1 cm 帶腋芽的莖段進行脫毒苗擴繁,分別插入含有0、25、50、75、100 mmol/L NaCl 的MS 固體培養基的玻璃瓶(高11 cm,直徑7 cm),每瓶放置6 個莖段,每個處理10 瓶。蓋緊瓶口放在無菌培養室培養,溫度25 ℃,光照強度2 000~3 000 lx,每天光照16 h,暗處理8 h。生長25 d 進行農藝性狀的測定。
1.2.2 生理生化指標的測定 選取4 個品種馬鈴薯脫毒苗定植于珍珠巖穴盤,用1/2 Hoagland 培養液澆至珍珠巖全部浸濕,培養7 d,然后用蒸餾水浸濕珍珠巖24 h,分別用0、50、100 mmol/L NaCl 的蒸餾水浸濕,培養溫度23 ℃,光照強度2 000~3 000 lx,每天光照16 h,暗處理8 h。48 h 后測定生理生化指標。POD、SOD、CAT、MDA 分別采用過氧化物酶(POD)測試盒、超氧化物歧化酶(SOD)測試盒、過氧化氫(CAT)測試盒、丙二醛(MDA)測試盒,利用分光光度計進行測定。試劑盒均購自南京建成生物工程研究所。
1.3 數據分析
原始數據的整理采用Microsoft Excel 2016 軟件進行,統計分析用SPSS 18.0 完成。
2 結果與分析
2.1 不同鹽濃度對馬鈴薯農藝性狀的影響
由表1 可知,隨著鹽濃度的增加,4 個馬鈴薯品種的株高生長受到不同程度的抑制。75 mmol/L 鹽濃度處理下,株高受到抵制作用由高到低依次為青薯9 號>克新1 號>冀張薯12 號>晉薯16 號,青薯9 號的抑制最嚴重,降幅達5.12 cm。100 mmol/L 鹽濃度處理時,4 個品種均出現株高停止生長甚至莖段褐化的現象。隨著鹽濃度的增加,4 個品種的鮮質量變化不明顯。
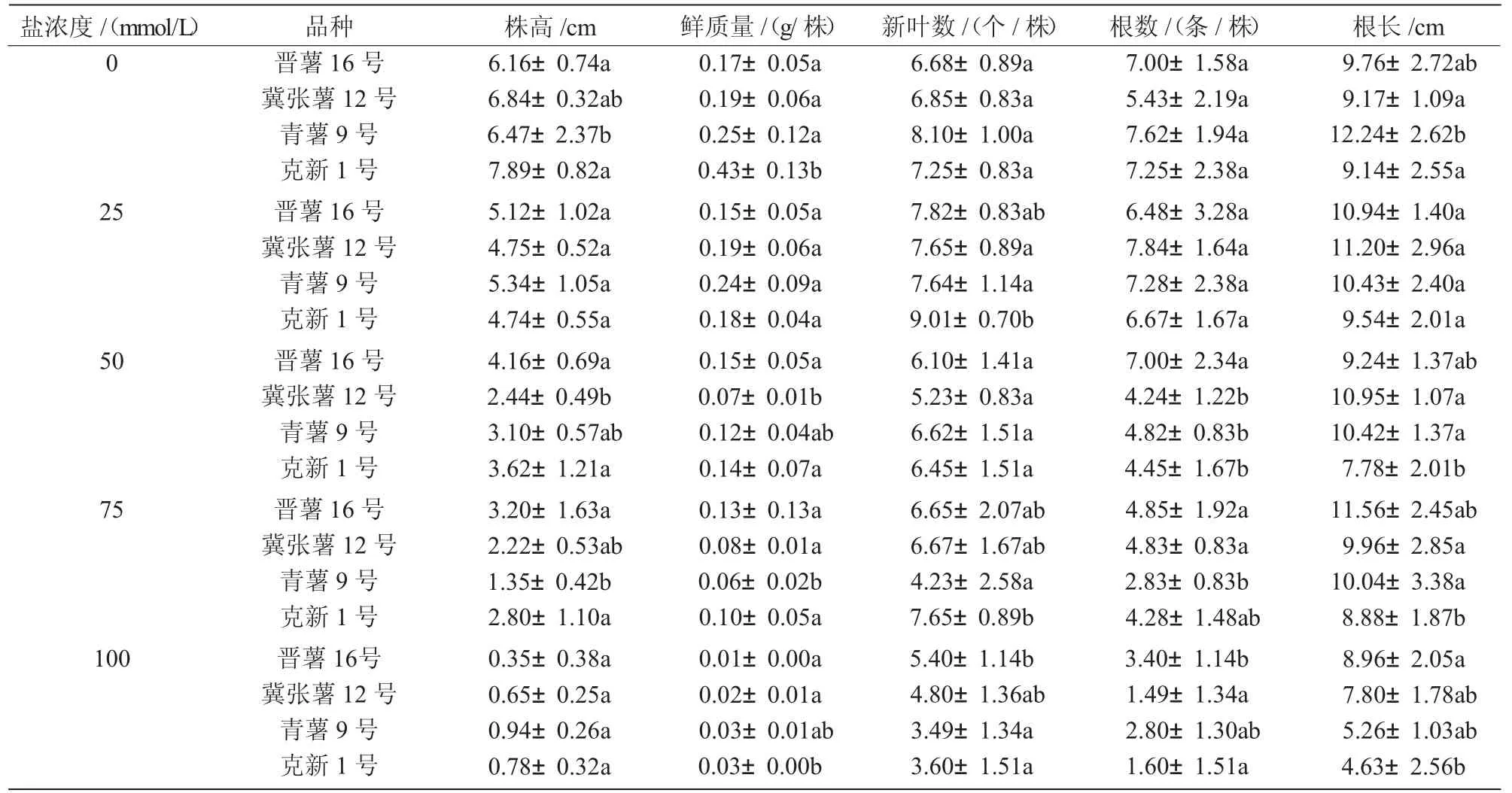
表1 不同鹽濃度下馬鈴薯脫毒苗生長情況
隨著鹽濃度的增加,青薯9 號的新葉數呈現降低趨勢;但晉薯16 號、冀張薯12 號和克新1 號在25 mmol/L 鹽濃度下均出現小幅上升,之后隨著鹽濃度的增加呈現降低趨勢。在75 mmol/L 鹽濃度下青薯9 號降幅最大,達到3.8 片;其余品種降幅在1 片之內,差異達到顯著水平(P<0.05)。在75 mmol/L鹽濃度處理下,根數由高到低依次為:晉薯16 號>冀張薯12 號>克新1 號>青薯9 號。
青薯9 號的根長隨著鹽濃度的增加呈現小幅下降趨勢,與對照相比,75 mmol/L 濃度下青薯9 號的根長減少2.2 cm。克新1 號根長隨著鹽濃度的增加呈現先增后降的趨勢;在25 mmol/L 濃度下雖出現小幅增加,但50、75 mmol/L 下均表現下降趨勢,但降幅較低。晉薯16 號在25、75 mmol/L 鹽濃度下的根長相比對照分別升高了1.18、1.8 cm,而50 mmol/L 濃度下的根長比對照降低了0.52 cm。冀張薯12 號的根長隨著鹽濃度的增加呈現升高趨勢,在25、50、75 mmol/L 濃度下的根長相比對照分別升高了2.03、1.78、0.79 cm。100 mmol/L 鹽濃度下4 個品種中青薯9 號的根數降幅最大,達到62%。
2.2 不同鹽處理對馬鈴薯POD 活性的影響
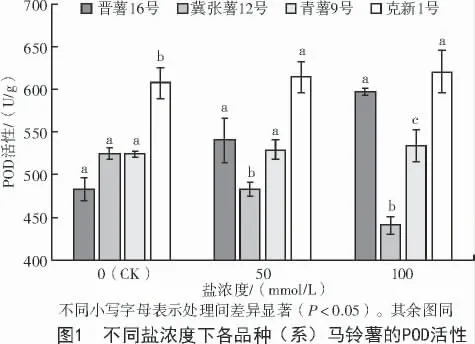
由圖1 可知,正常生長條件下,冀張薯12 號、青薯9 號和晉薯16 號間POD 酶活性差異不顯著。50 mmol/L 鹽脅迫條件下,4 個材料之間的差異達顯著水平(P<0.05),克新1 號和晉薯16 號的POD 活性顯著高于冀張薯12 號;與對照相比,晉薯16 號升高11%,青薯9 號升高0.8%,克新1 號升高1%,冀張薯12 號不升反降。100 mmol/L 鹽脅迫條件下,冀張薯12 號的POD 酶活性降低,晉薯16 號的POD 酶活性升高,青薯9 號和克新1 號的變化不顯著,4 個品種之間的差異達顯著水平,冀張薯12 號和青薯9 號的POD 酶活性顯著低于其他2 個品種。由此可見,鹽脅迫后馬鈴薯POD 活性升高,抵御逆境脅迫過程中晉薯16 號POD 活性增加,清除活性氧的能力較強。
2.3 不同鹽處理對馬鈴薯SOD 活性的影響
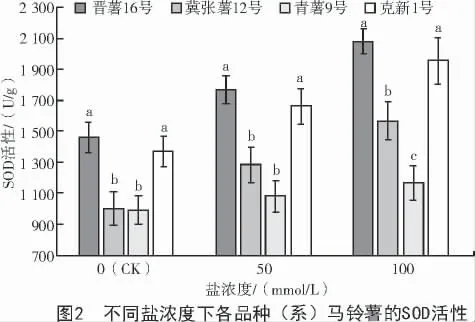
由圖2 可知,正常生長條件下,由于品種間遺傳特性的差異,晉薯16 號和克新1 號的SOD 活性略高于其他2 個品種。2 種鹽濃度處理下,4 個品種間SOD 酶活性差異均達顯著水平(P<0.05),晉薯16 號和克新1 號之間差異不顯著,青薯9 號的SOD酶活性最低且顯著低于其余3 個品種。50 mmol/L鹽濃度處理下,晉薯16 號的SOD 活性最高,青薯9 號的SOD 活性最低;與對照相比,晉薯16 號升高20%,冀張薯12 號升高28%,青薯9 號升高5%,克新1 號升高21%。100 mmol/L 鹽濃度處理后的SOD酶活性均高于對照,青薯9 號的增加幅度最小,為17%,其他3 個品種增幅均達到40%。由此可見,青薯9 號在鹽濃度處理后SOD 酶活性最低,耐鹽性較弱。
2.4 不同鹽處理對馬鈴薯CAT 活性的影響
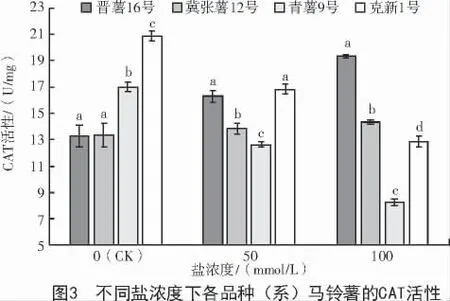
由圖3 可知,正常生長條件下,由于品種間遺傳特性的差異,克新1 號和青薯9 號的CAT 酶活性均高于其他2 個品種。2 種鹽濃度處理下,4 個品種間CAT 酶活性差異均達顯著水平(P<0.05),晉薯16 號CAT 酶活性最大,高于其余3 個品種,青薯9 號顯著低于其余3 個品種。50 mmol/L 鹽濃度處理下,晉薯16 號和冀張薯12 號的CAT 活性升高,分別升高23%和3.7%;克新1 號和青薯9 號的CAT活性降低,分別降低25%和16%。100 mmol/L 鹽濃度處理后的CAT酶活性與對照相比,晉薯16 號和冀張薯12 號均呈現升高的趨勢,而克新1 號和青薯9 號的CAT 酶活性呈降低趨勢;其中,晉薯16 號的增幅較大,為45%,青薯9 號的降低幅度較大,為51%。說明本試驗鹽濃度下,青薯9 號在100 mmol/L 鹽濃度處理下CAT 酶活性較低,對鹽的耐受反應較弱。
3 結論與討論
鹽處理條件下不同馬鈴薯品種間的農藝性狀表現不盡相同,相同趨勢下的敏感程度也不同。張俊蓮等[6]研究認為,植株高度作為鹽脅迫指標較靈敏。王新偉[7]研究認為,馬鈴薯株高、根長、干物質可以用來鑒定耐鹽性。本試驗發現,MS 培養基模擬鹽脅迫環境下,4 個馬鈴薯品種脫毒苗的株高、新葉數、根長、根數、鮮質量均受到不同程度的抑制,與前人研究的結果相一致[8-9]。本研究還發現,25 mmol/L 鹽濃度處理后4 個品種受到鹽脅迫的影響較小,并且4 個品種間的差異也不顯著,低鹽處理可促進根系生長,促進晉薯16 號、冀張薯12 號和克新1 號新葉數的增加,推測低鹽處理可一定程度上誘導馬鈴薯的根系和新葉的生長,這與張招娟等[10]的研究結果一致。50 mmol/L 或75 mmol/L 鹽濃度處理對馬鈴薯脫毒苗影響明顯,且4 個品種間農藝性狀差異顯著,故50 mmol/L 或75 mmol/L 濃度可作為馬鈴薯脫毒苗耐鹽性品種(系)的鑒別濃度,且青薯9 號的各農藝性狀受到影響較大,晉薯16 號最小,表明晉薯16 號耐鹽能力較強;青薯9 號耐鹽能力較弱。100 mmol/L 鹽濃度下馬鈴薯脫毒苗出現不生根、無新葉甚至褐化的現象,可認為該濃度是馬鈴薯脫毒苗生長停滯的臨界濃度。綜合表明,晉薯16號對鹽脅迫耐受性較好,青薯9 號較弱。在山西省高鹽堿地馬鈴薯產區有較高的推廣價值。
張景云等[11]研究認為,SOD 活性和POD 活性可作為間接指標評價馬鈴薯耐鹽性。白江平等[12]報道鹽脅迫使馬鈴薯試管苗SOD 和CAT 活性增加。KEYVAN 等[13]研究認為,鹽脅迫提高了馬鈴薯POD活性。鹽脅迫下植物會產生大量活性氧,抗氧化防御系統是植物抗脅迫的途徑之一[14],SOD、POD 和CAT參與植物的抗氧化防御系統。本研究結果表明,SOD 和POD 活性整體上呈上升趨勢,克新1 號和青薯9 號CAT 活性下降而晉薯16 號和冀張薯12 號CAT 活性小幅上升。推測SOD、POD 和CAT 并非在在同一時間內起作用,CAT 的響應效果較慢,與李青等[15]研究結果一致。

