維生素B12早期干預影響海馬神經元DNA甲基化和抗β淀粉樣蛋白神經毒性作用
劉乃榕,李景輝,任剛,李晶,詹杰
阿爾茨海默病(Alzheimer disease,AD)是一種中樞神經神經系統退行性疾病。臨床以進行性記憶及認知障礙,伴精神及行為異常為主要特征,目前病因迄今未明,尚無有效治療手段[1],是影響全球公共健康的重大問題[2]。目前已知AD具有兩大病理特征,β淀粉樣蛋白(amyloid-β,Aβ)沉積形成的細胞炎斑和tau蛋白過度磷酸化形成神經細胞內神經原纖維纏結,典型的細胞炎斑核心是Aβ,Aβ沉積被認為是AD始發因素。研究發現AD具有高度遺傳性,目前全基因組關聯研究已發現20多個AD風險基因。營養作為細胞分裂、增殖和代謝的物質條件,伴隨著生命從孕育到終結的全過程。相對于遺傳學缺陷,表觀遺傳性疾病有可能通過生命早期的營養干預而發生逆轉,影響AD風險基因的表達。
研究顯示,成人體內缺乏B12可引起血漿Hcy濃度升高,導致AD發生。本試驗以維生素B12不同劑量對新生大鼠海馬神經元進行早期干預,對比觀察維生素B12早期干預對DNA甲基化以及海馬神經元成熟后對Aβ毒性作用的反應,從細胞水平分析生命早期補充維生素B12對AD發病的保護機制。
1 材料與方法
1.1 實驗動物 健康SPF級SD大鼠20只(雌鼠15只,雄鼠5只),體質量300~350 g,由遼寧長生生物技術有限公司提供[許可證編號:SCXK(滬)2012-0002]。
1.2 實驗藥品及試劑 維生素B12(Sigma公司);脫氧胞苷(deoxycytidine,dC)標準品、5-甲基脫氧胞苷(5-methyl-deoxycytidine,5-mdC)標準品;Aβ1-42、rat TFA(MCE);AnnexinⅤ/PI凋亡試劑盒(達科為);DNA提取試劑盒、蛋白質定量試劑盒(BCA法,天根);四甲基偶氮唑鹽(3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)(Amresco公司);丙二醛試劑盒、超氧化物歧化酶(superoxide dismutase,SOD)試劑盒、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-PX)試劑盒(南京建成生物公司)。
1.3 主要儀器及設備 高效液相色譜儀(安捷倫8650)、酶標儀(上海三科318C);分光光度計(analytikjena公司SPECORD 210);CO2培養箱(Thermo HERAcell vios 160i);熒光倒置顯微鏡(卡爾蔡司Axio Vert.Al);全自動流式細胞儀(BECKMAN COULTER CytoFLEX);超聲細胞破碎儀(寧波新芝)。
1.4 實驗方法
1.4.1 新生大鼠海馬神經元細胞(hippocampal neuron cells,HNCs)培養[3-4]和分組 新生大鼠出生12 h內取海馬組織,去除血管、筋膜等海馬無關組織,0.125%胰酶消化,吸管反復輕柔吹打至吹散細胞,37 ℃培養箱內消化25 min,加入含血清的全培養液終止消化,200目尼龍篩過濾,1 000 r/min離心10 min去上清,含10%血清的高糖DMEM培養液吹散細胞制成細胞懸液,計數細胞密度,調整細胞密度為2×106個/mL,接種于涂布10%賴氨酸的培養瓶中。每窩HNCs細胞隨機分為5組,即空白組、模型組、維生素B12低劑量組(200 μg/L)、中劑量組(400 μg/L)、高劑量組(600 μg/L),添加干預因素后,置37 ℃ 5%CO2培養箱內培養24 h,換添加不同濃度維生素B12的無血清B27培養液繼續培養48 h。此后每隔2~3天換液1次,每次無干預因素的空白B27培養液半量換液。培養期間,每天在倒置顯微鏡下觀察神經元生長狀況。培養7 d左右,可見HNCs細胞形成突觸。
1.4.2 高效液相法測定 各組HNCs細胞DNA甲基化水平按DNA提取試劑盒說明書進行DNA提取,分光光度計法測定DNA濃度,DNA濃度滿足HPLC測定需求后,HPLC法測定基因組DNA甲基化水平[5-6]。色譜柱:Ultimate Polar-RP(4.6 mm×250.0 mm,5 μm);流動相:0.2%(體積分數)磷酸;流速:1.3 mL/min;檢測波長273 nm;進樣量20 μL。分別配制5種濃度(1.0、2.0、5.0、10.0、20.0 mg/L)的dC和5-mdC標準品溶液,用于繪制標準曲線。根據標準曲線計算樣品色譜圖中2種脫氧核苷峰面積對應的濃度(分別記為CdC和C5-mdC),則樣品基因組DNA的整體甲基化水平(%)=100×C5-mdC/(C5-mdC+CdC)。
1.4.3 Aβ1-42熟化及細胞損傷模型的建立[7]Aβ1-42用無菌磷酸鹽緩沖液配制成2×103μmol/L的Aβ原液,37 ℃孵育5 d成纖維狀,-20 ℃保存備用。各組HNCs細胞培養至細胞元細胞形成突觸。模型組及各劑量干預組換成含5 μmol/L熟化Aβ的B27培養液造模,繼續培養24 h,倒置顯微鏡下觀察神經元生長狀況。
1.4.4 MTT比色分析法 計算細胞增殖率新生大鼠HNCs 96孔板培養,分組、維生素B12添加及Aβ染毒造模方法同前,MTT比色分析,酶聯免疫檢測儀OD 490 nm處測量各孔的吸光值,計算細胞增殖率。細胞增殖率(%)=A實驗組/A對照組×100%。
1.4.5 流式細胞術檢測細胞凋亡率 各組HNCs細胞胰酶消化,FITC-AnnexinV/PI雙熒光標記,上流式細胞儀檢測細胞凋亡率。FlowJo軟件分析結果,結果以凋亡細胞的百分率表示。細胞凋亡率=晚期細胞凋亡率+早期細胞凋亡率。
1.4.6 氧化應激指標測定 收集各組HNCs培養液,按試劑盒使用說明操作,用硫代巴比妥酸法測定丙二醛含量,比色法測定GSH-PX活力。
各組HNCs細胞胰酶消化,冰水浴條件下超聲細胞破碎,功率300 W,每次超聲3~5 s,間隔30 s,重復4~5次,黃嘌呤氧化酶法按試劑盒使用說明測定SOD活性。
1.5 統計學方法 采用SPSS 16.0軟件包對各組變量值做方差分析和組間差異顯著性分析,P<0.05為差異有統計學意義。
2 結果
2.1 維生素B12早期干預對新生大鼠HNCs細胞DNA甲基化的影響及不同處理比較 見表1。

表1 維生素B12早期干預對HNCs細胞DNA甲基化的影響
由表1結果可知,新生大鼠HNCs細胞出生12 h內進行維生素B12低、中、高劑量干預后DNA甲基化水平較空白組均有降低,其中低、中劑量組低于空白組,差異有統計學意義(P<0.01)。
2.2 維生素B12早期干預對Aβ染毒HNCs細胞增殖率的影響 見表2。

表2 維生素B12早期干預對HNCs細胞增殖率的影響
圖2結果顯示,Aβ染毒24 h后,模型組與空白組比較細胞增殖率顯著下降(P<0.01),與模型組對比觀察可知,維生素B12早期干預組HNCs細胞Aβ染毒24 h后,各組細胞增殖率水平與模型組比較均有提高,差異有統計學意義(P<0.01)。
2.3 維生素B12早期干預對Aβ染毒HNCs細胞凋亡的影響 見圖1。
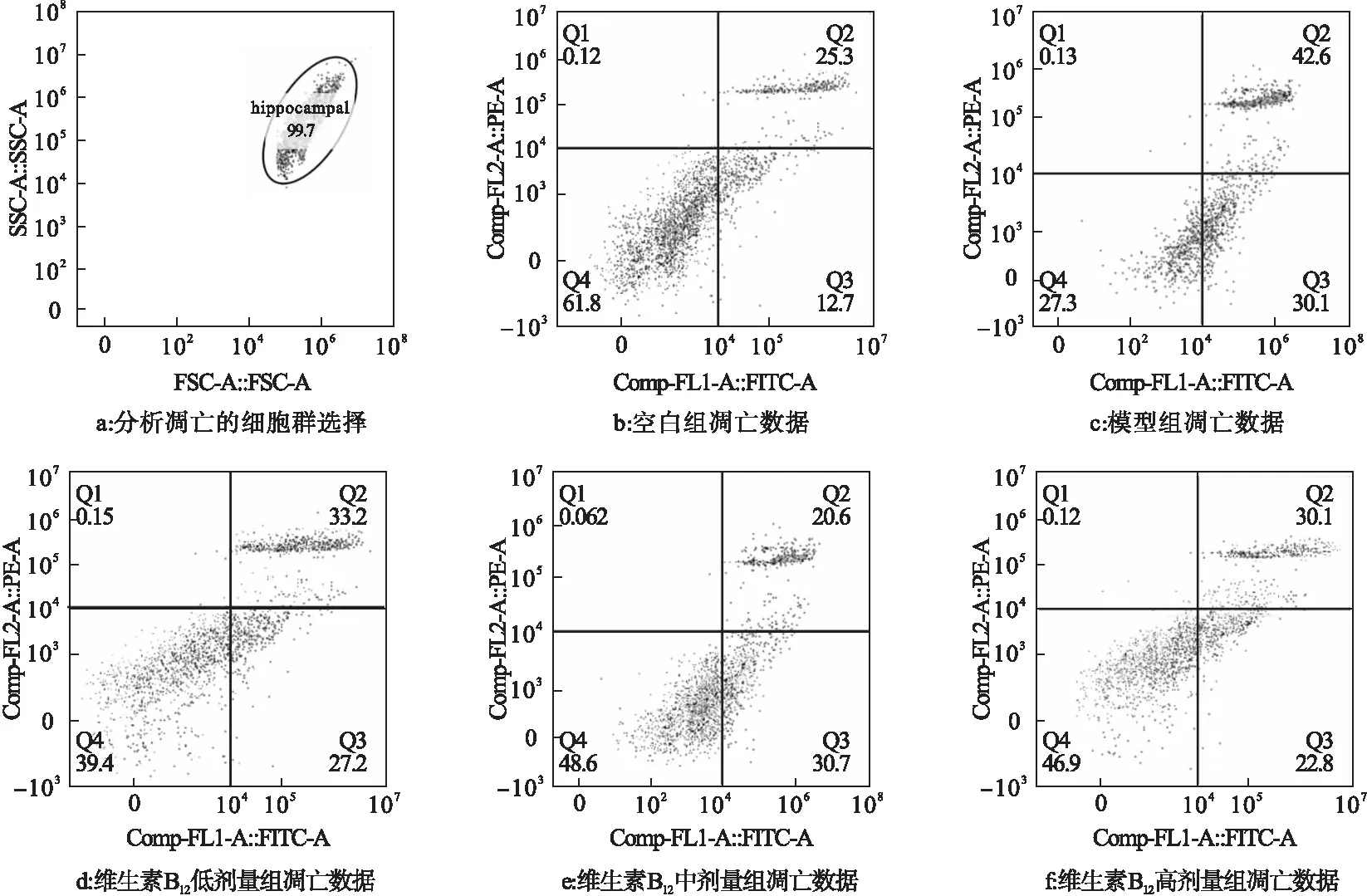
注:Q1:壞死細胞;Q2:晚期凋亡細胞;Q3:早期凋亡細胞;Q4:活細胞
圖1結果顯示,Aβ染毒24 h后,模型組細胞早期凋亡細胞和晚期凋亡細胞數均明顯增多,細胞凋亡率明顯高于空白組(72.7%vs38.0%),差異有統計學意義(P<0.05)。
維生素B12干預各組與模型組比較細胞凋亡率均有降低,分別為60.4%、51.3%、52.9%,差異有統計學意義(P<0.05)。
2.4 維生素B12早期干預對Aβ染毒HNCs細胞抗氧化能力的影響 見表3。
表3 維生素B12早期干預對Aβ染毒HNCs細胞抗氧化能力的影響
表3結果顯示,Aβ染毒24 h后,模型組HNCs的丙二醛較空白組明顯增高,差異有統計學意義(P<0.05),維生素B12干預各組均可顯著減少Aβ染毒后HNCs的丙二醛含量,差異有統計學意義(P<0.05)。
Aβ染毒24 h后,模型組SOD活性明顯低于空白組,差異有統計學意義(P<0.05);維生素B12干預各組Aβ染毒后HNCs的SOD活力較模型組均有提高,其中低劑量組與模型組差異有統計學意義(P<0.05)。
Aβ染毒24 h后,模型組GSH-Px活性明顯低于空白組,差異有統計學意義(P<0.05);維生素B12干預各組Aβ染毒后HNCs的GSH-Px活性較模型組均有提高,差異有統計學意義(P<0.05)。
3 討論
AD是老年人認知障礙癥最主要的類型之一,是一個全球性的健康問題,給社會和家庭帶來了沉重負擔。該病至今病因和發病機制未明,尚無公認有效的治療方法,目前已知AD具有兩大病理特征,Aβ沉積形成的細胞炎斑和tau蛋白過度磷酸化形成神經細胞內神經原纖維纏結[7]。Aβ學說認為AD的發病機制是多種基因變異,導致Aβ淀粉樣沉淀,形成神經炎斑,逐漸損傷突觸及神經細胞,導致神經細胞內鈣離子增高,腦內蛋白酪氨酸激酶活化,tau蛋白過度磷酸化,與神經細胞微管蛋白纏結;Aβ同時損傷線粒體膜,影響神經細胞能量代謝和乙酰膽堿的合成與釋放,導致神經興奮傳遞減慢,神經細胞功能喪失,臨床出現記憶障礙,甚至癡呆癥狀。Aβ1-42是人體內最常見的Aβ亞型之一,具有更強的毒性,且更容易聚集,形成Aβ沉淀的核心,引發神經毒性作用。研究結果顯示,成熟的HNCs體外培養加入5 μmol/L的Aβ1-42染毒24 h可造成HNCs細胞增殖率降低,細胞凋亡率升高,丙二醛含量增高,SOD活性和GSH-PX活性下降,證明Aβ1-42導致HNCs的自由基損傷增加,同時誘導HNCs發生細胞凋亡,加速HNCs退行性損傷。
充足的營養對正常的大腦結構和功能至關重要,尤其是妊娠期及嬰幼兒時期的營養為大腦的形成奠定了物質基礎,甚至影響整個生命周期的認知、運動、語言和情緒等大腦功能[8-9]。維生素B12(鈷胺素)主要參與一碳單位循環,在機體同型半胱氨酸合成蛋氨酸的轉甲基反應過程中扮演著重要角色。現代研究顯示,該藥物能夠有效促進機體神經系統中神經元髓鞘及卵磷脂的形成,從而對軸突再生、促進神經生長產生較強的刺激。此外,該藥物分子還能夠轉移到神經細胞的細胞器中,增加神經遞質的代謝活性,從而改善神經組織代謝障礙及傳遞作用。成人體內缺乏B12可引起血漿Hcy濃度升高,導致AD發生,通過科學補充可抑制腦缺血神經細胞凋亡,抑制自由基產生和脂質過氧化反應,降低腦神經損害[10-11]。
本研究結果顯示,維生素B12作用于出生12 h內的大鼠海馬神經元,可降低神經元細胞的甲基化水平,發揮表觀遺傳學調節作用,其影響可一直持續,并在成熟期HNCs對抗Aβ神經毒性作用中繼續發揮調節作用,參與神經元細胞氧化應激,減少脂質過氧化物的產生,保護細胞膜的結構及功能不受過氧化物的干擾和損害,促進細胞增殖,減緩神經細胞凋亡,從而可能在預防AD方面發揮有益效應。維生素B12安全性研究中人群資料顯示人體攝入維生素B12后的毒性很低,目前尚無維生素B12毒性反應及生殖與發育毒性的報道,也為其在生命早期干預達到AD預防作用提供了可能。

