圍手術期免疫營養支持對口腔癌患者手術預后的影響*
韓新生 譚小堯 張興安 明華偉 王華東 袁宗毅 李婷 賈佳欣 陳方園
(南充市中心醫院·川北醫學院第二臨床醫學院口腔頜面外科,四川 南充 637000)
口腔癌是消化系統常見的惡性腫瘤,90%是潰爛型及外生型的鱗狀細胞癌,患者更易出現吞咽功能障礙,所以口腔癌患者存在營養風險及營養不良的比率較高。中國抗癌協會腫瘤營養專業委員會最近研究報告指出,我國住院腫瘤患者中、重度營養不良的發生率高達58%,消化系統腫瘤營養不良的發生率顯著高于非消化系統腫瘤[1]。目前,對于存在營養風險及營養不良的口腔癌患者,在圍手術期實施免疫營養支持治療及其臨床結局,相關文獻的研究報道較少。本研究旨在探討圍手術期對存在營養風險的口腔癌患者應用免疫營養支持治療,分析其是否與術后營養狀況及臨床結局存在相關性。現報告如下。
1 資料與方法
1.1 一般資料 選取2016年9月~2018年9月間我院住院確診存在營養風險的60例口腔癌患者為研究對象,采取隨機數字表法分為觀察組和對照組,每組各30人。其中男性32例,女性28 例,年齡61~87歲,平均年齡(68.2±9.3)歲。納入標準:①術前均經組織病理學檢查明確診斷。②均采用口腔癌根治術+血管化游離皮瓣轉移修復術。③術前均未行放、化療。④患者及家屬知情并簽署知情同意書。⑤經營養風險篩查存在營養風險。排除標準:①嚴重胃腸道吸收障礙疾病者。②存在其他部位的惡性腫瘤。本研究經醫院倫理委員會批準。
1.2 方法 入院后4 h內經營養風險篩查表2002(nutritional risk screening 2002, NRS2002)進行營養風險評估,對評分≥3分的患者認為存在營養風險。圍手術期對照組術前采用常規流質飲食補充營養并實施營養支持指導,術后經鼻胃管常規流質飲食補充腸內營養并給予營養支持指導;觀察組采用常規營養飲食的基礎上術前經口服或代金氏管給予免疫營養制劑( 精氨酸、ω-3 脂肪酸和核苷酸)行腸內免疫營養支持治療,術后經鼻胃管除常規飲食外,由營養科醫師評估并開出具備“食補”和“免疫支持”的腸外營養液袋和腸內營養粉(液)行普通營養+免疫營養支持治療。根據惡性腫瘤營養治療指南[2]每天患者營養支持的給量標準:總熱量的攝入以 每天25~30 kcal/kg計算, 蛋白質支持攝入量以每天1.5~2 g/kg來計算。術后給予抗感染、止痛、消腫及輸液維持內環境穩定的常規治療方案。
1.3 觀察指標 研究時間點:入組后從入院第1天開始,持續至出院。分別記錄兩組患者在入院時、手術當天、手術后第7天三個時間節點的相關數據。在早晨7∶00~8∶00患者未進食的情況下抽取外周靜脈血進行實驗室檢查,記錄有關實驗室檢查指標:血清前白蛋白(PAB)、血清白蛋白(ALB)、轉鐵蛋白(TRF)、總淋巴細胞計數(TLC);記錄體重指數(BMI)、肱三頭肌皮褶厚度(TSF),BMI計算公式:BMI=體重(kg)÷身高(m)的平方。操作方法:①身高、體重:采用標準的帶有身高測量尺的體重測量秤進行測量,患者均統一穿著病員服測量。②肱三頭肌皮褶厚度(TSF): 患者取自然站立,上臂自然下垂,取右上臂肱三頭肌肌腹最厚處測量,將測量點處皮膚及皮下脂肪輕輕的捏起,用專門的測量尺測量皮褶的厚度,所測數值即為TSF厚度,單位為mm[3]。
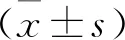
2 結果
2.1 兩組患者一般資料比較 兩組患者的性別、年齡、病例種類等一般資料比較差異無統計學意義(P>0.05),有可比性,見表1。
2.2 兩組人體測量BMI和TSF數據比較 入院時,兩組患者BMI、TSF指標比較差異均無統計學意義(P>0.05);手術當天兩組患者BMI、TSF指標均高于入院時,但與入院時相比差異無統計學意義(P>0.05),且組間比較差異仍無統計學意義(P>0.05);術后7天兩組患者的BMI、TSF較手術當天有所下降,但是和入院時、手術當天相比差異均無統計學意義(P>0.05),并且組間比較差異仍無統計學意義(P>0.05),見表2。
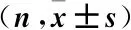
表1 兩組一般資料比較
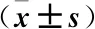
表2 兩組人體測量BMI和TSF數據比較
2.3 兩組實驗室營養代謝指標比較 入院時,兩組患者PAB、ALB、TRF、TLC指標比較差異均無統計學意義(P>0.05);手術當天兩組PAB、ALB、TRF、TLC指標均高于入院時,且觀察組各項指標均高于對照組(P<0.05);術后7天兩組PAB、ALB、TRF、TLC指標均高于入院時,且觀察組高于對照組,差異均有統計學意義(P<0.05),見表3。
2.4 兩組術后胃腸道不良反應發生率及住院時長比較 通過對比分析,觀察組住院時間明顯短于對照組且胃腸道不良反應發生率均顯著低于對照組,組間比較差異均有統計學意義(P<0.05),術后傷口I期愈合例數觀察組高于對照組,組間差異具有統計學意義(P<0.05),見表4。
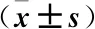
表3 兩組實驗室營養指標比較
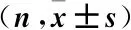
表4 兩組術后不良反應及住院時長比較
3 討論
營養風險指經營養評估后患者現在已經存在的或潛在存在的機體營養因素相關的對疾病或手術相關的臨床結局發生負面影響的可能[4]。營養不良是惡性腫瘤的重要發生、發展因素,是腫瘤患者最常見的合并癥,其嚴重削弱抗腫瘤治療效果,導致并發癥發生、延長住院時間、增加醫療費用[5]。目前關于腫瘤患者營養不良的發病率各家報道差異很大,惡性腫瘤患者營養不良的發生率在35%~85%之間,這和腫瘤病變的類型、發生的部位、TNM臨床分期、接受的治療等因素有直接關系[6-8]。口腔癌屬于消化系統的一種惡性腫瘤,同樣存在營養不良發生率較高,且臨床營養治療率低的現象,需要臨床醫生高度重視。
良好的圍手術期處理是手術病人順利康復的重要保障,營養支持是圍手術期處理的主要內容之一。目前很多外科醫生只追求手術技能的提高,盡可能減少手術創傷,但缺乏營養支持治療的知識[9-10]。中國抗癌協會腫瘤營養與支持治療專業委員會進行了一項中國醫務人員腫瘤營養知識-態度-行為調查分析,調查結果顯示總體醫務人員腫瘤營養知識得分不高,平均得分41.26±23.68,及格率僅為35.31%[11]。進一步說明我國腫瘤患者營養不良是一個未被重視的嚴重問題。口腔癌雖然沒有食道癌、胃癌高發,但是口腔癌仍屬于消化道腫瘤的一種常見惡性腫瘤,病變以外生或潰爛方式多見,患者常伴有吞咽功能障礙[12-13]。根據現有研究理論可見口腔癌患者存在營養風險或營養不良是臨床常見現象。
營養支持治療的前提是營養不良的營養篩查、評估,臨床上常用的營養篩查量表包括營養風險篩查2002(NRS 2002)和患者主觀整體評估(PG-SGA)[14]。其中NRS 2002 是歐洲腸內營養學會推薦給住院患者使用的營養風險篩查方法,同樣是中華腸內腸外營養協會首推用于住院患者的篩查表[15-16],國內使用較普遍。因此,本研究采用此量表進行營養風險評估是可信的。
營養支持治療的內容包括營養教育和人工營養。人工營養分為普通營養支持治療和免疫營養支持治療[17]。以往營養支持治療研究側重的多為普通營養支持治療,側重于能量支持和蛋白支持,而忽略了免疫營養支持治療。崔久嵬等[18]就消化道腫瘤患者營養治療的應用持續時間及應用人群提出了建議,其中一致的 A 級推薦包括:無論營養狀況如何,接受胃腸道腫瘤手術的患者術前應用腸內免疫營養5~7天;術前營養不良的患者,術后若無不良反應應繼續應用免疫營養 5~7 d。這進一步強調免疫營養治療的重要性。本研究選用富含精氨酸、ω-3 脂肪酸和核苷酸的免疫營養制劑,這一營養制劑組合符合指南推薦的免疫營養制劑[19]。本研究結果表明圍手術期對口腔癌患者進行免疫營養支持治療可有效改善實驗室快速營養指標,能有效減少術后不良反應的發生而縮短住院時間。
4 結論
圍手術期對存在營養風險的口腔癌患者給予免疫營養支持治療,可改善圍手術期營養相關的快速變化的實驗室參數指標,可顯著縮短患者的住院時間,有效減少術后胃腸道并發癥的發生,有利于患者術后加速康復,可在臨床推廣應用。

