趨化因子受體2 和生長調節性基因α在食管鱗癌中的表達、臨床意義及相關性研究
范玉宏 周海豐 范 爽 王立坤 侯雅雄 劉 博
1.河北北方學院附屬第一醫院病理教研室,河北張家口 075000;2.河北北方學院附屬第一醫院普通外科,河北張家口 075000;3.河北北方學院研究生學院,河北張家口 075000;4.河北北方學院附屬第一醫院超聲醫學科,河北張家口 075000;5.河北北方學院附屬第一醫院病理科,河北張家口 075000
據最新流行病學調查顯示,我國食管癌發病率總體呈上升趨勢,2014 年我國居民食管癌新發病例數繼肺癌、胃癌、食管鱗癌、肝癌、乳腺癌之后位居第六,死亡例數繼肺癌、肝癌、胃癌位居第四,嚴重威脅國民健康安全[1-2]。我國食管癌90%以上為鱗癌,其早期篩查診斷、規范的治療方式和敏感的預后監測指標,對于患者的無病生存期(disease-free survival,DFS)、總生存期(overall survival,OS)的提高,生活質量的改善有著非常重要的影響[3]。因此,進行與食管癌相關的基礎研究,尤其是分子生物學研究,為臨床早期診斷提供準確度高、特異性強的標志物已成為臨床醫師的研究熱點。
早期研究證實,細胞CXCR2 主要影響骨髓來源單核細胞向中性粒細胞和髓源性抑制性細胞分化和募集,進而在炎癥誘導的惡性腫瘤發生中起重要作用;但近年發現,CXCR2 在肺癌、腎癌、黑色素瘤、胰腺癌、肝癌等人類諸多惡性腫瘤中表達量增高,發揮促進腫瘤發生、發展的致癌作用,但在食管鱗癌中的研究文獻極少[4-6]。GROα 是ELR+CXC 趨化因子,是CXCR2 的最強配體,表達與巨噬細胞、中性粒細胞和上皮細胞,并對中性粒細胞有較強的趨化作用。研究證實,GROα 在肺癌、乳腺癌、肝癌等腫瘤組織中呈高表達,但在食管鱗癌中的研究報道較少[7-9]。
本研究通過對食管鱗癌和癌旁正常食管組織中CXCR2、GROα 行實時熒光定量PCR(qRT-PCR)和免疫組織化學技術,旨在探討CXCR2、GROα 在食管鱗癌和癌旁正常組織中的表達情況,同時收集患者的臨床資料,分析二者的表達水平和相關臨床病理因素間的關系,為食管鱗癌的早期篩查診斷、治療評估和預后監測方面提供敏感度高、特異性強的分子標志物,同時為食管鱗癌的精準治療、靶向治療提供科研基礎。
1 資料與方法
1.1 一般資料
選擇2017 年1 月—2018 年6 月河北北方學院附屬第一醫院胸心外科食管癌手術切除后病理確診為食管鱗癌的組織70 例,其中男38 例,女32 例;年齡39~78,平均(59.1±6.4)歲;正常組織70 例(切緣距離癌組織>5 cm,且經病理證實為正常組織),同時收集患者完整的臨床資料。納入標準:病理證實為食管鱗癌,未接受化學治療、生物治療及放射治療等,臨床資料完整;排除標準:不符合食管鱗癌臨床診斷標準者,臨床資料不全或難以配合取材者,合并嚴重心、肝、腎功能異常者。本研究經患者及家屬知情同意,醫院醫學倫理委員會批準。
1.2 試劑與實驗方法
1.2.1 試劑和儀器 RNA 逆轉錄試劑盒(貨號:639505)、RNA 提取試劑盒(貨號:3735A)、PrimeScriptTMRT reagent 試劑盒(貨號:3733)均購自日本Takara 公司;CXCR2、GROα 和β-catenin 引物由上海生工有限公司設計合成,全自動電化學發光免疫分析儀(E2010)購自瑞士羅氏公司,DEPC 水購自美國sima 公司,兔抗人CXCR2 單克隆抗體(貨號:EPR22301-103)、兔抗人GROα 多克隆抗體(貨號:EPR21759-11)均購自美國ABCAM 公司,DAB 顯色試劑盒購自北京中杉公司。
1.2.2 qRT-PCR 取食管癌組織及癌旁正常組織各5 mg,按照試劑盒說明書提取癌組織和癌旁組織的總mRNA,測定總mRNA 濃度。取4 μL mRNA,反轉錄成cDNA,反轉錄條件為:25℃5 min,42℃15 min,85℃5 s。取2 μL cDNA 進行實時定量PCR 擴增,PCR 擴增引物:CXCR2 正向引物:5’-ATTCTGGGCATCCTTCACAG-3’,反向引物:5’-TGCACTTAGGCAGGAGGTCT-3’;GROα 正向引物:5’-CCGAAGTCATAGCCACACTCAA-3’,反向引物:5’-TGTTGCAGGCTCCTCAGAAATA-3’;GAPDH 作為內參,正向引物:5’-GGCTGCTTTTAACTCTGGTA-3’,反向引物:5’-ATGCCAGTGAGCTTCCCGT-3’。反應條件為:95℃1 min 預變性,1 個循環,94℃20 s 變性,55℃30 s 退火,72℃30 s延伸,5 個循環,94℃15 s,60℃30 s 收集熒光,40 個循環,采用ΔΔCt 相對定量法分析結果,差異水平用2-ΔΔCt表示。ΔΔCt=實驗組(Ct目的基因-Ct管家基因)-對照組(Ct目的基因-Ct管家基因)。
1.2.3 免疫組織化學法 將癌組織標本連續切片4 μm貼附于經多聚賴氨酸處理的玻片上,80℃烘烤50 min,光鏡下觀察切片中CXCR2、GROα 蛋白的表達和分布情況,每張切片選取5 個高倍視野(400×)。CXCR2、GROα 蛋白陽性均主要分布于細胞質和細胞膜中,均呈棕黃色顆粒。判斷標準:應用計算機圖像分析軟件Image J 觀察分析抽取結果,根據陽性細胞的平均灰度值和陽性面積百分比,給出4 種評分:3 分(強陽性)、2 分(陽性)、1 分(弱陽性)、0 分(陰性);分別對陽性細胞和陰性細胞進行計數。根據陽性細胞數占總細胞數的百分比評分,陽性細胞數<5%為0 分,6%~25%為1 分,26%~50%為2 分,>50%~75%為3 分,>75%為4 分,兩項評分的乘積為最終評分,總積分<3 分為陰性,總積分>3 分為陽性。
1.3 統計學方法
采用SPSS 17.0 對所得數據進行統計學分析,計量資料采用均數±標準差()表示,組間比較采用t檢驗;計數資料采用例數和百分率表示,組間比較采用χ2檢驗;qRT-PCR 結果用GraphPad Prism5 軟件進行分析和作圖;CXCR2 和GROα 蛋白表達與臨床病理特征的相關性用Spearman 檢驗分析。以P <0.05 為差異有統計學意義。
2 結果
2.1 CXCR2 和GROα mRNA 在食管癌組織和癌旁正常組織中的表達
食管鱗癌和癌旁正常組織中CXCR2 mRNA、GROα mRNA 表達:以目的基因與GAPDH 的比值作為qRT-PCR 相對定量分析結果,癌組織中CXCR2 mRNA、GROα mRNA 的表達水平明顯高于正常食管組織,差異有高度統計學意義(P <0.01)。見表1。
表1 CXCR2 和GROα mRNA 在食管癌組織和癌旁正常組織中的表達()
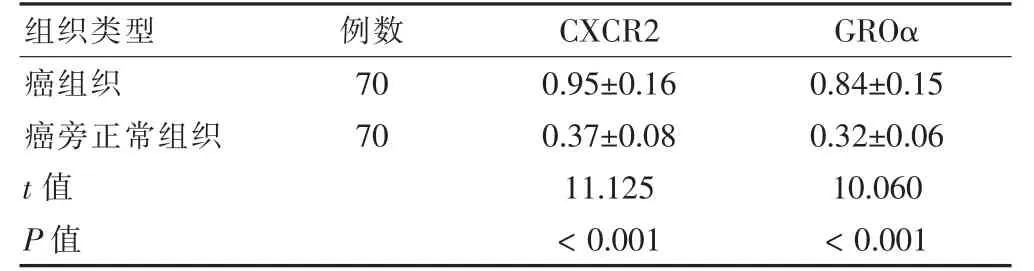
表1 CXCR2 和GROα mRNA 在食管癌組織和癌旁正常組織中的表達()
注:CXCR2:趨化因子受體2;GROα:生長調節性基因α
2.2 食管鱗癌和癌旁正常組織中CXCR2 和GROα蛋白的表達
免疫組化結果顯示癌組織中CXCR2 陽性表達為84.29%(59/70),明顯高于其在正常組織中的37.14%(26/70),癌組織中GROα 陽性表達為72.86%(51/70),明顯高于其在正常組織中的32.86%(23/70),差異均有高度統計學意義(χ2=18.441、16.508,均P <0.01)。見圖1。
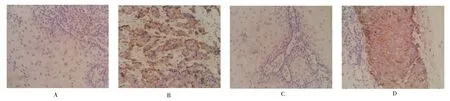
圖1 免疫組化檢測CXCR2、GROα 在正常食管組織和癌組織中的表達情況(SP,400×)
2.3 CXCR2 和GROα 蛋白的表達與食管鱗癌患者臨床病理特征的關系
CXCR2 和GROα 蛋白表達均與腫瘤的分化程度、TNM 分期、淋巴結轉移及肝轉移有關(均P <0.05),而與腫瘤大小無關(P >0.05),TNM 分期越高,二者的表達水平越高,伴淋巴結轉移、肝轉移的患者二者的表達水平明顯高于未轉移的患者(均P <0.05)。見表2。
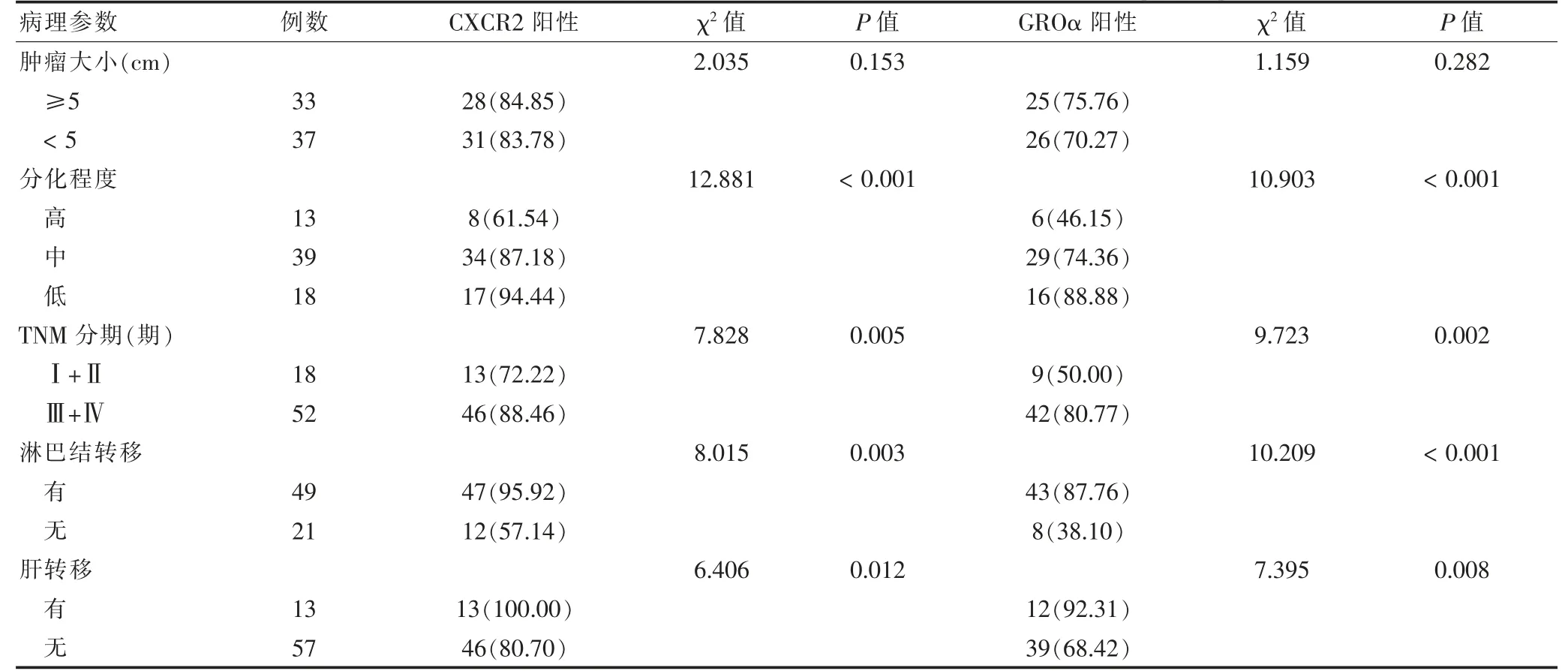
表2 CXCR2 和GROα 蛋白的表達與食管鱗癌患者臨床病理特征的關系[例(%)]
2.4 食管鱗癌組織中CXCR2 和GROα 蛋白表達的相關性
Spearman 檢驗結果顯示CXCR2 和GROα 蛋白表達呈正相關(r=0.476,P <0.01)。見表3。
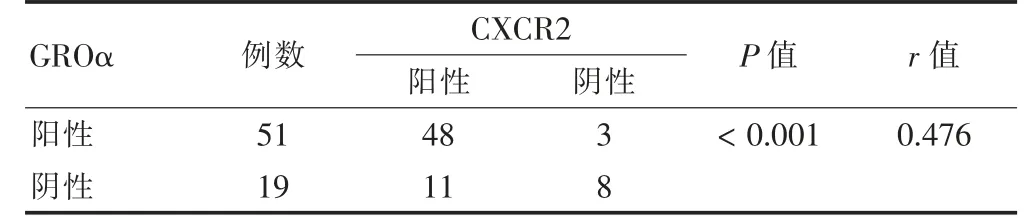
表3 食管鱗癌組織中GROα 和CXCR2 蛋白表達的相關性
3 討論
趨化因子受體可參與病原體的清除、炎癥反應、病原體感染、細胞及器官的發育、創傷的修復等病理生理過程,而且其與相應的配體結合能介導腫瘤細胞遷移和浸潤。目前,已有相關研究表明趨化因子與腫瘤的形成及其轉移相關,多種趨化因子均與腫瘤細胞所表達的相應受體有關[10]。
CXCR2 是趨化因子受體家族中的重要一員,最早由Holmes 和Murphy 克隆成功,CXCR2 基因定位于人染色體2q35 上,內含2 個內含子和3 個外顯子。CXCR2 蛋白全長約為350 個氨基酸,由1 個糖基化的N 末端和7 個富含疏水氨基酸跨膜區的結構組成[11]。CXCR2 是一種7 次跨膜的G 蛋白偶聯受體(GPCR),其在細胞內、外各有3 個結構域,每一個位于胞外的結構域均含有一個特定的半胱氨基酸殘基,而其中的一個N 末端結構域與配體的結合有關。由α、β 和γ3個亞基構成的鳥嘌呤核苷酸調節蛋白位于細胞膜內,CXCR2 完成信號轉導需依靠這種偶聯的G 蛋白[12-13]。
GRO 家族共3 個成員,GROα(CXCL1)、GROβ(CXCL2)和GROγ(CXCL3),其受體均為CXCR2,其中以GROα 與CXCR2 結合最強。GROα 基因定位于人染色體4q21,由3 個內含子和4 個外顯子構成。GROα cDNA 編碼73 個氨基酸,其效應與細胞生長相關[14]。GROα 與其受體CXCR2 結合后,參與機體炎癥、感染、創傷愈合等病理過程,此外,還能誘導在腫瘤的發生、演進。具體機制為:①直接促進腫瘤細胞的生長、遷移和轉移;②促進腫瘤血管形成、白細胞浸潤,為腫瘤的形成和發展提供必要的物質基礎[15]。
Xiang 等[16]研究證實,在胃癌組織中CXCR2 和GROα 蛋白的表達顯著高于正常組織,且與胃癌的浸潤程度、大小、TNM 分期、淋巴結和神經浸潤均有關,生存期研究顯示二者的表達水平與胃癌患者的預后呈正相關。Kasashima 等[17]研究證實,癌細胞中的GROα通過CXCR2 信號刺激了骨髓間充質細胞(BM-MC)向腫瘤基質的募集,癌細胞中GROα 的表達與T 細胞侵襲、淋巴結轉移、淋巴侵襲、靜脈侵襲、腹膜轉移及間質細胞CXCR2 表達相關。CXCR2 在基質細胞中的表達與組織學類型、T 細胞侵襲、淋巴結轉移、淋巴侵襲、浸潤、腹膜轉移和CD271 在基質細胞中的表達有關。GROα 和CXCR2 陽性癌癥患者的總體生存率較陰性癌癥患者低。胃癌細胞中GROα 表達和基質細胞中CXCR2 表達都是胃癌患者的獨立預后因素。Yung等[18]在卵巢癌中發現GRO-α 可通過CXCR2 受體激活TAK1/NFκB 信號傳導,通過shRNA 基因敲低、CXCR2 抑制劑SB225002 等方法處理,卵巢癌細胞中TAK1/NFκB 信號傳導顯著減弱,并降低體內外致癌和轉移的潛力,表明CXCR2 在GRO-α 控制的腹膜腔卵巢癌細胞的轉移擴散中起關鍵作用。這項研究強調了GRO-α 在腹膜腫瘤微環境中作為關鍵趨化因子的重要性,并建議將受體CXCR2 作為卵巢癌腹膜轉移的潛在治療靶標。Li 等[19]在肝癌組織中發現,GROα-CXCR2 軸能夠調節中性粒細胞的浸潤,而阻斷GROα-CXCR2 軸,中性粒細胞浸潤顯著減少,從而抑制肝癌細胞的轉移和復發。
本研究顯示,CXCR2 和GROα 在食管鱗癌組織中的表達明顯高于正常食管組織,提示食管黏膜在癌變的過程中,CXCR2 和GROα 相互作用,啟動趨化過程,從而介導腫瘤的發生;進一步研究顯示,在食管鱗癌中CXCR2 和GROα 表達水平與其分化程度、TNM分期、淋巴結和肝轉移均明顯相關,且二者表達呈明顯正相關,提示CXCR2 和GROα 相互結合,共同參與整個趨化過程,二者表達越高,病變越嚴重、預后越差。有研究證實[20-22],CXCR2 和GROα 結合后能激活機體腫瘤細胞內包括RAS、MAPK、AKT、NF-KB 等多個信號傳導途徑,同時誘導多種腫瘤相關因子的表達,如基質金屬蛋白酶(MMMP)-2、MMP-9 等,因而在腫瘤細胞的發生、侵襲、轉移過程中發揮重要作用[23-25]。
綜上,CXCR2 和GROα 的異常表達和食管鱗癌的發生、發展、浸潤及轉移密切相關,其具體的相互作用機制及相關通路需要進一步研究,這也將是本研究下一步努力的方向。

