血清氧化三甲胺與冠心病的相關性研究
婁煥堃 趙 玲 王怡練 孫黎明
1.蚌埠醫學院附屬連云港市第二人民醫院心血管內科,江蘇連云港 222006;2.蚌埠醫學院附屬連云港市第二人民醫院檢驗科,江蘇連云港 222006
心血管疾病(cardiovascular disease,CVD)死亡率居世界首位,高于腫瘤及其他疾病,占居民疾病死亡構成的40%以上[1]。研究表明,腸道菌群的代謝物氧化三甲胺(TMAO)與許多心血管疾病的發生有關[2-3]。TMAO 水平升高與心血管不良結局風險的增加密切相關,包括心臟病發作和死亡[4-6]。此外,TMAO 水平升高會促進血管炎癥和氧化應激[7-8],損害血管功能[9-10],并誘導動脈粥樣硬化[11]。本研究通過檢測冠心病(CHD)患者循環中的TMAO 表達水平進一步探討TMAO 與CHD 的相關性,為CHD 的防治提供新的思路。
1 資料與方法
1.1 一般資料
選取2019 年7 月—2020 年6 月于蚌埠醫學院附屬連云港市第二人民醫院(以下簡稱“我院”)心血管內科住院的CHD 患者98 例為CHD 組,另選擇同期我院體檢健康志愿者104 名為對照組。CHD 組中慢性穩定性勞力型心絞痛患者52 例、缺血性心肌病患者26 例、急性冠狀動脈綜合征之后穩定的病程階段患者20 例。
納入標準:符合《2018 年穩定性冠心病診斷與治療指南》[12],即指冠脈造影顯示1 支或1 支以上主要冠狀動脈(指左冠狀動脈主干,前降支,回旋支,右冠狀動脈)狹窄程度達到Ⅲ級或以上(Ⅲ級:51%<管腔面積縮小≤75%;Ⅳ級:75%<管腔面積縮小≤100%),包括慢性穩定性勞力型心絞痛、缺血性心肌病和急性冠狀動脈綜合征之后穩定的病程階段。排除標準:①年齡<18 歲;②處于妊娠前或妊娠中;③具有嚴重感染、肝腎功能不全、腫瘤、結核等重大疾病;④近1 個月內使用過益生菌、抗生素等影響腸道菌群活性的制劑;⑤沒有完整病例和血液標本。
本研究經我院醫學倫理委員會批準(批準編號:2020K003),所有入選者均簽署知情同意書。
1.2 方法
1.2.1 觀察指標 收集兩組一般資料,包括性別、年齡、身高、體重指數(BMI)、飲酒史、吸煙史、血糖、是否合并高脂血癥、尿酸、是否合并高血壓病。
1.2.2 樣本采集與儲存 兩組留取血液標本前均禁食6 h,在凌晨空腹狀態下抽取靜脈血4 mL,離心20 min(離心半徑:16 cm,離心速度:2000~3000 r/min)后將血清在-80℃條件下冷凍保存。
1.2.3 樣本檢測及TMAO 定量分析 采用雙抗體一步夾心法酶聯免疫吸附試驗(試劑盒由上海江萊生物科技有限公司提供,貨號:JL47698)。以標準物的濃度為橫坐標,光密度(OD)值為縱坐標,在坐標紙上繪出標準曲線,根據樣品的OD 值由標準曲線查出相應的濃度;再乘以稀釋倍數即為樣品的實際濃度。
1.3 統計學方法
采用SPSS 24.0 對所得數據進行統計學分析,計量資料采用均數±標準差()表示,組間比較采用t檢驗,計數資料采用例數或百分率表示,組間比較采用χ2檢驗。多因素分析采用logistic 回歸模型,采用Spearman 相關系數分析相關性。以P <0.05 為差異有統計學意義。
2 結果
2.1 兩組一般資料比較
兩組年齡、身高比較,差異無統計學意義(P >0.05)。CHD 組男性占比、BMI、吸煙占比、飲酒占比、血清TMAO、血糖、尿酸、合并高脂血癥、合并高血壓病占比均明顯高于對照組,差異均有統計學意義(均P <0.05)。見表1。
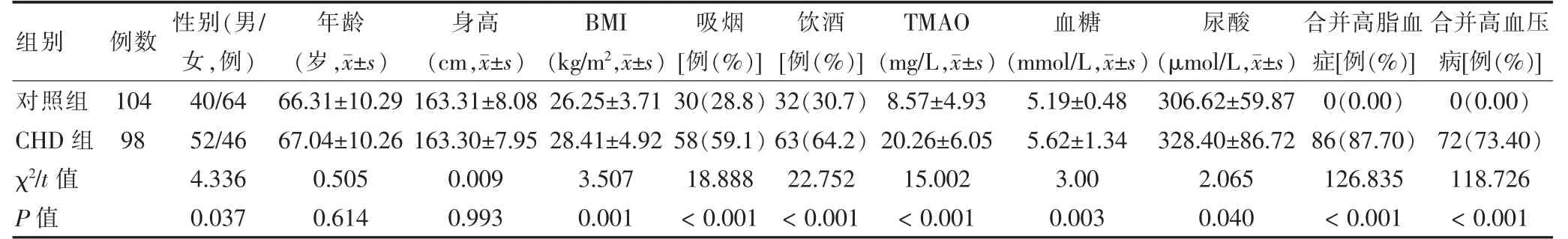
表1 兩組一般資料比較
2.2 CHD 影響因素的多因素logistic 回歸分析
以CHD 為因變量,賦值:有=1,無=2。以TMAO、BMI、血糖、高脂血癥、合并高血壓為自變量進行logistic 回歸分析(BMI、TMAO、血糖、尿酸為連續性變量,二分類變量賦值如下:男性=1,女性=2;吸煙=1,不吸煙=2;合并高脂血癥=1,無高脂血癥=2;合并高血壓病=1,無高血壓病=2),其中分析顯示高TMAO 水平、高BMI、高血糖水平、合并高脂血癥、吸煙史、合并高血壓病、高尿酸水平均是CHD 的危險因素(OR >1,P <0.05)。見表2。
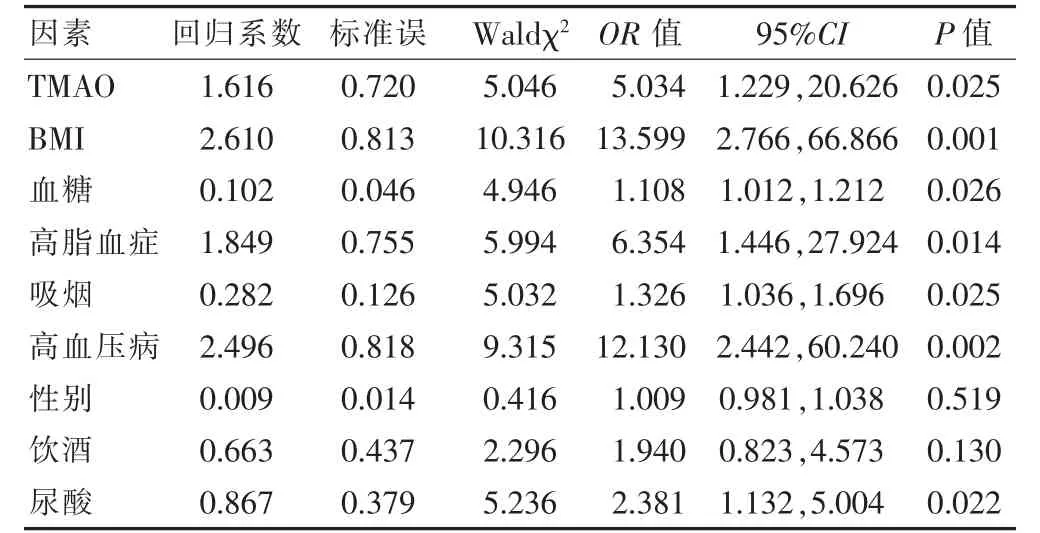
表2 CHD 影響因素的多因素logistic 回歸分析
2.3 TMAO 與CHD 嚴重程度的相關性分析
CHD 組中冠脈造影顯示1 支或1 支以上主要冠狀動脈狹窄程度達到Ⅲ級有65 例,達到Ⅳ級的有33 例,其平均血清TMAO 水平分別為(17.75±5.42)、(24.11±5.75)mg/L。相關性分析結果顯示TMAO 與CHD 嚴重程度呈正相關(rs=0.443,P <0.05)。
3 討論
根據《中國衛生和計劃生育統計年鑒(2017)》[13],自2012 年以來中國城市和農村居民CHD 死亡率保持上升趨勢。導致CHD 的病因除冠狀動脈粥樣硬化外(占95%~99%),還包括炎癥、栓塞等。研究發現,TMAO 與動脈粥樣硬化呈正相關[14-15]。TMAO 如何促進動脈粥樣硬化的機制尚不完全清楚,可能與以下機制有關:TMAO 可抑制膽固醇的反向轉運[16],還能刺激巨噬細胞募集。TMAO 可以通過增加細胞表面CD36 受體的表達和腫瘤壞死因子-α(TNF-α)、白細胞介素-6(IL-6)和細胞間黏附分子-1(ICAM1)的表達來加劇巨噬細胞膽固醇的積聚[17]。
本研究顯示CHD 組TMAO、BMI、吸煙占比、血糖水平、合并高脂血癥占比、合并高血壓病占比、尿酸水平均高于對照組,差異有統計學意義(P <0.05),提示TMAO 水平與傳統CHD 危險因素一樣是導致CHD的原因之一。多因素logistic 回歸分析證明了暴露于高TMAO 水平患CHD 的風險是一般人群的5 倍,進一步相關性分析顯示TMAO 水平與CHD 嚴重程度呈正相關。一項橫斷面研究[18]和一項隊列研究[19]發現,血清中高水平的TMAO 會增加心血管事件(死亡、心肌梗死)的風險。在動物模型中,證明額外補充TMAO是動脈粥樣硬化的直接誘因,其通過促進巨噬細胞膽固醇積累和泡沫細胞的形成,降低循環中TMAO 水平的干預措施可以在不同的動物模型中預防動脈粥樣硬化的發展[19-20]。這可能解釋了TMAO 水平在CHD患者中較高的原因。
綜上,TMAO 在促進動脈硬化[21]和上調炎癥因子[22-23]中扮演著重要的角色,將其作為一種新的生物標志物用于心血管疾病預防的可能性進一步增加。然而,有必要在未來進行進一步的大規模隨機對照研究,以確定TMAO 作為疾病標志物、致病因子和治療靶點的真正重要性。

