CTC、HER2 及PI3KCA 在轉移性乳腺癌中的表達
桑玉玉 喻海忠
江蘇省南通市中醫院檢驗科,江蘇南通 226001
乳腺癌在全球患病率、死亡率均較高[1]。研究表明每年全球乳腺癌新發確診病例約為130 萬,死亡人數約45 萬[2]。在歐美國家,乳腺癌在各類癌癥中的占比為25%~30%[3]。目前,我國乳腺癌患病率逐年增長,與此同時,其治療手段也逐漸增多,包括化療、放療、手術切除、生物細胞干預、靶向干預等,在一定程度上提升了遠期生存率。然而,即便如此,仍然有約33%的患者在5 年內發生病灶轉移,預后欠佳[4-5]。為了改善預后,臨床需采取措施及時發現轉移性腫瘤,并進行干預,但現有技術針對轉移性乳腺癌的檢出率較低。循環腫瘤細胞(CTC)既往被用于乳腺癌化療效果評估中,其能反映癌癥進展情況[6-7]。人類表皮生長因子受體2(HER2)過表達已被證實能增強乳腺癌侵襲性,與其進展過程密切相關[8]。磷脂酰肌醇-3-激酶催(PI3K)信號通路在腫瘤進展中大多處于失調狀態,這可致通路功能發生變化,誘發細胞轉化[9]。本研究旨在分析CTC 與HER2、PI3KCA 在轉移性乳腺癌中的表達意義,為該病診療提供依據,報道如下:
1 資料與方法
1.1 一般資料
選取江蘇省南通市中醫院(以下簡稱“我院”)2018 年4 月—2019 年6 月收治的轉移性乳腺癌患者50 例作為病例組,選取同期于我院體檢的健康婦女50 名作為正常組。病例組年齡36~85 歲,平均(56.90±10.03)歲;體重指數18~24 kg/m2,平均(21.01±0.84)kg/m2;病例類型:浸潤性導管癌34 例,非浸潤性導管癌16 例;內臟轉移:有8 例,無42 例;轉移灶數量1~3 個,平均(1.82±0.46)個。正常組年齡34~86 歲,平均(58.67±9.92)歲;體重指數18~24 kg/m2,平均(21.12±0.79)kg/m2。兩組一般資料比較,差異無統計學意義(P >0.05),具有可比性。研究方案獲得醫院醫學倫理委員會批準。
1.2 納入與排除標準
1.2.1 納入標準 ①病例組均經CT、MRI、病理穿刺證實為轉移性乳腺癌;②兩組均順利完成指標檢測,臨床資料完整;③所有受試者均知情同意。
1.2.2 排除標準 ①存在出血傾向,或因慢性炎癥等引起的難愈合傷口;②伴其他原發性腫瘤或血液系統病、器質性心臟疾病;③近3 個月內存在放療、化療史;④合并嚴重感染。
1.3 方法
所有納入者分別于就診/體檢當日采血測定各指標,在空腹狀態下,采集6 mL 肘靜脈血,分裝于3 個無菌試管內,每管2 mL。①CTC 檢測:取2 mL 靜脈血,在空腹狀態下采集。經微流芯片法檢測CTC,檢測過程直接在芯片內實現。首先,血樣進入芯片,取PBS沖洗液200 μL 對芯片予以沖洗。其次,取Triton x-100 PBS 液(濃度為0.2%)20 μL 加入芯片內,反應10 min,有助于細胞膜破裂。取清洗緩沖液200 μL 對芯片予以清洗,取20 μL 1%牛血清白蛋白對芯片進行處理,反應10 min,行免疫熒光染色。經倒置顯微鏡與配套軟件進行分析、觀察。②HER2 檢測:經化學發光法測定HER2 蛋白,取2 mL 血樣,離心半徑16 cm,轉速為3000 r/min,離心15 min,分離血清,化學發光免疫分析試劑盒由北京百奧萊博科技有限公司提供(貨號:ZN2161-KCJ),嚴格根據說明書完成各項操作,并進行質量控制。③CF-DNA 中PI3KCA 含量檢測:根據試劑說明書,使用德國QIAGEN 公司生產的Qiamp DNA 試劑盒(貨號:51504)分別從病例組和正常組血清中提取和純化游離DNA。同時,設計針對PI3KCA 短片段的上下游引物,序列如下,Fw:5’-CTCCACGACCATCATCATCAGGT-3’,Rev:5’-TGGTTAT-TAATG-AGCCTCACGG-3’。將樣本置于7500 實時熒光儀托盤中,在95°C 90 s;40 個循環,95°C 15 s;54°C 45 s 的條件下擴增。將已知濃度的人類基因組DNA標準品進行梯度稀釋,構建標準曲線,用于推算樣品量。當重復樣本之間的差異大于1 個周期閾值時,重復分析。在相同的8 個樣品上分別進行2 次實時實驗,以測試分析不精確性。然后計算PI3KCA 短片段的變異系數。④血清癌胚抗原(CEA)、糖類抗原15-3(CA15-3):經化學發光法測定,試劑盒由上海撫生實業有限公司提供(貨號:FS17620),根據說明書操作。
1.4 統計學方法
采用SPSS 20.0 軟件進行數據分析,計量資料用均數±標準差()表示,采用t 檢驗;計數資料用例數百分比(%)表示,采取χ2檢驗;經Kappa 檢驗分析相關指標診斷與病理診斷一致性;經Pearson 線性模型分析CTC、HER2 蛋白量、CF-DNA 中的PI3KCA 含量與CEA、CA15-3 的相關性。以P <0.05 為差異有統計學意義。
2 結果
2.1 兩組CTC、HER2、CF-DNA 中PI3KCA 含量表達比較
病例組CTC、HER2 以及CF-DNA 中PI3KCA CFDNA 含量均高于正常組,差異有統計學意義(P <0.05)。見表1。
表1 兩組CTC、HER2、CF-DNA 中PI3KCA 含量比較()
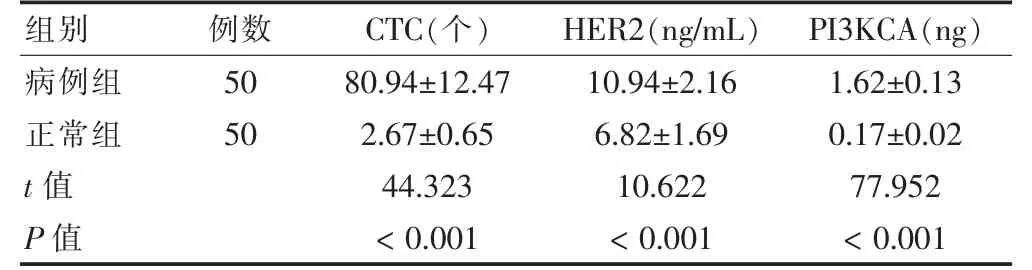
表1 兩組CTC、HER2、CF-DNA 中PI3KCA 含量比較()
注:CTC:循環腫瘤細胞;HER2:人類表皮生長因子受體2;PI3KCA:磷脂酰肌醇-3-激酶催化亞單位α
2.2 CTC、HER2、CF-DNA 中PI3KCA 含量聯合診斷與病理診斷一致性分析
三者聯合診斷轉移性乳腺癌的靈敏度為86.00%,特異度為90.00%,準確率為88.00%,陽性預測值為89.58%,陰性預測值為86.54%,與病理診斷一致性為0.760(高度一致)。見表2。
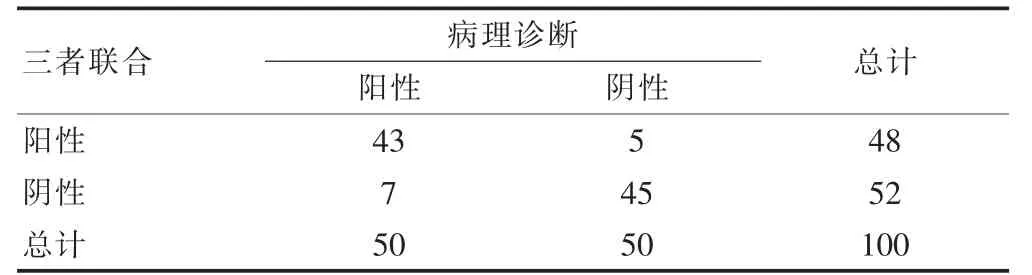
表2 CTC、HER2、CF-DNA 中PI3KCA 含量聯合診斷與病理診斷一致性分析(例)
2.3 兩組血清CEA、CA15-3 含量比較
病例組血清CEA、CA15-3 含量顯著高于正常組,差異有統計學意義(P <0.05)。見表3。
表3 兩組血清CEA、CA15-3 含量比較()
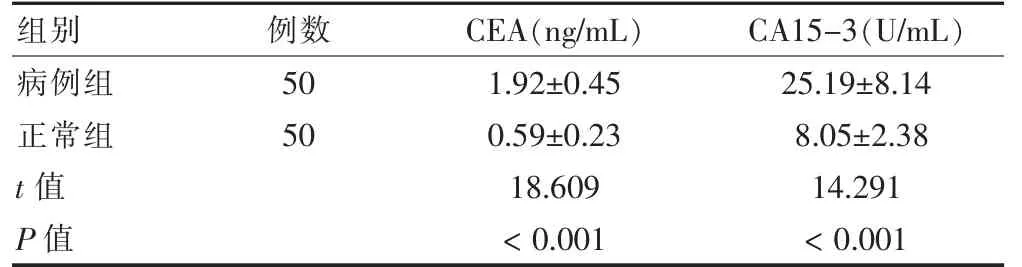
表3 兩組血清CEA、CA15-3 含量比較()
注:CEA:癌胚抗原;CA15-3:糖類抗原15-3
2.4 CTC、HER2、CF-DNA 中PI3KCA 含量與血清CEA、CA15-3 的相關性
Pearson 分析提示CTC 與血清CEA、CA15-3 呈正相關(r=0.752、0.801,均P <0.05);HER2 與血清CEA、CA15-3 呈正相關(r=0.691、0.702,均P <0.05);CF-DNA 中PI3KCA 含量與血清CEA、CA15-3 呈正相關(r=0.628、0.611,均P<0.05)。
3 討論
乳腺癌在女性癌癥患者中死亡率約達14%。雖然臨床針對該病的診療水平較過去明顯提升,但仍然有部分病例經輔助干預后,病灶出現復發、轉移,演變成進展期乳腺癌,增加治療難度[10-12]。轉移性乳腺癌死亡率高,既往行常規MRI、CT 等檢查,雖然對病情診斷有一定價值,但無法了解治療靶點是否發生變化,難以為靶向干預提供依據[13]。因此,臨床需尋求有效指標為其診療提供依據。
本研究顯示,與正常組比較,病例組的CTC、HER2以及CF-DNA 中PI3KCA 表達量明顯增高。CTC 是原發病灶或轉移病灶脫落所致的一類細胞,可通過生物學行為進入血液內[14]。研究表明癌癥患者在化療前,CTC 數量較多,其在外周血中處于較高表達水平,經化療后,CTC 數量明顯減少[15]。另有研究認為CTC 表達與癌癥患者預后密切相關,其表達越高,則生存率越低,表達越低,預后往往越好[16]。研究指出健康者未能檢測到CTC[17]。本研究則發現正常組中也檢出CTC,這可能是因操作過程中受客觀因素干擾所致,未來將對此進行更深入的論證。HER2 已被證實在乳腺癌患者中陽性率較高,且在病灶復發環節中,HER2 狀態發生明顯變化[18-20]。HER2 在血清中表達增高表明病灶具備更強侵襲性,其對化療效果具有一定預測價值[21]。有研究者針對乳腺癌患者進行研究,提示分期越高,HER2 在血清中表達程度越高[22]。這也證實HER2 表達與乳腺癌進展程度密切相關,對該病進展有較高評估價值。PI3K-AKT 信號通路激活對腫瘤細胞有調節作用,它與病灶侵襲轉移密切相關[23]。研究表明乳腺癌復發者的PI3K 陽性率高于非復發者[24]。此外,有學者證實PI3K-AKT 路徑激活可導致機體對化療藥物耐藥性的形成,影響療效[25]。在本研究中,筆者針對上述三項指標進行分析,證實三者在轉移乳腺癌中表達增高,臨床需引起重視。
筆者發現三者聯合診斷時效果更顯著,與病理結果一致性較高。血清CEA、CA15-3 是評價惡性腫瘤的常用指標,對腫瘤性質鑒別有重要意義。研究表明乳腺癌患者血清CEA、CA15-3 含量能反映化療效果[26-28]。筆者發現與CTC、HER2、PI3KCA 與血清CEA、CA15-3含量均有相關性。因此,未來可根據CTC、HER2、PI3KCA表達的變化,推測血清CEA、CA15-3 含量的變化。
綜上,轉移性乳腺癌患者的CTC、HER2、CF-DNA中PI3KCA 表達水平較正常者明顯增高,三者均能作為預測該病的重要指標,與病理診斷一致性良好,與血清CEA、CA15-3 含量存在相關性。此外,本研究也有不足,如未分析三者對患者遠期預后的影響,未來將對此予以探討。

