5-氮雜-2'-脫氧胞苷對食管癌放射敏感性的影響及作用機制
張翠紅,呂 欣,范 才,侯春立,馬博敬,張建軍
放射治療是食管癌一種重要、有效的治療手段,約80%的患者需接受放射治療[1-2]。然而腫瘤細胞對放射線抗拒是抗腫瘤治療失敗的主要原因之一[3],所以如何提高腫瘤細胞對放射線的敏感性,在提高腫瘤局部控制率的同時降低放射線對正常組織的毒性作用是食管癌放射治療的重要研究課題。5-氮雜-2'-脫氧胞苷(5-aza-CdR)屬于核苷類似物甲基化抑制劑,不僅可以抑制DNA甲基轉移酶,降低細胞分裂時DNA甲基化水平,還可以干擾RNA代謝、DNA和蛋白質合成[4-6]。研究表明,5-aza-CdR可通過與DNA甲基轉移酶1共價結合形成復合物,進而抑制該酶甲基轉移活性,逆轉CpG島異常甲基化、恢復腫瘤抑制因子表達,起到抑制腫瘤作用[7]。最近研究發現,5-aza-CdR可能與腫瘤的放射敏感性有密切關系[8]。但目前有關5-aza-CdR在食管癌放射敏感性方面的研究甚少。故本研究以5-aza-CdR作用于人食管癌細胞株EC9706,研究其對食管癌細胞增殖、凋亡、侵襲及放射敏感性的影響。
1 材料與方法
1.1材料和主要試劑
1.1.1食管癌細胞株:人食管癌EC9706細胞購自中國細胞資源庫,用含10%胎牛血清、青霉素100 U/ml、鏈霉素100 μg/ml的DMEM培養基在37℃、5%CO2培養箱中培養,用0.25%胰蛋白酶消化傳代。取第二、三代對數生長期細胞進行實驗。
1.1.2藥物及主要試劑、儀器:5-aza-CdR購自上海研謹生物有限公司;DMEM培養基及胎牛血清購自美國Gibco公司;CCK8試劑購自武漢默沙克生物科技有限公司;Annexin V-FITC/PI雙染細胞凋亡試劑盒購自美國BD公司;一抗cleaved caspase-3、Bax、Bcl-2、p-ATM/ATM、β-actin及二抗購自美國Cell Signaling Technology公司;細胞裂解及蛋白抽提試劑、蛋白濃度檢測試劑考馬斯亮藍、Western blot配膠試劑盒購自江蘇碧云天生物技術有限公司;聚偏二氟乙烯膜、ECL發光液購自美國Millipore公司。Transwell小室購自美國Millipore公司;Matrigel購自美國BD公司。流式細胞儀購自美國BD公司。
1.2實驗方法
1.2.1細胞分組及照射方法:將實驗細胞分為4組:①對照組(Control組):不做任何處理;②5-aza-CdR處理組:予不同濃度(0、0.50、1.00、1.50及3.00 μmol/L)5-aza-CdR處理細胞;③單純照射組(RT組):僅予射線照射;④照射+5-aza-CdR處理組(RT+5-aza-CdR組):予5-aza-CdR處理細胞48 h后行射線照射。5-aza-CdR用磷酸鹽緩沖溶液(PBS)溶解,對照組用等量PBS液處理。培養12 h細胞貼壁后,室溫下采用6 MV-X射線照射。
1.2.2CCK-8法測定5-aza-CdR對EC9706細胞毒性及照射后增殖抑制的影響:取對數生長期EC9706細胞,胰蛋白酶消化制成細胞懸液,接種于96孔細胞培養板中(2.0×103/孔),細胞貼壁后加入不同濃度5-aza-CdR,每個濃度設3個復孔,細胞培養箱中繼續培養48 h后,棄去舊培養基,加入100 μl新鮮無血清培養基,然后各孔加入CCK-8溶液10 μl,放入37℃孵箱繼續培養4 h,用酶標儀檢測450 nm波長處的吸光度,計算細胞增殖抑制率。增殖抑制率(%)=[1-(吸光度實驗/吸光度對照)]×100%。實驗重復3次。采用相同方法檢測5-aza-CdR對EC9706細胞放射敏感性,將接種細胞分為Control組、RT組(射線照射劑量2、4、6、8及10 Gy)和RT+5-aza-CdR組,每組設置3個復孔。培養24 h后,RT+5-aza-CdR組細胞加入1.00 μmol/L 5-aza-CdR;2 h后,RT組和RT+5-aza-CdR組細胞分別接受不同劑量射線照射,繼續培養48 h,按照CCK-8法檢測吸光度值,計算細胞增殖抑制率和放射增敏比(SER)。SER=RT組D0/RT+5-aza-CdR組D0,D0為細胞增殖活性下降50%時的放射劑量,即半數致死劑量。實驗重復3次。
1.2.3Western blot檢測相關蛋白表達:收集RT組和RT+5-aza-CdR組細胞,加入PMSF細胞裂解液,提取蛋白。考馬斯亮藍法檢測蛋白濃度,加熱使蛋白變性,10%十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離,轉膜,血清密閉,分別加入cleaved caspase-3(1︰1000稀釋)、Bax抗體(1︰1000稀釋)、Bcl-2抗體(1︰500稀釋)、ATM/p-ATM抗體(1︰1000稀釋)、β-actin抗體(1︰20 000稀釋),置于4℃搖床過夜。次日TBST反復沖洗,加入二抗(1︰5000稀釋)。ECL試劑顯影,拍照。實驗重復3次。
1.2.4流式細胞儀檢測細胞周期:細胞以每皿3×105個的密度接種于25 cm2培養皿中,貼壁后分為RT組和RT+5-aza-CdR組,繼續培養24 h后收集細胞,細胞周期檢測按試劑盒說明進行操作,用流式細胞儀進行檢測。
1.2.5Transwell小室侵襲實驗檢測5-aza-CdR對EC9706細胞照射后的侵襲能力:用DMEM培養液將Matrigel按1︰6稀釋,取80 μl稀釋液加入到Transwell小室上室,37℃培養箱中過夜。收集RT組和RT+5-aza-CdR組細胞,胰蛋白酶消化制備成1×105/ml細胞懸液,接種于已鋪基質膠的Transwell小室上室,鋪勻,下室加入含20%胎牛血清的DMEM培養液600 μl,在5% CO2、37℃培養箱中培養24 h,取出Transwell小室,用棉簽拭去聚碳酸酯膜表面的Matrigel膠,PBS液沖洗,4%多聚甲醛固定20 min,0.1%結晶紫染色30 min,PBS液沖洗晾干,光學顯微鏡下觀察并拍照。實驗重復3次。
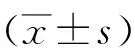
2 結果
2.15-aza-CdR對人食管癌EC9706細胞的毒性作用 CCK-8法檢測結果顯示,不同濃度(0、0.50、1.00、1.50及3.00 μmol/L)5-aza-CdR處理后,細胞增殖活性受到明顯抑制,分別為(0.68±0.07)%、(0.80±0.10)%、(1.13±0.32)%、(13.33±4.16)%及(38.33±7.64)%。0、0.50及1.00 μmol/L 5-aza-CdR對EC9706細胞增殖抑制作用基本一致,經單因素方差分析,差異無統計學意義(P>0.05);1.00、1.50及3.00 μmol/L 5-aza-CdR對EC9706細胞增殖抑制率經單因素方差分析,差異有統計學意義(P<0.01),且進一步兩兩比較差異亦有統計學意義(P<0.05)。見圖1。可見1.00 μmol/L是5-aza-CdR無毒的最高劑量,故為排除5-aza-CdR本身對細胞增殖抑制的影響,本研究選擇1.00 μmol/L為實驗濃度行放射敏感性研究。

圖1 不同濃度5-aza-CdR對人食管癌EC9706細胞的毒性作用
2.25-aza-CdR對人食管癌EC9706細胞照射后增殖活性的影響 CCK-8法檢測顯示,不同放射劑量(2、4、6、8及10 Gy)照射后,細胞增殖活性受抑制,D0為6.897 Gy。而不同照射組細胞予5-aza-CdR預處理后,各組細胞增殖抑制率經析因設計的雙因素方差分析,處理因素5-aza-CdR的主效應比較差異有統計學意義(P<0.01),處理因素放射線的主效應比較差異有統計學意義(P<0.01),二者交互作用比較差異無統計學意義(P>0.05)。故無論是否予5-aza-CdR預處理,經不同放射劑量照射后,細胞增殖活性均受抑制;而予5-aza-CdR預處理后,能增強放射線對EC9706細胞增殖活性的抑制作用。RT組D0為6.016 Gy,RT+5-aza-CdR組D0為4.506 Gy,SER為1.335±0.04。見表1,圖2。

表1 2組人食管癌EC9706細胞經不同放射劑量照射后細胞增殖抑制率的變化

圖2 2組人食管癌EC9706細胞經不同放射劑量照射后細胞增殖抑制率的變化
2.35-aza-CdR對人食管癌EC9706細胞照射后凋亡的影響 RT+5-aza-CdR組細胞培養48 h后,凋亡相關蛋白cleaved caspase-3和Bax相對表達量較RT組明顯升高(P<0.01),抗凋亡蛋白Bcl-2相對表達量較RT組降低(P<0.01)。見表2,圖3。

圖3 5-aza-CdR對人食管癌EC9706細胞照射后cleaved caspase-3、Bax和Bcl-2蛋白表達的影響

表2 2組人食管癌EC9706細胞cleaved caspase-3、Bax及Bcl-2蛋白相對表達量變化
2.45-aza-CdR對人食管癌EC9706細胞照射后細胞周期的影響 流式細胞術結果顯示,RT組(4 Gy)和RT+5-aza-CdR組G0/G1期、S期和G2/M期細胞比例比較,差異有統計學意義(P<0.05或P<0.01)。見圖4。與RT組比較,RT+5-aza-CdR組G0/G1期和S期細胞減少(P<0.05或P<0.01),而G2/M期細胞增多(P<0.01)。見表3。

表3 5-aza-CdR對人食管癌EC9706細胞照射后細胞周期的影響

圖4 5-aza-CdR對人食管癌EC9706細胞照射后細胞周期的影響
2.55-aza-CdR對人食管癌EC9706細胞照射后DNA損傷修復的影響 EC9706細胞在照射后1 h p-ATM蛋白表達明顯增加,隨著時間推移,表達逐漸下降;RT+5-aza-CdR組照射1、24、48 h與RT組EC9706細胞中p-ATM蛋白表達比較差異無統計學意義(P>0.05)。說明5-aza-CdR不是通過抑制DNA損傷修復來增加細胞放射敏感性的。見圖5。

圖5 5-aza-CdR對人食管癌EC9706細胞照射后DNA損傷修復的影響
2.65-aza-CdR對人食管癌EC9706細胞照射后侵襲能力的影響 Transwell小室侵襲實驗結果顯示,RT+5-aza-CdR組細胞的侵襲能力發生了改變,與RT組相比,RT+5-aza-CdR組穿膜細胞數量明顯減少,差異有統計學意義(P<0.01)。提示5-aza-CdR可明顯增加放射線抑制食管癌細胞侵襲的能力,提高放射敏感性。見圖6。

圖6 5-aza-CdR對人食管癌EC9706細胞侵襲能力的影響
3 討論
放射治療是食管癌常用、有效的治療手段,治療原理為利用電離輻射誘導細胞核DNA損傷甚至雙鏈斷裂,從而促進腫瘤細胞凋亡[9-11]。多年臨床實踐證實,不同患者對放射線的敏感性和耐受性差異較大,是導致局部治療失敗和影響患者預后的主要原因[12]。因此,如何改善食管癌細胞的放射敏感性,是提高食管癌患者放射治療效果、減少局部復發及實現個體化治療的有效策略[13]。
5-aza-CdR作為胞嘧啶類似物,不僅表現出顯著的去甲基化作用,而且具有直接的抗腫瘤作用[14-17],雖然其臨床應用較為廣泛,但是在食管癌放射敏感性方面的研究卻較少見。蔡銳等[18]研究發現,5-aza-CdR可增加鼻咽癌細胞株C666-1的放射敏感性。Hu等[19]研究發現,5-aza-CdR可提高子宮內膜癌細胞對孕酮治療的敏感性。除此之外,Füller等[20]發現5-aza-CdR通過改變DNA甲基化,在急性白血病和非小細胞肺癌治療過程中,可以與多種化療藥物產生協同效應而提高療效。以上研究提示我們,5-aza-CdR在調節腫瘤細胞多種生物學行為、功能改變及放化療敏感性方面發揮重要作用。因此,探究5-aza-CdR在食管癌治療中的作用,有可能為尋求更佳治療手段提供新的思路和方法。
在本研究中,我們首先通過CCK-8法確定5-aza-CdR最高無毒劑量為1.00 μmol/L。因此,在后續實驗中初步選定1.00 μmol/L作為5-aza-CdR的用藥劑量。進一步在放射線照射前2 h予1.00 μmol/L 5-aza-CdR預處理,后采用CCK-8法檢測證實1.00 μmol/L 5-aza-CdR可增強不同照射劑量對EC9706細胞增殖的抑制作用,SER為1.335±0.04。
藥物增加腫瘤細胞放射敏感性的機制一般與誘導腫瘤細胞凋亡、影響細胞周期進程和DNA損傷修復密切相關[21]。Bcl-2蛋白家族和cleaved caspase-3都屬于重要的細胞凋亡相關蛋白。Bcl-2屬于抗凋亡因子,可以抑制線粒體細胞色素C的釋放,而Bax為促凋亡蛋白,可以誘導線粒體釋放細胞色素C,從而啟動細胞凋亡[22]。當Bcl-2表達增強時,其與Bax形成異源二聚體,從而抑制細胞凋亡[23-25]。所以我們進一步從凋亡蛋白分子水平分析5-aza-CdR對EC9706細胞放射敏感性的影響。結果顯示:5-aza-CdR聯合射線照射處理EC9706細胞后,cleaved caspase-3和Bax表達較單純照射處理明顯升高,Bcl-2表達明顯降低。既往研究發現,在骨肉瘤細胞株SaOS2、HOS和U2OS中,5-aza-CdR通過調節細胞周期和增加細胞凋亡來增加放射敏感性,提示5-aza-CdR可能是提高骨肉瘤治療效果的潛在放射增敏劑[26]。Qiu等[27]利用5株胃癌細胞株(OCUM-2M、OCUM-12、KATO-Ⅲ、MKN-45和MKN-74)觀察5-aza-CdR聯合照射對胃癌細胞生長活性、細胞周期分布及凋亡相關基因表達的影響,結果發現在5-aza-CdR聯合照射明顯降低了OCUM-2M、OCUM-12和MKN-45細胞的生長活性,而G2/M期細胞百分率和細胞凋亡率均升高。進一步研究發現,在5-aza-CdR聯合射線照射干預下,G0/G1期和S期細胞減少,而G2/M期細胞增多。p-ATM與DNA損傷相關,當DNA損傷時,ATM激酶被激活,使其下游的反應元件發生磷酸化,導致細胞在細胞周期關卡處停滯分裂,使損傷的DNA獲得修復的時間,若修復失敗則細胞進入凋亡過程。本研究結果顯示,p-ATM蛋白表達隨著時間的推移無明顯差異。最后,我們探究了5-aza-CdR聯合射線照射對EC9706細胞侵襲能力的影響,結果發現5-aza-CdR聯合射線照射使EC9706細胞的穿膜數量明顯減少,侵襲能力下降。以上結果說明5-aza-CdR不是通過抑制DNA損傷修復來提高放射敏感性的,而是通過升高射線照射后細胞凋亡率、影響細胞周期和增強放射線抑制細胞侵襲的能力,從而提高食管癌細胞放射敏感性。然而5-aza-CdR是通過調節細胞甲基化狀態還是通過其他途徑誘導細胞凋亡,還需進行深入研究。
綜上所述,1.00 μmol/L 5-aza-CdR可增加人食管癌EC9706細胞放射敏感性,其作用機制可能與5-aza-CdR能增加放射線誘導的細胞凋亡、抑制細胞增殖、影響細胞周期及增強放射線抑制細胞侵襲的能力有關,為5-aza-CdR用于放射治療增敏提供一定的實驗依據,但是其是否可以作為放射治療增敏劑用于臨床,尚需要更全面、更系統的實驗研究。

