PEG引發對小冠花種子萌發及幼苗生理特性的影響
富波年,馬樂元,馬慧霞,何仁元,楊曉燕
(甘肅農業大學 資源與環境學院,甘肅 蘭州 730070)
種子萌發及幼苗建成是植物生命周期的關鍵時期。種子在貯藏過程中,會受自身或外界環境的影響而發生劣變,從而導致種子萌發及幼苗生長能力下降,甚至死亡[1]。種子引發是通過控制種子吸水速率和吸水量,并逐步回干使其處于預發芽代謝狀態的一項技術[2]。有研究表明,引發處理使種子達到胚根即將突破種皮時的早期萌發狀態,可提高種子活力,促進種子萌發和幼芽生長[3-5]。聚乙二醇(polyethylene glycol,PEG)是一種高分子滲壓劑,其本身不能滲入種子細胞中。用PEG浸種處理可使種子處于低水勢的介質中,從而降低種子萌發過程中水分進入的速度,提高種子的出苗率及整齊度,縮短出苗期[6],尤其對于不易萌發的種子(硬實度高、未成熟及老化種子)的促進效果顯著[7-8]。
小冠花(Coronillavaria)為豆科多年生草本植物,是優良的飼用、水土保持、公路護坡、觀賞及綠肥植物,主要種植在我國西北干旱區域[9-10]。其種子硬實率高,發芽率低,發芽時間長,出苗率低且參差不齊[11-12],已成為限制小冠花推廣種植的主要因素[13]。目前PEG引發處理提高種子活力,促進種子萌發和幼芽生長已在小麥[14]、燕麥[7]、穿心蓮[15]以及油菜[16]等多種植物種子的研究中得到證實。本研究用不同濃度PEG引發處理小冠花種子,從種子萌發、幼芽生長,滲透調節物質含量及抗氧化酶活性等角度,研究PEG引發處理對小冠花種子萌發及幼芽生長的影響,為PEG引發技術在小冠花栽培種植上提供基礎數據,也為種子引發技術應用于農業生產提供實踐依據。
1 材料和方法
1.1 供試材料
供試小冠花品種為綠寶石(LBS)和西輻(CY),由甘肅創綠草業科技有限公司提供。本試驗在甘肅農業大學資源與環境學院旱區生態研究所進行。
1.2 試驗設計
(1)供試小冠花種子,先用10%NaClO消毒10 min,用蒸餾水沖洗數次,再用吸水紙吸干待用[17]。在預試驗的基礎上,共設10個處理,每個處理6個重復。以沒有處理的原始種子作為對照(CK),將小冠花種子分別置于0%(蒸餾水)和10%、20%、30%的PEG溶液中,種子重量與溶液體積比為1∶5 [(W(g)∶V(mL)],在25℃的發芽箱內培養12 h,用蒸餾水將種子上的PEG溶液洗凈、濾紙吸干,攤在發芽紙上移入25℃的鼓風干燥箱,回干至原種子質量,密封于常溫下待用。

表1 實驗處理方案
(2)采用培養皿濾紙法進行種子萌發實驗。挑選兩個品種飽滿、大小一致的引發和對照(CK)處理小冠花種子,置于底部墊有兩層發芽紙的標準發芽培養皿,每個培養皿放入60粒種子,加入10 mL蒸餾水,加蓋,置于種子發芽箱,8 h光照、16 h黑暗,光子量照度300 μmol/(m2·s),溫度為25℃,相對濕度為70%,進行發芽試驗[18]。每2 d定量補加蒸餾水,使其保持濕潤。每天統計發芽率,共統計10 d(根據預實驗此時種子已經停止萌發),并測定種子萌發指標。選引發處理后萌發效果最佳的處理(10%PEG引發)測定幼芽生理指標。
1.3 測定指標及方法
1.3.1 種子萌發指標和幼苗生長指標 種子萌發以胚根0.2 cm作為發芽標準,處理第4 d統計發芽勢(GE),第9 d統計發芽率(GP),并計算發芽指數(GI)和活力指數(VI)。其中:發芽率(GP)=9 d發芽種子數/測試種子總數×100%,發芽勢(GE)=前4 d發芽種子數/種子總數×100%,發芽指數(GI)=∑(Gt/Dt),活力指數(VI)=GI×S[19](Gt為第t天的發芽數,Dt為相應發芽的天數,S為第9 d幼芽鮮重)。萌發9 d時,測量幼芽的生長指標,每處理隨機抽取20株幼芽,用精度0.01 mm的游標卡尺測量胚根尖到子葉端的長度。
1.3.2 幼芽生理指標測定 取發芽試驗第10 d的CK處理和用10%PEG處理的幼芽進行生理指標測定。
滲透調節物質含量測定:可溶性蛋白含量采用考馬斯亮藍G-250比色法測定;脯氨酸含量采用酸性茚三酮法測定[20];可溶性糖含量采用蒽酮比色法測定[21]。
電解質滲透率(電導率)用DDS-11A型電導儀測定幼芽外滲液電導率值[22]。
超氧化物歧化酶(SOD)活性采用氮藍四唑法測定;過氧化氫酶(CAT)活性采用紫外分光光度法測定;過氧化物酶(POD)活性采用愈創木酚比色法測定[22]。
1.4 數據分析
采用SPSS 19.0軟件進行數據分析,采用單因素法進行差異顯著性分析,使用最小顯著差異法(least significant difference,LSD)在0.05顯著性水平進行差異顯著性分析,利用Excel 2016軟件作圖。
2 結果與分析
2.1 PEG引發對小冠花種子萌發的影響
PEG處理下2個小冠花品種的種子發芽勢、發芽率和發芽指數較CK顯著增高(圖1~3),隨著PEG濃度的增加,兩個品種的各萌發指標呈現先升高后降低的趨勢,其中10%PEG處理效果最佳。10%PEG處理下,綠寶石(LBS)和西輻(CY)小冠花的發芽勢、發芽率、發芽指數分別比CK高550.06%、29.31%、74.54%和229.52%、25.42%、50.23%,且差異顯著(P<0.05)。30%PEG處理下,綠寶石(LBS)和西輻(CY)小冠花種子發芽勢較10%PEG處理顯著降低了55.03%和25.51%(P<0.05),發芽率和發芽指數有所降低但未達到差異顯著水平。PEG處理下,綠寶石(LBS)小冠花種子活力指數較CK顯著提高了88.09%、75.07%和95.38%(圖4),西輻(CY)小冠花種子活力指數也有提高但差異不顯著(P<0.05)。

圖1 PEG處理下小冠花種子的發芽勢Fig.1 Effects of PEG treatments on the germination vigour of Coronilla varia注:不同小寫字母表示差異顯著(P<0.05),下同
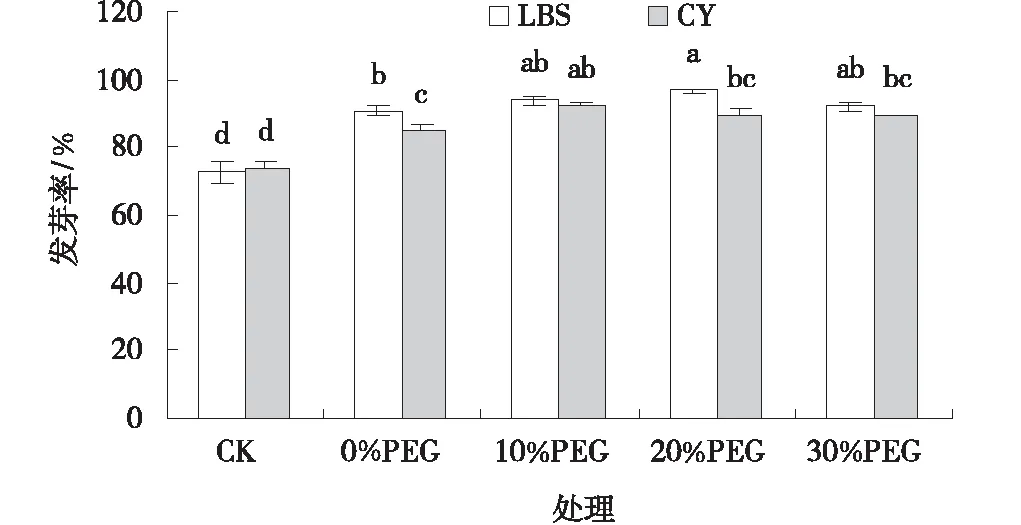
圖2 PEG處理下小冠花種子的發芽率Fig.2 Effects of PEG treatments on the germination percentage of Coronilla varia
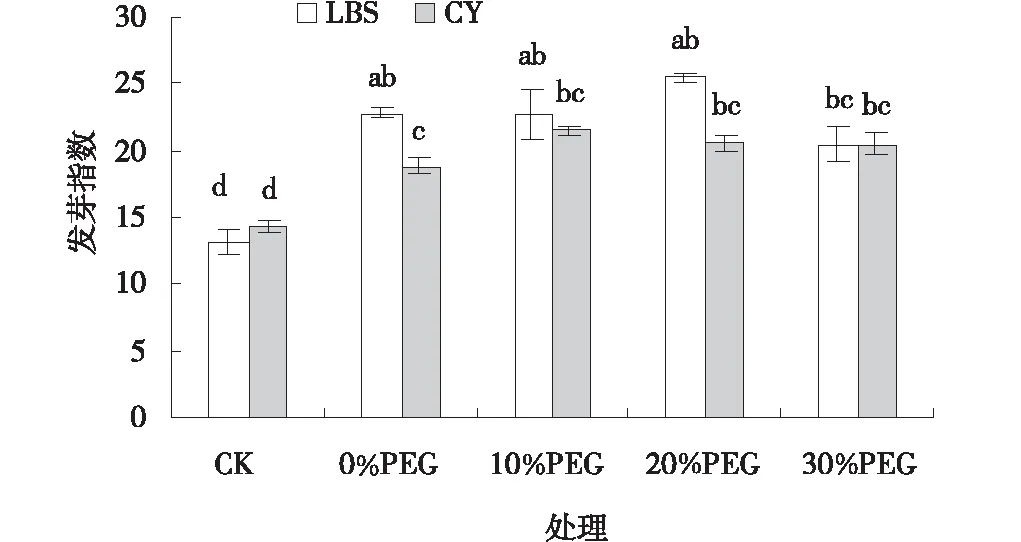
圖3 PEG處理下小冠花種子的發芽指數Fig.3 Effects of PEG treatments on the germination index of Coronilla varia
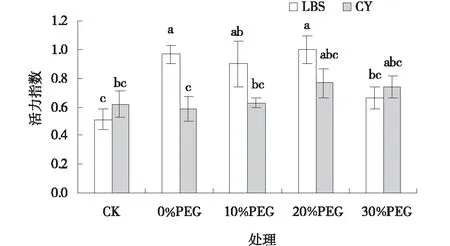
圖4 PEG處理下小冠花種子活力指數Fig.4 Effects of PEG treatments on the vitality index of Coronilla varia
2.2 PEG引發對小冠花幼芽生長的影響
不同濃度PEG處理,小冠花幼芽的生長指標與對照相比呈先增加后降低的趨勢(圖5~7)。0%和10%PEG引發處理下,綠寶石(LBS)胚根長比CK增加18.45%、2.77%。胚芽長比CK增加20.30%、11.87%,但兩個品種與CK均未達到顯著水平。30%PEG引發處理時,與CK相比,綠寶石(LBS)和西輻(CY)胚根長分別降低32.19%、40.73%,胚芽長降低22.66%、22.96%,差異達到顯著水平(P<0.05)。隨PEG引發濃度增加,2個品種小冠花幼芽鮮重先增加后降低,10%PEG引發處理高于其他處理,其中西輻(CY)幼芽鮮重達到36.80 mg,顯著高于對照26.80 mg(P<0.05)。說明低濃度PEG處理對促進小冠花幼芽生長有積極作用,且品種間有差異。
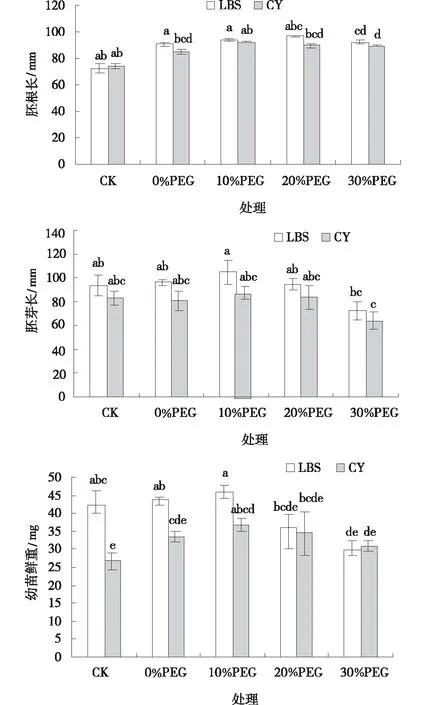
圖5 PEG處理下小冠花幼苗的胚根長,胚芽長和鮮重Fig.5 Effects of PEG treatments on the hypocotyl length,epicotyl length and seedling fresh weight of Coronilla varia
2.3 PEG引發對小冠花幼苗滲透調節物質含量和電解質滲透率的影響
可溶性蛋白、可溶性糖和脯氨酸是植物體內參與滲透調節的主要有機溶質。10% PEG處理后,綠寶石(LBS)和西輻(CY)幼芽可溶性蛋白含量較CK增加了137%和226%;脯氨酸含量高于CK 82.92 μg/g FW和82.04 μg/g FW,且均達到顯著水平(P<0.05);可溶性糖含量有所增加,但差異不顯著。電解質滲透率均顯著降低(P<0.05),其中綠寶石(LBS)降低5.03%,西輻(CY)降低10.59%(表2)。說明適宜濃度PEG引發處理提升了幼芽滲透調節物質含量,降低了細胞膜電解質滲透率。2個品種滲透調節物質含量和電解質滲透率有差異,說明引發效果品種間存在差異。
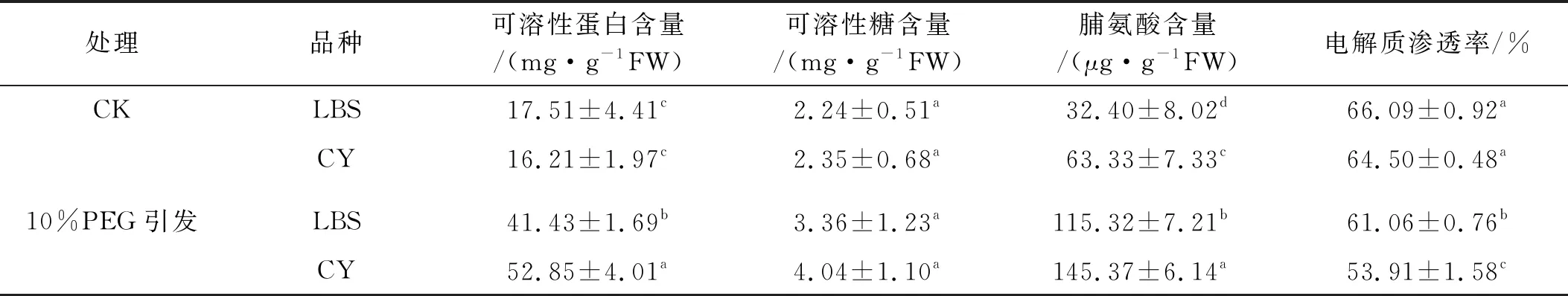
表2 10%PEG引發處理下小冠花幼苗滲透調節物質含量和電解質滲透率
2.4 PEG引發對小冠花幼苗CAT、POD和SOD活性的影響
與CK相比,10% PEG處理下2個品種幼苗CAT、POD和SOD活性均顯著增加(表3)。PEG處理的綠寶石(LBS)和西輻(CY)幼苗CAT活性較CK分別增加了97.48%、39.82%;POD酶活性分別增加了71.69%、97.86%;SOD活性分別增加了88.28%、39.68%。說明PEG引發處理可以幫助小冠花幼芽抗氧化酶維持在更高的活性水平。

表3 10%PEG引發處理下小冠花幼芽CAT、POD和SOD活性
3 討論
種子引發由Heydecker W提出[2],在一些發達國家已作為部分蔬菜、花卉作物種子的播前處理技術,旨在控制條件使種子前期緩慢吸水但不發生可見萌發。其原理是控制種子吸水,使種子處于DNA修復、酶活化準備和萌發所需物質代謝提前啟動的發芽代謝狀態[3-4]。PEG引發可提高多種植物種子發芽率和出苗率一致性,同時增加幼苗株高、鮮重等[5-8,23]。本研究中,0%~20%PEG引發處理均顯著提高了2個品種小冠花種子發芽勢、發芽率和發芽指數,顯著提高綠寶石(LBS)小冠花種子活力指數,20%PEG引發處理則無明顯促進作用。這與前人研究15%PEG引發可顯著提高甘藍種子活力[24]、40%PEG引發可顯著提高甜菜種子發芽勢、發芽率、發芽指數、活力指數的結果類似[25]。表明適宜濃度PEG引發處理可以促進植物種子萌發,但不同植物品種對PEG引發濃度響應不同。在本研究中,10%PEG處理能顯著促進小冠花幼芽的生長,30%PEG處理下小冠花幼芽生長和鮮重均降低,說明高濃度的PEG引發對小冠花幼苗生長抑制。
植物積累脯氨酸、可溶性蛋白和可溶性糖等滲透調節物質,可以提高細胞內滲透勢,維持細胞內膨壓,防止細胞過度失水[26-27],穩定細胞器結構,維持細胞內正常的新陳代謝[28]。PEG可以減緩種子在萌發初期吸收水分的速率,減少種子在吸收水分的過程中膜系統受到的損傷和對受損膜系統的修復[29]。本研究中,10%PEG引發處理下,小冠花幼芽脯氨酸、可溶性蛋白含量顯著升高,與王彥榮等[30]對紫花苜蓿的研究結果類似。膜結構的完整性是維持種子活力的基礎,干燥的種子快速吸水會造成膜損傷,引起其功能的異常,物質外滲量增加,種子活力下降[31]。經PEG引發處理,2個品種小冠花幼芽的電解質滲透率均低于對照。這與PEG引發對芹菜種子幼芽影響的研究結果一致[32]。表明PEG引發能夠提高小冠花幼芽滲透物質的積累能力,維持細胞繼續生長,保護了細胞膜結構。
引發會引起抗氧化酶系統(CAT、POD和SOD酶)的增強,使自由基的清除能力得到提高,膜脂過氧化降低[33]。本試驗在PEG引發處理下小冠花幼芽CAT、SOD和POD活性較CK處理顯著升高。這在蔡春菊等對毛竹[34]和孫園園等對水稻[4]的研究結果相似。表明PEG能夠通過提升小冠花抗氧化酶活性,減少膜脂過氧化,保護膜結構的完整性,增強幼芽應對外界環境的適應能力。
4 結論
適宜濃度的PEG引發處理對小冠花種子萌發和幼芽生長具有明顯的促進作用,表現為提升了種子的發芽勢、發芽率、發芽指數和活力指數,并增加了幼芽的重量以及根長和芽長。但超出最高PEG 引發濃度的閾值(20%PEG引發),會影響種子正常萌發和幼芽生長。PEG引發可誘導小冠花通過增加脯氨酸和可溶性蛋白等滲透調節物質含量,提升幼芽滲透調節能力。并通過提高CAT、POD、SOD等抗氧化酶活性,降低細胞膜脂過氧化和電解質外滲,保護細胞結構完整性。建議在小冠花的培育種植前用10%PEG引發處理,以促進種子萌發和幼芽生長,增強小冠花的適應能力。

