刻畫反應流程圖 快速建立關系式 突破滴定計算題
江蘇
(作者單位:蘇州高新區第一中學)
一、高考情況分析
當下高考化學試題在高考評價體系框架的引領下,以真實情境為考查載體,科學設置考查內容,保證“四翼”要求,滿足高校對高素質人才選拔的需要。化學計算的本質是對化學問題的數學處理過程,即對物質的組成、結構、性質及其變化規律的量化過程,以真實的定量分析實驗為基礎,根據實驗測定的數據,通過計算確定物質的組成或揭示反應的規律,在高考題中備受青睞。近五年有關滴定分析法的考查情況如表1所示。

表1 近五年高考中有關滴定分析的考查
二、常見滴定分析法
通過分析發現,化學計算的考查通常以滴定分析為主,以真實的滴定情境為載體,通過化學計算確定物質的組成或揭示反應的基本規律,基于化學計算的學科應用功能設計試題,考查學生運用實驗數據和結果進行化學計算的能力,培養學生從定量視角分析和解決化學實驗問題的思維方式。常見滴定類型及對應的反應原理如表2所示。
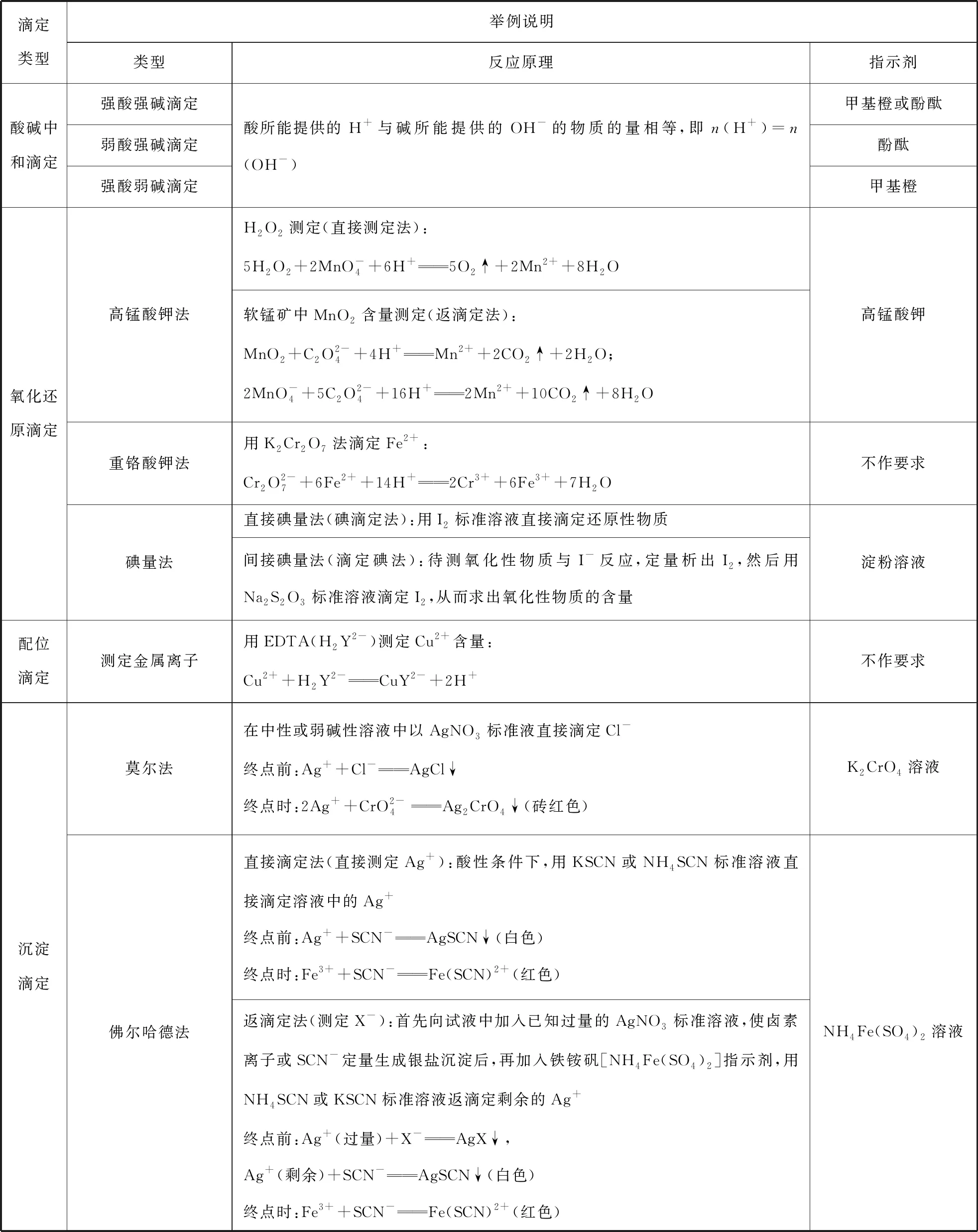
表2 常見滴定分析類型及反應原理
三、滴定分析考查落點
滴定類試題的考查角度主要有滴定曲線分析、指示劑選擇、滴定終點判斷、數據處理及誤差分析等,具體分析如表3所示。

表3 滴定分析考查剖析
四、解題思維模型分析
化學計算的關鍵即找到已知量與未知量之間的關系,建立關系式進行解答。針對滴定類試題命題思路和意圖,歸納總結了解答此類試題的思維模型如圖1所示。

圖1 化學計算思維模型
“一次性審題”就是一次性完成審題,審時要“邊讀題邊刻畫反應流程圖”,并在線上標注反應過程、數據等關鍵信息,目的在于能準確、簡潔、清晰地敘述出題意,縮短做題時間。
五、典型例題分析
1.酸堿中和滴定
【例1】(2017·北京卷·27節選)SCR和NSR技術可有效降低柴油發動機在空氣過量條件下的NOx排放。尿素溶液濃度影響NO2的轉化,測定溶液中尿素[CO(NH2)2,M=60 g·mol-1]含量的方法如下:取ag尿素溶液,將所含氮完全轉化為NH3,所得NH3用過量的v1mLc1mol·L-1H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L-1NaOH溶液恰好中和,則尿素溶液中溶質的質量分數是________。
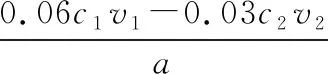
【反應流程分析】快速瀏覽試題可知,該題屬于酸堿滴定計算,目標是計算尿素溶液中溶質的質量分數。對本題滴定分析如圖2所示。
圖2
【解析】由反應流程圖可知,2NH3~H2SO4,2NaOH~H2SO4
H2SO4總量:n(H2SO4)=c1v1×10-3mol
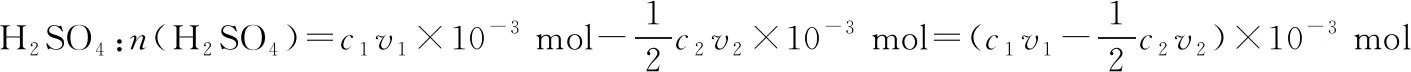
n(NH3)=2n(H2SO4)=(2c1v1×10-3-c2v2×10-3) mol
根據N原子守恒

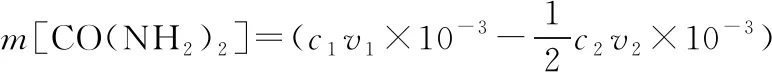
2.氧化還原滴定
【例2】(2019·江蘇卷·18)聚合硫酸鐵[Fe2(OH)6-2n(SO4)n]m廣泛用于水的凈化。以FeSO4·7H2O為原料,經溶解、氧化、水解聚合等步驟,可制備聚合硫酸鐵。
(1)將一定量的FeSO4·7H2O溶于稀硫酸,在約70℃下邊攪拌邊緩慢加入一定量的H2O2溶液,繼續反應一段時間,得到紅棕色黏稠液體。H2O2氧化Fe2+的離子方程式為____________________;水解聚合反應會導致溶液的pH________。
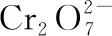
①上述實驗中若不除去過量的Sn2+,樣品中鐵的質量分數的測定結果將________(填“偏大”“偏小”或“無影響”)。
②計算該樣品中鐵的質量分數(寫出計算過程)。

(2)①偏大 ②具體計算過程見解析
【反應流程分析】本題可模仿無機工藝流程題來畫反應流程圖,如圖3所示。
Fe3+、Cr3+
圖3
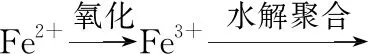
(2)①加入還原劑SnCl2,由Sn2+變為Sn4+,若不除去具有還原性的Sn2+,Sn2+與K2Cr2O7反應,則會消耗更多的K2Cr2O7,使測定的鐵的含量偏高。


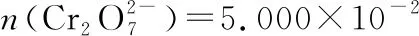
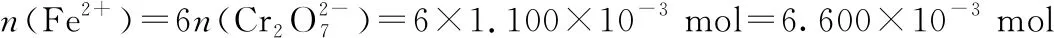
樣品中鐵元素的質量:
m(Fe)=6.600×10-3mol×56 g·mol-1=0.369 6 g
樣品中鐵元素的質量分數:
3.配位滴定

(1)制備堿式硫酸鋁溶液時,維持反應溫度和反應時間不變,提高x值的方法有___________。
(2)堿式硫酸鋁溶液吸收SO2過程中,溶液的pH________(填“增大”“減小”或“不變”)。
(3)通過測定堿式硫酸鋁溶液中相關離子的濃度確定x的值,測定方法如下:
①取堿式硫酸鋁溶液25.00 mL,加入鹽酸酸化的過量BaCl2溶液充分反應,靜置后過濾、洗滌,干燥至恒重,得固體2.330 0 g。
②取堿式硫酸鋁溶液2.50 mL,稀釋至25 mL,加入0.100 0 mol·L-1EDTA標準溶液25.00 mL,調節溶液pH約為4.2,煮沸,冷卻后用0.080 00 mol·L-1CuSO4標準溶液滴定過量的EDTA至終點,消耗CuSO4標準溶液20.00 mL(已知Al3+、Cu2+與EDTA反應的化學計量比均為1∶1)。
計算(1-x)Al2(SO4)3·xAl(OH)3中的x值(寫出計算過程)。
【答案】(1)適當增加CaCO3的量或加快攪拌速率
(2)減小
(3)具體過程見解析
【反應流程分析】該題要注意取樣時溶液的倍數關系。
取25.00 mL
x=0.41
取2.50 mL
圖4
【解析】25.00 mL溶液中:
2.50 mL溶液中:
n(Al3+)=n(EDTA)-n(Cu2+)=
0.100 0 mol·L-1×25.00 mL×10-3L·mL-1-0.080 00 mol·L-1×20.00 mL×10-3L·mL-1=
9.000×10-4mol
25.00 mL溶液中:n(Al3+)=9.000×10-3mol
1 mol (1-x)Al2(SO4)3·xAl(OH)3中:
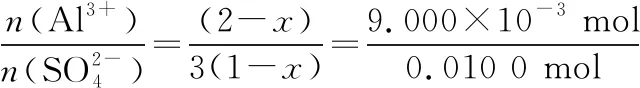
求得x=0.41
4.沉淀滴定
【例4】(2017·天津卷·9)用沉淀滴定法快速測定NaI等碘化物溶液中c(I-),實驗過程包括準備標準溶液和滴定待測溶液。
Ⅰ.準備標準溶液
a.準確稱取AgNO3基準物4.246 8 g(0.025 0 mol)后,配制成250 mL標準溶液,放在棕色試劑瓶中避光保存,備用。
b.配制并標定100 mL 0.100 0 mol·L-1NH4SCN標準溶液,放在棕色試劑瓶中避光保存,備用。
Ⅱ.滴定的主要步驟
a.取待測NaI溶液25.00 mL于錐形瓶中。
b.加入25.00 mL 0.100 0 mol·L-1AgNO3溶液(過量),使I-完全轉化為AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示劑。
d.用0.100 0 mol·L-1NH4SCN溶液滴定過量的Ag+,使其恰好完全轉化為AgSCN沉淀后,體系出現淡紅色,停止滴定。
e.重復上述操作兩次。三次測定數據如表4:

表4
f.數據處理。
回答下列問題:
(1)將稱得的AgNO3配制成標準溶液,所使用的儀器除燒杯和玻璃棒外還有___________。
(2)AgNO3標準溶液放在棕色試劑瓶中避光保存的原因是___________。
(3)滴定應在pH<0.5的條件下進行,其原因是____________________。
(4)b和c兩步操作是否可以顛倒________,說明理由___________。
(5)所消耗的NH4SCN標準溶液平均體積為________mL,測得c(I-)=________mol·L-1。
(6)在滴定管中裝入NH4SCN標準溶液的前一步,應進行的操作為___________。
(7)判斷下列操作對c(I-)測定結果的影響(填“偏高”“偏低”或“無影響”)
①若在配制AgNO3標準溶液時,燒杯中的溶液有少量濺出,則測定結果________。
②若在滴定終點讀取滴定管刻度時,俯視標準液液面,則測定結果________。
【答案】(1)250 mL(棕色)容量瓶、膠頭滴管
(2)避免AgNO3見光分解
(3)防止因Fe3+的水解而影響滴定終點的判斷(或抑制Fe3+的水解)
(4)否(或不能) 若顛倒,Fe3+與I-反應,指示劑耗盡,無法判斷滴定終點
(5)10.00 0.060 0
(6)用NH4SCN標準溶液進行潤洗
(7)偏高 偏高
【反應流程分析】
圖5
【解析】具體分析(5)、(6)、(7)
(5)根據所提供的三組數據可以看出第一組數據誤差較大,應舍去,第二、三兩組數據取平均值即可,所以消耗的NH4SCN標準溶液平均體積為10.00 mL,加入的AgNO3物質的量:n(AgNO3)=0.100 0 mol·L-1×25.00 mL。

n(AgNO3)=0.100 0 mol·L-1×10.00 mL。
則與NaI反應的AgNO3物質的量:
n(AgNO3)=0.100 0 mol·L-1×15.00 mL。

則c(I-)=0.060 0 mol·L-1。
(6)在滴定管中裝入NH4SCN標準溶液前應用NH4SCN標準溶液進行潤洗。
(7)①若在配制AgNO3標準溶液時,燒杯中的溶液有少量濺出,造成溶質減少,所配制的AgNO3標準溶液濃度偏低,測定結果偏高。
②若在滴定終點讀取滴定管刻度時,俯視標準液液面,造成讀數偏小,則測定結果偏高。


