蘋果蠹蛾幾丁質脫乙酰基酶2的基因克隆、表達模式和分子特性
石國良,武強,楊念婉,黃聰,劉萬學,錢萬強,萬方浩,?
1青島農業大學植物醫學學院,山東青島 266109;2中國農業科學院植物保護研究所植物病蟲害生物學國家重點實驗室,北京 100193;3中國農業科學院深圳農業基因組研究所/農業農村部基因組分析實驗室/廣東嶺南現代農業科學與技術實驗室,廣東深圳 518120
0 引言
【研究意義】蘋果蠹蛾(Cydiapomonella)屬鱗翅目卷蛾科,寡食性害蟲,主要以幼蟲鉆蛀蘋果、梨、桃和杏等水果的果實危害,該蟲原產歐洲,20世紀50年代入侵我國,是我國重要的檢疫對象[1-3]。幾丁質普遍存在于許多無脊椎動物以及大多數真菌和藻類的細胞壁中,昆蟲幾丁質主要存在于表皮、圍食膜和氣管等組織中,對維持外骨骼和組織的形狀和大小以及蛻皮過程的順利完成起著至關重要的作用[4-5]。昆蟲蛻皮和生長發育必須經歷周期性去舊表皮和合成新表皮的過程,這一過程伴隨著幾丁質的合成和降解[6]。幾丁質代謝酶參與昆蟲表皮和圍食膜中幾丁質的形成,在昆蟲蛻皮發育等生命活動中具有重要的生理功能[7-10]。因此,著手于參與昆蟲幾丁質代謝途徑的酶的研究以開發新型殺蟲劑成為研究熱點[11-14],如除蟲脲是幾丁質合成抑制劑,已經被用作殺蟲劑廣泛使用[15]。【前人研究進展】幾丁質脫乙酰基酶(chitin deacetylase,簡稱CDA,EC 3.5.1.41)是一種催化幾丁質轉化為殼聚糖的修飾酶,在幾丁質代謝系統中發揮重要作用[16]。根據功能域和系統發育關系 CDA可分為 5大類,第 1類和第 2類都含有幾丁質結合域(ChBD)、低密度脂蛋白受體(LDLa)和催化域(CDA)3個功能域,第3類和第4類都含有催化域CDA,但其他功能域部分或全部缺失,第5類只含有CDA功能域[17-18],各類CDA基因分布于昆蟲不同組織/器官并且在不同時期差異表達,表明其在昆蟲各發育時期發揮著不同的生理功能[19]。另外,蛻皮激素(20E)對昆蟲的發育、變態和繁殖等起著至關重要的作用,幾丁質酶的活性也受蛻皮激素誘導的反應的調節,在一些鱗翅目昆蟲中,幾丁質酶基因受到20E的影響,在家蠶(Bombyxmori)CDA2的研究中,經蛻皮激素誘導后BmCDA表達量上調[20]。其中CDA2屬于第1類,在多種昆蟲中其CDA2存在兩個可變剪切轉錄本,通過RNAi技術抑制云杉卷葉蛾(Choristoneurafumiferana)[21]和美國白蛾(Hyphantriacunea)[22]幼蟲中CDA2兩個剪切體的表達后,其幼蟲的生長發育均受到抑制甚至死亡;而對中華稻蝗(Oxyachinensis)[6]CDA2的研究發現,該基因的兩個剪切體中只有OcCDA2a在其蛻皮過程中發揮重要作用,OcCDA2b則對其正常發育無顯著影響。【本研究切入點】蘋果蠹蛾作為我國重要的入侵害蟲,近年來呈現出快速擴張的趨勢,對我國蘋果產業構成了嚴重威脅,亟需開發更加高效的防控技術。而 CDA作為幾丁質合成代謝的關鍵酶,對昆蟲的生長發育具有重要功能,是新型殺蟲劑的重要作用靶標之一,對蘋果蠹蛾CDA2的研究有助于防控蘋果蠹蛾新型農藥的開發。【擬解決的關鍵問題】鑒定蘋果蠹蛾CDA2的序列及其可變剪切情況,分析其基因結構并檢測在不同發育時期、組織以及注射蛻皮激素后兩個剪切體(CpCDA2a和CpCDA2b)的表達情況,比較二者的蛋白結構、性質和功能,為后續篩選和開發以幾丁質合成相關通路為靶標的新型殺蟲劑提供理論依據。
1 材料與方法
試驗于2019—2020年在中國農業科學院植物保護研究所完成。
1.1 供試昆蟲
蘋果蠹蛾原始種群于2013年11月從甘肅省酒泉市果園采集,使用人工飼料在室內飼養并建立穩定種群,已連續飼養60余代。飼養溫度為(26±0.5)℃,相對濕度為(70 ±10)%,光周期為16L∶8D。
1.2 試驗試劑
總RNA提取所需試劑為組織/細胞RNA快速提取試劑盒,購于北京金百特生物技術有限公司;cDNA第一鏈合成所需試劑為 Hifair?Ⅲ 1st Stand cDNA Synthesis SuperMix for qPCR反轉錄試劑盒,購于上海翊圣生物科技有限公司;RT-qPCR所需試劑為Hieff?qPCR SYBR Green Master Mix(Low Rox),購于上海翊圣生物科技有限公司;PCR擴增所需試劑為TransStart Taq DNA Polymerase、10×TransStart Taq Buffer、dNTPs,均購于TransGen Biotech;凝膠回收試劑盒購于北京天漠科技開發有限公司;克隆試劑盒pClone007 Simple Vector Kit和感受態細胞 Tsurbo Chemically Competent Cell購于北京擎科新業生物技術有限公司;引物合成和測序均由上海生工生物工程股份有限公司(簡稱生工)完成。
1.3 目的基因的鑒定、擴增和克隆測序
在NCBI網站下載部分已發表的昆蟲CDA2蛋白序列,然后以這些蛋白序列為查詢序列(query),通過本地 BLAST在蘋果蠹蛾轉錄組數據中進行比對,鑒定蘋果蠹蛾CDA2的全長CDS序列。
根據其序列信息,使用Vector NTI軟件設計其基因全長克隆引物(表1)。采用RNA提取試劑盒提取蘋果蠹蛾5齡幼蟲的總RNA,使用反轉錄試劑盒合成第一鏈cDNA,然后進行PCR擴增,程序為95℃預變性5 min,然后進行如下循環,95℃變性30 s,50℃退火1 min,72℃延伸2 min,共35個循環;最后72℃延伸10 min。PCR產物經過1%瓊脂糖凝膠電泳分離出含有目的條帶的膠塊,使用凝膠回收試劑盒對PCR產物進行純化,然后按照試劑盒說明書將純化后的PCR產物連接到pClone007 Simple Vector載體上,用移液槍吸取 5 μL連接產物輕輕加入置于冰上并剛解凍的50 μL感受態細胞中,輕輕混勻,冰上放置5 min,42℃水浴熱激45 s,迅速轉移至冰浴中,靜置2 min,加入500 μL不含抗生素的LB液體培養基,然后取200 μL均勻涂布到含氨芐青霉素的LB固體培養基上,37℃培養箱倒置過夜培養,從平板中挑選單克隆菌落,通過菌落PCR篩選陽性克隆,搖菌培養后送生工測序。
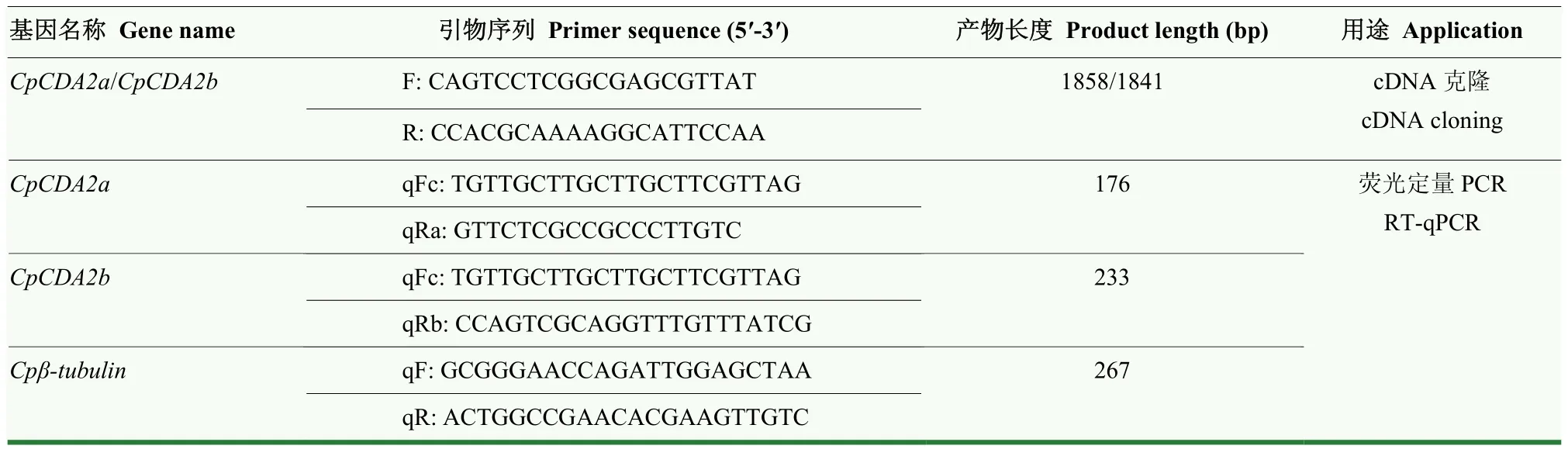
表1 本研究中所用引物信息Table 1 Information of primers used in this study
1.4 生物信息學分析
CpCDA2a和CpCDA2b的CDS序列分別通過本地BLAST與蘋果蠹蛾基因組數據比對得到外顯子和內含子的位置信息,并用IBS1.0軟件繪制基因結構示意圖。通過Pfam網站(https://pfam.xfam.org)和CDD網站(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)對其蛋白序列進行信號肽和功能域預測,并用IBS1.0軟件繪制示意圖。通過MEGA7.0軟件對其進行多序列比對并通過GeneDoc軟件展示。從NCBI蛋白數據庫獲取其他昆蟲中已鑒定的 CDA2氨基酸序列,并使用 MEGA7.0軟件采用鄰接法(neighborjoining,NJ)進行聚類分析。通過網站 https://web.expasy.org/protparam對其蛋白分子量、等電點和氨基酸含量進行預測,蛋白親/疏水分析通過網站 https://web.expasy.org/protscale進行,蛋白 N-糖基化位點和O-糖基化位點分別通過網站 http://www.cbs.dtu.dk/services/NetNGlyc和http://www.cbs.dtu.dk/services/YinOYang進行預測,蛋白三維結構預測示意圖由Phyre2 Server網站(http://www.sbg.bio.ic.ac.uk/~phyre2/html/page.cgi?id=index)和PyMol Molecular Graphics System(ver.2.2.3)軟件完成。
1.5 熒光定量PCR(RT-qPCR)
基于CpCDA2a和CpCDA2b的可變剪切分析,使用Vector NTI軟件分別設計基因的RT-qPCR引物(表1),上游共同引物在第2個外顯子上,下游引物分別在其差異外顯子上(圖1-A)。將cDNA稀釋10倍作為模板,反應體系為Hieff?qPCR SYBR Green Master Mix(Low Rox)10 μL,模板 1 μL,上游和下游定量引物分別0.4 μL,ddH2O 8.2 μL。擴增程序為95℃ 5 min,95℃ 10 s,60℃ 34 s,共40個循環,熔解曲線程序為95℃ 15 s,60℃ 1 min,95℃ 30 s。每個樣本設置3個技術重復,以Cpβ-tubulin作為內參基因,采用2-ΔΔCt方法對數據進行分析,使用R version 3.5.1軟件單因素方差分析(one-way ANOVA)的LSD法進行顯著性分析,使用GraphPad Prism6.0軟件進行作圖。
1.6 不同發育時期和幼蟲不同組織的相對表達量分析
通過蘋果蠹蛾不同發育時期,包括卵、1—3齡幼蟲、4齡早期幼蟲、4齡中期幼蟲、4齡晚期幼蟲、5齡早期雌雄幼蟲、5齡中期雌雄幼蟲、1日齡雌雄蛹、5日齡雌雄蛹、9日齡雌雄蛹、雌雄成蟲的轉錄組測序數據(未發表),采用 RSEM(RNA-Seq by Expectation Maximization)方法計算各樣本中CpCDA2a和CpCDA2b的FPKM(Fragments Per Kilobase per Million)值,作為蘋果蠹蛾不同發育時期的相對表達量。收集蘋果蠹蛾4齡第2天幼蟲,在解剖鏡下快速解剖收集表皮、頭、中腸、馬氏管、唾液腺、血淋巴和脂肪體,迅速凍于液氮中,共設置3個生物學重復。采用RNA提取試劑盒分別提取7個組織部位的總RNA,以1 μg總RNA為模板使用反轉錄試劑盒去除基因組 DNA后合成第一鏈 cDNA。采用RT-qPCR技術檢測CpCDA2a和CpCDA2b在蘋果蠹蛾幼蟲不同組織的相對表達量。
1.7 注射蛻皮激素(20E)后CpCDA2a和CpCDA2b的表達分析
選取5齡第2天蘋果蠹蛾幼蟲進行20E處理。先將20E溶于含0.1%二甲基亞砜(DMSO)的PBS緩沖液,配置成1 μg·μL-1的溶液,將此濃度的20E溶液采用顯微注射方法注射到幼蟲胸足位置。對照組注射等體積的PBS緩沖液,分別于注射后24 h和48 h取樣,提取總RNA,反轉錄并進行RT-qPCR檢測,分析CpCDA2a和CpCDA2b在注射20E后不同時間的表達動態。采用GraphPad Prism6.0軟件的獨立樣本T檢驗(T-test)進行差異顯著性分析。
2 結果
2.1 CpCDA2a和CpCDA2b的基因結構及其蛋白結構域分析
基于已知昆蟲的CDA2序列信息,通過同源比對在蘋果蠹蛾轉錄組數據中獲得了蘋果蠹蛾CDA2的兩個不同轉錄本,分析發現與其他昆蟲中類似,這兩個轉錄本也是可變剪切體,將其分別命名為CpCDA2a和CpCDA2b。通過PCR擴增和克隆測序,發現測序結果與轉錄組中的序列一致,兩個基因的CDS長度分別為1 629和1 611 bp,分別編碼542和536個氨基酸。基因結構分析顯示,兩個基因均包含5個外顯子和5個內含子,其中第3個外顯子存在差異(圖1-A)。
功能域分析表明,CpCDA2a和CpCDA2b蛋白均具有信號肽(SP)、幾丁質結合域(ChBD)、低密度脂蛋白受體域(LDLa)和幾丁質脫乙酰基催化域(CDA)功能域,其中僅有ChBD存在差異,CpCDA2a和CpCDA2b的ChBD分別包含62個和56個氨基酸(圖1-B)。另外,通過不同昆蟲CDA2蛋白兩個剪切體差異區域序列比對發現,各昆蟲兩個剪切體的差異序列大部分在ChBD結構域中,其中CpCDA2a和CpCDA2b共有18個差異氨基酸序列,均分布于ChBD結構域中(圖2)。
2.2 CDA2蛋白聚類進化分析
選取不同昆蟲CDA2氨基酸序列構建系統發育樹,結果顯示相同目昆蟲的CDA2均以較高的置信度聚為一支,其中蘋果蠹蛾CpCDA2a和CpCDA2b與云杉卷葉蛾 CfCDA2a 和 CfCDA2b進化關系最近。并且除直翅目的兩種昆蟲外,本研究所選其他昆蟲均為本物種的CDA2a和CDA2b首先聚為一支,再與近緣種聚到一起,而直翅目中的飛蝗(Locusta migratoria)和中華稻蝗首先是不同物種的同一剪切類型分別聚為一支,然后兩種剪切類型再聚到一起(圖 3),對其序列分析發現這可能與本研究所選取的不同目中的不同昆蟲間親緣關系的遠近程度有關。另外,黑腹果蠅(Drosophilamelanogaster)中兩個剪切體分別又存在兩個不同的亞型,可能是在基因組上發生了擴增現象,這在進化上值得進一步深入分析。
2.3 CpCDA2a和CpCDA2b的蛋白三維結構預測
利用 Phyre2在線網站和 PyMol軟件構建CpCDA2a和CpCDA2b蛋白三維結構模型。從圖中可以看出,蘋果蠹蛾兩個CDA2蛋白的三維結構整體上十分相似(圖4-A、4-C)。根據多序列比對結果可知,兩個CDA2蛋白間的差異序列位于ChBD功能域,所以將兩個蛋白該區域的序列分別獨立構建了三維結構模型(圖4-B、4-D),發現兩者的ChBD功能域均含有 5個β-轉角,但CpCDA2a的 ChBD比 CpCDA2b多了1個α-螺旋,并且CpCDA2a的ChBD中有2個β-轉角均比CpCDA2b的ChBD對應的2個β-轉角長約3個氨基酸,其中1個的氨基酸序列差異較大,這些結構上的差異會導致其分子特性發生變化,也可能會造成其功能上的分化。
2.4 CpCDA2a和CpCDA2b的蛋白理化性質
CpCDA2a和CpCDA2b蛋白的氨基酸長度分別為542和536 aa,兩個蛋白的分子量相近、等電點相同,均具有2個相同的N-糖基化位點和5個相同的O-糖基化位點,但CpCDA2a在差異位置(T37)比CpCDA2b多1個O-糖基化位點(表2)。
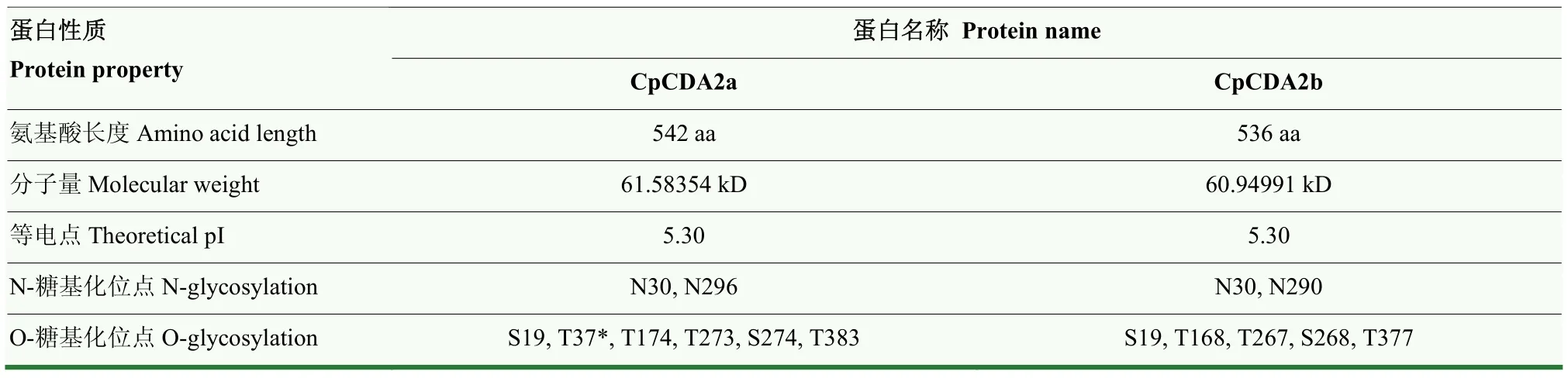
表2 CpCDA2a和CpCDA2b蛋白性質Table 2 Protein property of CpCDA2a and CpCDA2b
親/疏水分析發現,兩個蛋白親水和疏水氨基酸都在整個肽鏈中的分布比較均勻,分別占總氨基酸的65.10%和34.90%,第11位氨基酸分值最高2.967,第28位分值最低為-3.144。而兩者在 61—76區域親/疏水性有較大差異(圖 5),如圖中灰色方框所示,在此區域其氨基酸親/疏水分值最高峰都在第 76位,CpCDA2a為0.667,而CpCDA2b則高達1.322;最低峰都在第67位,CpCDA2a為-1.956,遠低于CpCDA2b的-1.333;并且從61—67位兩者氨基酸親/疏水分值都呈下降趨勢,但 CpCDA2a的下降趨勢更劇烈,且該區段其每個氨基酸親/疏水分值都小于CpCDA2b所對應位置的氨基酸分值。
2.5 CpCDA2a和CpCDA2b在蘋果蠹蛾不同發育階段的差異表達分析
CpCDA2a和CpCDA2b在蘋果蠹蛾各發育階段均有表達,且相同基因在不同發育階段的雌、雄蟲間的表達量均無顯著差異,其中CpCDA2a在幼蟲期的蛻皮前后(4齡末期、5齡初期和4齡初期)、卵期以及蛹中期顯著高表達,而幼蟲各齡期的中期以及蛹末期和成蟲中表達量較低;CpCDA2b在蛹的前期和中期顯著極高表達,幼蟲期的蛻皮前后和卵期顯著高表達,而幼蟲各齡期的中期以及蛹末期和成蟲中表達量均較低。另外,CpCDA2a在4齡末和5齡初幼蟲中高表達,且其表達量顯著高于CpCDA2b,約為其3—5倍;而CpCDA2b在蛹前期和中期高表達,且其表達量顯著高于CpCDA2a,約為其2—5倍,值得注意的是在預蛹期時CpCDA2b的表達量極低,化蛹第1天急劇升高,除此之外,在其他發育階段兩個基因的表達量基本無明顯差異(圖6)。
2.6 CpCDA2a和CpCDA2b在蘋果蠹蛾幼蟲不同組織特異表達分析
CpCDA2a和CpCDA2b在7個組織中均有表達,且都是在表皮中表達量最高,頭部次之,但CpCDA2b在頭部的表達量與表皮相差較小,無顯著差異,而CpCDA2a在頭部的表達量顯著低于表皮;其他組織中兩個基因的表達量均較低,而在血淋巴中幾乎不表達,這與其生物學功能是相符的(圖7)。
2.7 注射20E后CpCDA2a和CpCDA2b的表達分析
為了分析CpCDA2a和CpCDA2b的表達是否受蛻皮激素的影響,選取5齡第2天蘋果蠹蛾幼蟲,分別注射20E溶液和對照緩沖液,采用RT-qPCR技術檢測兩個基因的表達情況(圖8)。結果顯示,與對照相比在注射20E后兩個基因表達量均呈現出上調趨勢,但CpCDA2a在注射20E后24 h和48 h的表達量與對照相比差異均不顯著,而注射20E后CpCDA2b在兩個時間點的表達量均顯著高于對照,在24 h為對照的40倍左右,48 h時其表達量有所回落,但仍達到對照表達量的20倍。
3 討論
幾丁質脫乙酰基酶(CDA)是一種糖酯酶家族的金屬酶,它能夠催化幾丁質β-1,4糖苷鍵連接的N-乙酰基葡糖胺的乙酰胺基水解,形成脫乙酰幾丁質(即殼聚糖),在幾丁質代謝中起重要作用[23-25]。CDA已在真菌、細菌和昆蟲等物種中被廣泛發現并研究,在昆蟲中CDA可通過使幾丁質脫乙酰基形成殼聚糖來參與昆蟲發育過程中表皮、氣管和腸道等器官的形成,調節其幼蟲蛻皮過程,還具有抵抗病原菌的功能[16,20,26]。在赤擬谷盜(Triboliumcastaneum)[18]中根據包含功能域的不同,將其9個CDA分為5類,其中CDA1和CDA2屬于第1類,而且CDA2包含兩個可變剪切轉錄本,并且已在多種昆蟲中被鑒定和研究[6,21-22,27]。與其他昆蟲的CDA2相似,蘋果蠹蛾CDA2也存在兩個可變剪切轉錄本,分別命名為CpCDA2a和CpCDA2b,兩者的蛋白序列均包含信號肽以及幾丁質結合域(ChBD)、低密度脂蛋白受體域(LDLa)和幾丁質脫乙酰基催化域(CDA)3個功能域。
蛋白質的結構與其功能密切相關,個別關鍵位置氨基酸的差異都可能導致其功能活性方面的較大變化,CpCDA2a和CpCDA2b僅在ChBD功能域區域有18個氨基酸的差異,通過對其三維結構的模擬與比較發現,該結構域的三維結構存在較大差異,這很可能導致其可以結合并催化水解的幾丁質類型間的不同,從而使其在功能上存在較大差異。進一步分析了兩者親/疏水性、等電點和糖基化修飾位點等,其中親/疏水性在差異區域有顯著區別,這可能與其需結合催化的幾丁質類型相適應;而且該差異區中 CpCDA2a比CpCDA2b多一個O-糖基化位點,糖基化是一種重要的蛋白修飾類型,對維持蛋白的空間構象和保護其免受蛋白水解酶的降解具有重要意義,這表明兩個蛋白間發揮功能的環境和條件可能也存在差異。
CDA在昆蟲的不同發育階段和組織中的表達模式存在多樣性,這與其所發揮的生物學功能相關。目前,研究者已對褐飛虱(Nilaparvatalugens)[28]、橘小實蠅(Bactroceradorsalis)[29]、馬鈴薯甲蟲(Leptinotarsadecemlineata)[30]、云杉卷葉蛾[21]、家蠶[19]、中華稻蝗[6]及美國白蛾[22]等多種昆蟲中CDA2的發育階段和組織表達情況進行了研究。對中華稻蝗CDA2的研究發現,OcCDA2a在前腸中表達量最高,其次是表皮和后腸,而OcCDA2b在表皮中表達量最高,其次是前腸,根據其不同的表達特點,推測其功能發生了分化[6]。本研究中蘋果蠹蛾CDA2的兩個剪切體都是在表皮中表達量最高,其中CpCDA2a僅在表皮中特異性顯著高表達,而CpCDA2b除在表中顯著高表達外,頭部的表達量也與其相近,推測該基因的兩個剪切體在幼蟲的發育過程中所發揮的功能也有一定程度的差異。在發育階段表達方面,多種昆蟲中CDA2兩個剪切體均在蛻皮第1天后表達量最高,之后逐漸下降,可能參與新表皮的鞣化和骨化[6],本研究中蘋果蠹蛾CDA2兩個剪切體在幼蟲期都是蛻皮前后的表達量最高,推測其在昆蟲蛻皮和新表皮的形成過程發揮重要作用,而且它們在不同發育階段的總體表達模式也有較大差異,CpCDA2a主要在幼蟲期高表達,而CpCDA2b主要在化蛹前期和中期高表達,因此CpCDA2b對蘋果蠹蛾蛹殼中幾丁質的合成和代謝具有更重要的作用。另外,對5齡幼蟲注射20E后,兩個剪切體均表現出不同程度的上調,其中CpCDA2b顯著且劇烈上調,結合其不同發育階段中幼蟲蛻皮前后的表達量顯著高于幼蟲齡期中間階段,表明其在幼蟲蛻皮過程中也發揮重要作用,而CpCDA2a的上調趨勢不顯著,其在幼蟲蛻皮過程中的作用有待通過RNAi等技術進一步深入研究。
在其他昆蟲中開展的 RNAi試驗結果也驗證了昆蟲CDA2不同剪切體的功能特異性。如通過RNAi降低赤擬谷盜TcCDA2a的表達量后,主要影響其股脛關節的運動,而TcCDA2b表達量下調則導致背側褶皺[13];在馬鈴薯甲蟲中,干擾LdCDA2a既不影響食物攝取,也不影響發育時間,而干擾LdCDA2b后幼蟲生長發育遲緩,發育期延長,不能正常蛻皮最終死亡[30]。在美國白蛾、中華稻蝗和飛蝗中,干擾CDA2a的表達會導致非正常生物型和高死亡率,而CDA2b表達降低后不影響昆蟲的正常生長發育[6,22,31]。另外,趙盼等從酶學角度研究了飛蝗CDA2兩個剪切體的差異[32],為RNAi后導致飛蝗表型不同可能是由于它們催化功能不同的推斷提供了理論支持。但由于蘋果蠹蛾 RNAi效果很差且不穩定[33],無論通過注射還是飼喂CDA2的dsRNA,均不能顯著降低其表達量(未發表數據),后續可通過RNAi技術體系的優化來進一步驗證兩個剪切體的生物學功能。
4 結論
克隆并驗證了蘋果蠹蛾CDA2的全長 cDNA序列,該基因存在兩個可變剪切體CpCDA2a和CpCDA2b;通過綜合分析CpCDA2a和CpCDA2b分子特性、發育階段和組織表達譜、以及注射蛻皮激素后表達動態等,推測兩者可能都參與了蘋果蠹蛾蛻皮和新表皮形成過程,但由于可變剪切序列差異所導致的蛋白結構和理化性質上的差異,造成了兩者在功能上的分化,該研究結果為蘋果蠹蛾綠色新型農藥開發中的靶標選擇提供了科學依據。

