在極度弱光和兩種底質條件下苦草的生長和生理響應
張忠海 楊 桐 文紫豪 張霄林 曹 特 倪樂意 袁昌波
(1. 中國科學院水生生物研究所, 武漢 430072; 2. 大理市洱海管理局, 大理 671000)
湖泊富營養化及其引發的沉水植被退化仍然是我國眾多湖泊目前面臨的一個主要問題。由于沉水植物在湖泊生態系統中發揮著重要的生態功能(初級生產者, 維持生物多樣性和清水穩態, 穩定底質環境等[1]), 沉水植被的退化將引發一系列水生態和水環境問題, 比如引起湖泊的“草-藻”穩態轉換[2]。因此, 開展沉水植被修復是很多富營養化湖泊生態修復中的一項重要工作,并在很多湖泊中得到實施, 比如武漢東湖[3]、杭州西湖[4]和荊州洪湖[5]等。但是, 在污染嚴重的水體中, 沉水植物的自然恢復是十分困難的, 一般而言, 湖泊低透明度和水下植物繁殖體的缺乏是影響水生植被恢復的主要限制因素[6,7]。在這種情況下應盡快進行生態工程促進水生植被生境改善, 并積極開展水生植被重建與恢復工作[8]。就污染水體的低透明度而言, 水生植物必然會受到光照不足的影響, 一般認為環境光強持久或短時間顯著低于植物光飽和點, 可以稱為弱光逆境[9]。在弱光條件下, 首先通過降低光合作用效率抑制沉水植物的生長, 此外還通過抑制抗氧化酶活性影響沉水植物的生存[10,11], 而大多數富營養化湖泊普遍表現出弱光或極度弱光的水下環境, 成為影響這些湖泊中沉水植被恢復的一大難題。除了水下光照環境, 底質條件對沉水植物的恢復亦有重要的影響, 底質是沉水植物的固定基質和營養來源, 對沉水植物生根、繁殖和生長產生不同程度的影響[12,13], 研究表明富營養水體中肥沃底質對沉水植物造成脅迫, 使其生物量下降[14]。
洱海位于云南西北部的大理州境內, 是我國著名的高原淡水湖泊之一, 在洱海水面高程為1973.7 m時, 湖泊面積是249.8 km2。南部湖心平臺(簡稱湖心平臺)位于洱海南部湖心區域, 南起洱濱村, 北至才村和文筆村(25.64375—25.71297N, 100.21799—100.24011E), 南北兩端是水深10 m以上的深水區,東西兩側是水深10—13 m的深水帶與沿岸帶相隔,中間形成一片水深6 m左右的暗灘區域。湖心平臺曾經是洱海沉水植物成片連續分布的最大區域, 在洱海沉水植被演替過程中具有非常重要的地位(表 1)[15—17]; 自1998年洱海發生大面積水華后, 湖心平臺區域沉水植被大幅退化[18,19], 在2009年該區域未發現沉水植物生存[20]。如果能成功恢復湖心平臺的沉水植被, 將大幅提升洱海沉水植物群落的分布面積和生態功能。

表 1 洱海湖心平臺區域水生植被群落變化[15-17]Tab. 1 Changes of aquatic vegetation community in the lake center platform of Erhai Lake
2015年以來, 隨著洱海環境保護力度的加大,洱海水質呈現出逐年向好的發展趨勢, 透明度逐年提高, 湖心平臺水下光環境基本達到沉水植物的光補償點, 理論上有沉水植物恢復的可能性, 但是沒有出現自然恢復的現象, 因此我們希望通過人工強化的修復措施實現該區域的沉水植被重建。這里面有兩個問題: (1)選用哪種沉水植物; (2)如何通過改善局部環境來幫助沉水植物應對弱光脅迫。苦草(Vallisneria natans)是水鱉科(Hydrocharitaceae)苦草屬(Vallisneria)沉水草本植物, 無直立莖, 葉基生,條形[21], 生長區域廣泛, 在淡水湖泊、溝渠、池塘和內河航道的靜水或流動水體中均能很好地生長[22]。苦草對弱光環境具有很強的耐受能力, 因此成為洱海沉水植物群落中分布下限最深的物種[23], 并且在1980s中后期以來, 苦草成為洱海水生植被的優勢種之一[24], 所以我們選擇了對弱光環境耐受能力強的苦草作為湖心平臺區域沉水植被恢復的嘗試物種。另外, 就湖心平臺底泥中富集了大量有機碎屑的情況而言, 改善底質環境理論上對沉水植被的恢復有利, 所以我們選擇了黏土作為底質的處理, 以原位淤泥作為對照的方法, 探究底質改善對湖心平臺水域沉水植被恢復的影響。對當地水生植被的恢復可以起到很好的指導作用, 在洱海湖泊的生態修復中具有重要的意義。
1 材料與方法
1.1 實驗材料
實驗用的苦草來自洱海苗圃基地, 苗圃基地鄰于洱海北部, 由水深1.5 m水生植物培養池構成, 取洱海的苦草置于苗圃培養池, 通過培養擴增苦草數量。實驗選用的是生長茂盛、健康和形態指標大體一致[株高: (65±5) cm, 鮮重: (10.5±0.5) g]的苦草,并去除植株上的匍匐莖。
1.2 實驗時間與地點
實驗時間選擇苦草在洱海的生長旺盛期, 從2018年6月7日到2018年8月7日, 共9周(63d)。
如圖 1所示,實驗地點選擇在洱海南部湖心平臺水深最淺的區域, 實驗地點中心坐標(25.684234 N, 100.226728E)。

圖 1 實驗地點位置圖Fig. 1 Location map of experimental sites
1.3 實驗設計
實驗以黏土底質作為處理組, 以淤泥底質(湖心平臺原位底泥)作為對照組。淤泥是用彼德森采泥器采集湖心平臺水底的底泥, 黏土采自苗圃基地,是洱海岸邊常見的泥土。黏土含水率20%, N含量0.11%, C含量2.75%, 有機質含量7.76%; 而淤泥含水率83%, N含量1.09%, C含量13.63%, 有機質含量20.52%。比較兩種底泥, 淤泥含有更高濃度的C、N和有機質含量, 而黏土含水率低, 土質偏硬。
種植方式采用沉桶種植。種植桶是白色塑料桶(口直徑: 35 cm, 底直徑: 27 cm, 高: 33 cm), 在桶內裝填底質(淤泥或黏土)15 cm, 將苦草按照每桶30株的密度均勻植于桶內, 每個實驗處理分配20桶作為平行。種植桶沉入水底前, 用另一端綁著浮標(直徑10 cm的白色泡沫球)的尼龍繩系在桶上, 繩長度7.5 m, 略大于實驗地點的水深(約6.3 m), 保證種植桶不受浮標漂動影響, 然后緩慢沉入水底。
1.4 測量指標
水環境指標在實驗期間, 光合有效輻射、水溫、pH、透明度、實驗區水體總氮(TN)、氨氮(NH4-N)、硝態氮(NO3-N)、總磷(TP)和正磷酸鹽(PO4-P)每1周測量1次。水溫和pH用多參數水質分析儀YSI(Yellow Springs Instruments, Ohio, US)測量, 透明度用黑白透明度盤測量, 水底光合有效輻射使用水下照度計(Li-1400; Li-Cor Company, Lincoln, NE, U.S.A; UWQ-8342)于上午11—12點在苦草冠層深度測量, 水的消光系數用不同水深的光合有效輻射計算得來。總氮、氨氮、硝態氮、總磷和正磷酸鹽根據標準方法測定[25]。
苦草生長和生理指標在實驗周期內, 每1周從對照組和實驗組各隨機取5個實驗桶計數植株數量作為苦草存活量, 從5個桶內每桶隨機取1株苦草帶回實驗室, 測量地上部分(葉片)和地下部分(根和莖)的長度, 經80℃烘干至恒重后測量各部分的生物量(干重)、游離氨基酸、可溶性糖、淀粉、碳和氮含量。植物組織碳和氮含量通過元素分析儀(Flash EA 1112, CE Instruments, Italy)測定; 將烘干的植物組織50 mg用5 mL的80%乙醇在80℃的水浴萃取20min, 重復2次, 離心后合并上清液, 并定容到5 mL用于測定總糖和氨基酸, 萃取后的殘渣中加入1 mL 30%的高氯酸繼續萃取120min, 離心10min后收集上清液用于測定淀粉含量。總糖的測定使用1 g/L的葡萄糖溶液做標準曲線, 用蒽酮試劑法測定[26], 游離氨基酸的測定用3 μg/mL的丙氨酸做標準曲線, 用茚滿三酮—抗壞血酸法測定[27]。用5 g/L的淀粉溶液做標準曲線, 用碘試劑法測定淀粉含量[28]。
1.5 分析方法
使用SPSS 22軟件進行統計分析, 采用雙因素方差分析時間和底質因素對苦草存活數量和不同部位的生物量、長度的作用效應, 采用成組樣本t檢驗實驗組和對照組在游離氨基酸、可溶性糖、淀粉、碳、氮含量上是否有差異, 方差分析前所有數據進行正態分布和方差齊性檢驗, 如有必要時將數據進行轉換以滿足方差齊性檢驗。使用Origin 2017軟件繪圖。
2 結果
2.1 水環境特征
在實驗周期內, 實驗區域水深6.1—6.6 m, 透明度1.5—2.0 m, 湖底光照8.3—15.8 μmol/(m2·s), 有研究報道苦草的光補償點為9.4 μmol/(m2·s), 光飽和點200 μmol/(m2·s)[29](圖 2), 湖底光照強度不能滿足苦草的需光量, 光照不足是影響生長的主要限制因子, 在此區域苦草必然受到弱光脅迫的影響。另外,實驗區域水體水溫22.1—24.6℃; pH 8.5—8.6; TN濃度0.56—0.98 mg/L, NH4-N濃度0.012—0.071 mg/L, NO3-N濃度0.031—0.052 mg/L; TP濃度0.034—0.048 mg/L, PO4-P濃度0.002— 0.015 mg/L,湖心區域水質為Ⅲ類水, 按照地表水質標準(GB3838-2002), 屬于Ⅲ類水。有研究報道苦草能在5—35℃溫度條件下良好生長[30], 在氨氮<1.56 mg/L時, 現存量增加百分比略有增加, 而硝氮<25 mg/L時, 促進苦草生長, 在總磷濃度<3.2 mg/L時, 苦草的生產力可保持正增長[1], 在本實驗地點水溫和營養鹽因素對苦草的生長并沒有不利的影響。

圖 2 水環境因子變化Fig. 2 Changes in water environmental factors
2.2 苦草存活數量
在實驗期間, 苦草存活量顯著性下降, 對照組從30株/桶下降到(10±2)株/桶, 實驗組從30株/桶下降到(18±4)株/桶(圖 3), 這說明弱光環境限制了苦草的生長, 導致了部分苦草死亡。雙因素方差分析表明, 黏土組苦草存活株數顯著性大于淤泥對照組(表 2,P<0.05), 說明對比于淤泥底質, 黏土更有利于苦草的存活, 然而2種底質苦草存活數仍明顯少于初始種植數。
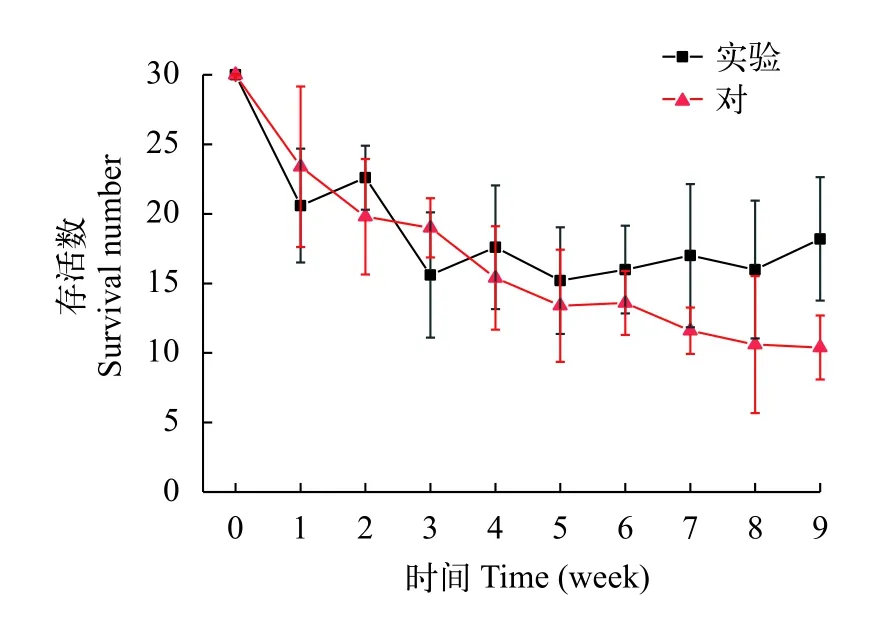
圖 3 苦草存活數量變化Fig. 3 Changes in the survival number of V. natans

表 2 苦草存活數和不同器官生物量、長度的雙因素方差分析Tab. 2 Two factor ANOVA table of survival number, biomass and length of different organs of V. natans (*P<0.05,** P <0.01,***P<0.001)
2.3 弱光脅迫下底質對苦草形態指標的影響
在實驗初始時, 單株苦草葉片的平均生物量為(0.96±0.04) g, 根莖的平均生物量為(0.27±0.01) g。在弱光環境下, 苦草生長明顯受到抑制, 葉片生物量和根莖生物量都有顯著性下降(表 2,P<0.05)。在實驗期間, 實驗組和對照組單株葉片的平均生物量分別下降至(0.10±0.03)和(0.10±0.02) g, 下降幅度分別是90%和90%; 根生物量在第1周下降趨勢最迅速, 之后在2個實驗組之間表現出差異, 對照組的下降趨勢減緩, 實驗組的變化是先上升后下降, 第9周,實驗組和對照組的根生物量分別是(0.13±0.04)和(0.06±0.01) g, 相比初始值下降幅度分別是51%和80%; 實驗組和對照組單株苦草根莖和葉片的生物量比值顯著性上升(表 2,P<0.05), 分別從(0.28±0.01)上升到(1.35±0.09)和(0.59±0.09), 并且葉片生物量的下降幅度遠大于根莖(圖 4)。雙因素方差分析表明, 時間因素對葉片和根莖的生物量及兩者的比值有顯著性影響, 底質因素對根莖的生物量有顯著性影響, 實驗組根莖生物量大于對照組(表 2,P<0.05)。
在初始時, 苦草葉片長度平均值(51.7±3.7) cm,根莖長度平均值(13.4±1.0) cm。在弱光環境下, 苦草葉片和根莖長度顯著性下降(表 2,P<0.05), 第1周, 實驗組的苦草葉片長度下降至(36.3±9.2) cm,對照組的苦草葉片長度下降至(40.1±14.4) cm, 比初始值分別下降了30%和22%, 此后變化不顯著; 第5周, 實驗組苦草的根莖長度為(3.6±1.0) cm, 對照組苦草的根莖長度為(3.7±1.1) cm, 比初始值分別下降了73%和72%, 此后苦草根長的變化不顯著; 苦草根莖和葉片長度的比值顯著性下降(表 2,P<0.05), 實驗組和對照組的根莖和葉片長度的比值分別從(0.26±0.00)下降到(0.12±0.01)和(0.11±0.01), 并且葉片長度的下降幅度遠小于根莖(圖 4)。雙因素方差分析表明, 時間因素對葉片和根莖的長度及兩者的比值都有顯著性影響, 而底質因素對它們沒有顯著性效應, 即實驗組和對照組之間沒有顯著性差異。
2.4 在弱光脅迫下兩種底質中苦草的生理指標的變化
在初始時, 苦草葉片的C含量是37.2%, 根莖的C含量是36.2%, 在弱光環境下, 實驗組和對照組的葉片和根莖的C含量均呈下降趨勢, 在實驗期間, 實驗組和對照組的葉片C含量分別下降至30.6%和32.1%, 相比于初始值其下降幅度分別是17.8%和13.8%; 實驗組和對照組的根莖C含量分別下降到28.3%和30.2%, 相比于初始值其下降幅度分別是21.8%和16.5%; 葉片C含量的下降幅度與根莖相差不大, 實驗組和對照組根莖和葉片的C含量比值在實驗期間的變化也不明顯(圖 5)。根莖和葉片的C含量在實驗組和對照組之間沒有顯著性差異(表 3)。
在初始時, 苦草葉片的N含量是0.94%, 根莖的N含量是0.91%, 在弱光環境下, 葉片和根莖的N含量呈上升趨勢, 在實驗期間, 實驗組和對照組葉片N含量分別下降到2.97%和3.07%, 相比于初始值上升幅度分別是215%和225%; 實驗組和對照組根莖的N含量分別下降到1.05%和1.75%, 相比于初始值上升幅度分別是15.1%和92.3%; 葉片N含量的上升幅度遠大于根莖, 實驗組和對照組根莖和葉片的N含量比值分別從0.97下降到0.35和0.57(圖 5)。實驗組葉片和根莖的N含量均顯著性大于對照組(表 3,P<0.05)。
在初始時, 苦草葉片和根莖的游離氨基酸含量分別是0.27和0.21 mg/g, 在弱光環境下, 葉片和根莖的游離氨基酸含量都呈上升趨勢, 在實驗期間,實驗組和對照組葉片的氨基酸含量分別上升到1.22和1.30 mg/g, 比初始值上升了347%和374%; 實驗組和對照組根莖的氨基酸含量分別上升到0.32和0.62 mg/g, 相比于初始值上升了49%和190%; 葉片的氨基酸含量的上升幅度大于根莖, 根莖和葉片的氨基酸含量比值下降, 實驗組和對照組分別從0.78下降到0.26和0.48(圖 6)。樣本t檢驗表明, 實驗組根莖的氨基酸含量顯著低于對照組(表 3,P<0.05)。
在初始時, 苦草葉片的可溶性糖含量是16.2 mg/g, 根莖的可溶性糖含量是14.1 m/g, 在弱光環境下,葉片的可溶性糖含量在第1周略有上升隨后迅速下降, 在實驗結束時, 實驗組和對照組葉片的可溶性糖含量分別下降至8.2和9.4 mg/g, 相比于初始值下降幅度分別是49%和42%; 根莖的可溶性糖含量呈先上升后下降的趨勢, 實驗組根莖的可溶性糖含量上升至29.3后下降至9.0 mg/g, 對照組根莖的可溶性糖含量先上升至31.9后下降至5.6 mg/g; 實驗組根莖和葉片的可溶性糖含量比值從0.87上升至3.9隨后下降至1.1, 對照組從0.87上升至5.4隨后下降至0.60(圖 6)。葉片和根莖的可溶性糖含量在實驗組和對照組之間沒有顯著性差異(表 3)。
在初始時, 苦草葉片和根莖的淀粉含量分別是239和286 m/g, 在弱光環境下, 苦草葉片和根莖的淀粉含量持續下降, 在實驗結束時, 實驗組和對照組葉片的淀粉含量分別下降到19和9 mg/g, 相比初始值下降幅度分別是92%和96%; 實驗組和對照組根莖的淀粉含量分別下降到212和133 mg/g, 相比根莖初始值下降幅度分別是26%和53%; 葉片淀粉含量的下降幅度大于根莖, 根莖和葉片的淀粉含量比值呈上升趨勢, 實驗組從1.2上升至11.4, 對照組從1.2上升至15(圖 6)。葉片淀粉含量在實驗組和對照組之間沒有顯著性差異, 而實驗組根莖的淀粉含量顯著大于對照組(表 3,P<0.05)。
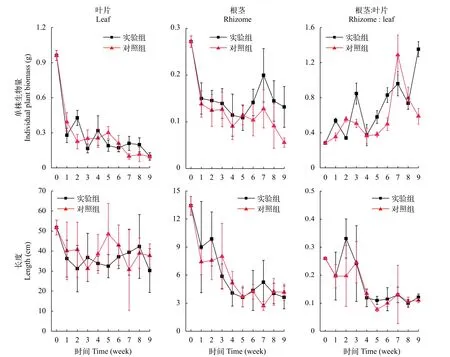
圖 4 苦草的生長特征變化Fig. 4 Changes of growth characteristics of V. natans
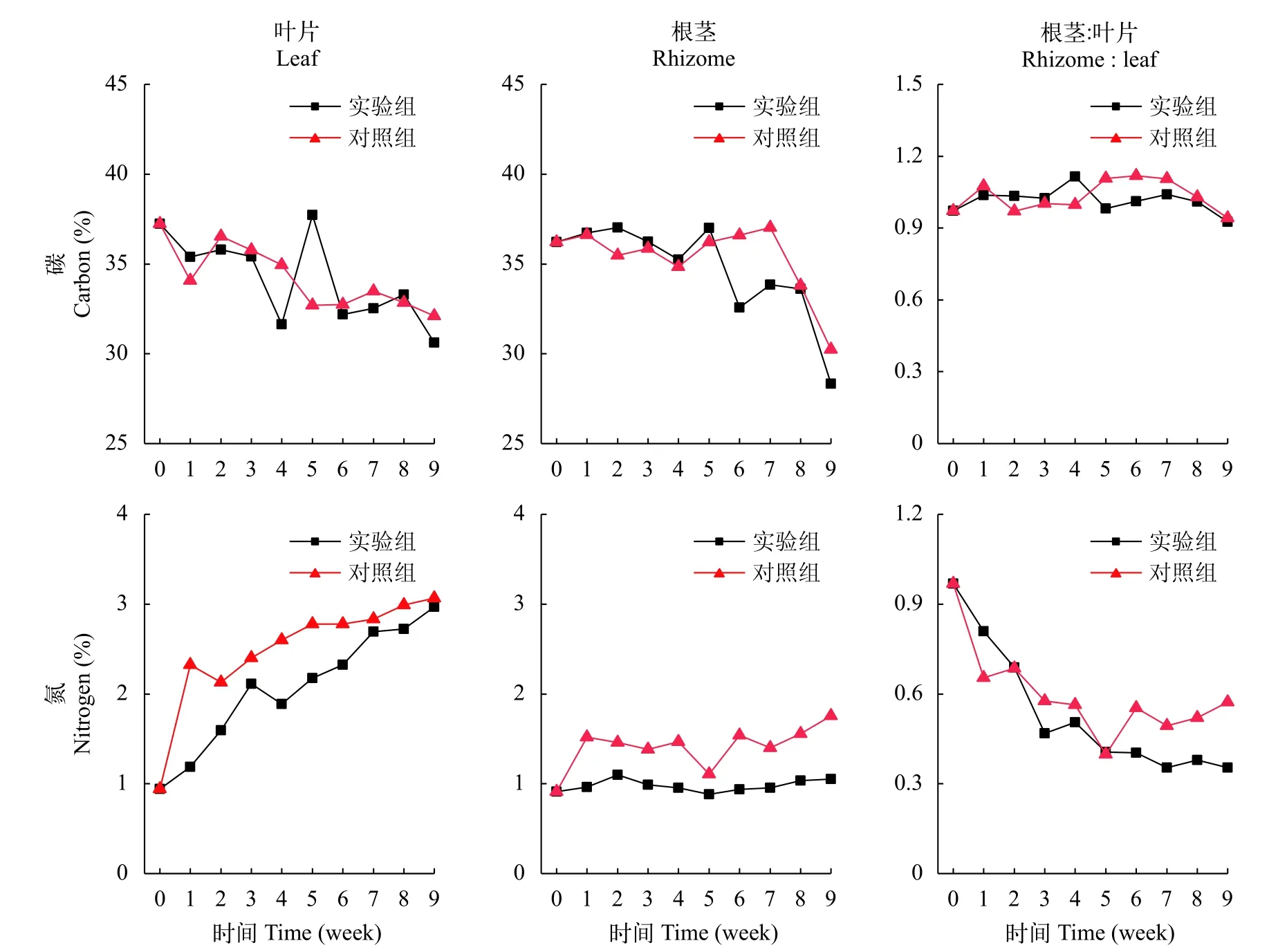
圖 5 苦草的碳(C)和氮(N)含量變化Fig. 5 Changes of carbon (C) and nitrogen (N) contents in V. natans
3 討論
3.1 弱光環境對苦草影響
植物通過光和色素吸收光能, 將無機碳和水轉化為有機物, 用于自身合成和代謝, 湖泊底部良好的光照是沉水植物生長的基本前提。在洱海湖心平臺所測的湖底光合有效輻射強度平均值是10.5 μmol/(m2·s), 略高于他人研究報道的苦草光補償點9.4 μmol/(m2·s)[29], 所以弱光是苦草植被恢復的主要限制因子。
在實驗結束時, 實驗桶內的苦草存活數量已穩定下來, 存活數量顯著小于初始種植數量。相比于初始狀態, 單株苦草的葉生物量、根生物量及根長和葉長均顯著性下降。有研究表明, 隨水深梯度的增加苦草生物量和和無性系分株數顯著性下降, 而株高呈先增加后降低的趨勢[31], 本研究結果與其一致。一方面苦草株高和生物量下降, 使其長期處于弱光脅迫下;另一方面低光照會減弱沉水植物的脅迫耐受能力[32], 兩者共同解釋了前面苦草存活株數小于初始種植株數的實驗結果。苦草葉片的游離氨基酸含量上升, 而C含量、淀粉含量和可溶性糖含量下降, N含量上升; 根莖的游離氨基酸含量上升, 可溶性糖的含量先上升后下降, C含量下降, N含量上升。有文獻報道水下光強的大幅降低能導致沉水植物出現生理脅迫, 包括植物組織N含量增加, 碳源性次生化學產物的含量下降, 比如可溶性糖和酚類[33,34]。苦草的生理響應可見苦草出現一定程度的脅迫反應。

表 3 樣本t 檢驗苦草生理指標在兩種底質間的差異顯著性分析Tab. 3 Significant analysis on the difference of physiological indexes of V. natans between two kinds of sediment by t test
在苦草形態響應弱光環境的過程中, 苦草對不同器官的資源重新分配有一定的差異。相比于初始狀態, 苦草根莖和葉片的生物量比值上升, 而根莖與葉片的長度比值下降, 實驗結果與張素娟的研究結果一致[35]。兩種器官相對比, 葉片的生物量損失相對更大, 而長度降低幅度相對較小, 這也反映了苦草為適應弱光環境發生了一些形態上的改變,因為苦草植株的高度很大程度取決于葉片的長度,并且苦草需要根的定植才能存活。弱光脅迫可以引起細胞活性氧的產生和積累, 誘導相關酶系統活性增強[11,36], 氨基酸是合成酶的物質基礎, 有許多文獻表明游離氨基酸含量是指示環境脅迫的重要生理指標[37,38]。與根莖相比, 苦草葉片的游離氨基酸含量上升幅度更大, 并且根莖和葉片的氨基酸含量比值大幅降低, 這說明苦草氨基酸的合成主要發生在葉片細胞中, 葉片細胞的脅迫響應更顯著。可溶性糖是植物能直接利用的能源物質[39], 在弱光脅迫下, 光合作用合成糖類和ATP的量都很低, 但用于合成氨基酸的能量和糖類的需求增多, 植株需要消耗淀粉分解成糖以提供能量基礎, 所以植株儲存的碳水化合物的含量與植物對不良環境的耐受能力息息相關[40]。苦草葉片的可溶性糖含量大幅降低, 而根莖的可溶性糖含量先升高后下降, 根莖和葉片的可溶性糖含量比值也先升高后下降, 這也表明了根莖細胞對逆境的抵抗能力相對更強; 根莖與葉片的淀粉含量比值大幅升高, 說明葉細胞受到弱光脅迫造成的能量損耗遠大于根莖的細胞, 當能量不能滿足代謝損耗時, 逆境抵抗能力也因此下降,造成細胞死亡。

圖 6 苦草的游離氨基酸、可溶性糖和淀粉含量變化Fig. 6 Changes of free amino acid, soluble carbohydrate and starch content in V. natans
3.2 在弱光環境下不同底質對苦草影響
在實驗期間, 淤泥和黏土2種底質下苦草存活數量表現出顯著性差異, 在實驗結束時, 實驗組(黏土底質)和對照組(淤泥底質)存活數量平均值分別是18和10株/桶, 實驗組大于對照組。并且底質因素對苦草根莖生物量也顯著性影響, 表現為實驗組大于對照組。雖然有研究報道在光照合適的條件下, 相比于黏土底質, 苦草更適合在高營養的湖泥中生長[41,42], 但是在弱光環境下, 底質對沉水植物生長影響的研究卻比較少, 并且, 李文朝[43]的研究認為, 底質條件是否適合沉水植物生長, 不僅取決于底質本身, 很大程度受制于湖水溫度和水深,30℃且水深遠大于l m時, 底泥和底層湖水中的厭氧環境會引起沉水植物爛根, 另外, 底泥的物理結構與沉水植物的扎根能力和扎根深度密切相關[44],密度大、孔隙小的黏土在根系的附著上占優勢。
在生理特征上, 葉片的N含量及根莖的N含量和氨基酸含量在不同底質處理下有顯著性差異, 均表現為實驗組小于對照組, 這說明實驗組苦草受到程度更小的生理脅迫, 并且不同底質條件苦草根莖的淀粉含量比較, 實驗組組顯著性大于對照組, 這也說明了實驗組苦草受到的脅迫損傷相對更小。以上2點均為2種底質條件下苦草存活率和形態特征的差異提供了一定的解釋。沉水植物可以直接從底質中吸收氮等營養鹽, 并且, 由于氨態氮濃度在底泥中往往比湖水高, 沉水植物吸收的氮主要來源于底泥[12]。相對于黏土底質, 淤泥底質的N含量約為黏土的9.9倍, 苦草葉片、根莖的N含量和氨基酸含量在不同底質之間的差異與兩種底質N含量的極大差異有關, 另外底泥中有機物含量和底泥營養含量密切相關, 過多的有機物分解可造成底泥缺氧和還原性的狀態, 對植物有毒害作用[45,46], 這也為本次實驗結果提供了一個較合理的解釋。
綜合來看, 在弱光環境下對比于淤泥對照組,黏土實驗組的苦草在生理上表現出幅度更小的脅迫響應, 同時受到相對更小的脅迫損傷, 使其根莖的生物量顯著大于對照組, 死亡植株數下降, 存活數量顯著大于對照組。所以使用黏土代替本底淤泥的措施對苦草的恢復有利。
3.3 苦草恢復的可行性分析和恢復策略
因為對照組底質是在湖心平臺退化區直接采取的底泥, 所以從對照組的苦草存活數量和形態特征來看, 雖然在實驗結束時, 苦草留有一定的存活數量, 但是苦草形態特征并沒有明顯的上升現象,并且實驗并未發現有大規模的分株現象, 所以此時的退化區環境并不適合直接進行沉水植物恢復工程, 應該優先考慮改善環境特征。因為光照是限制苦草生長的主要限制性因子, 應該采取降低水位和水體營養鹽濃度以增加透明度等提高水下光合有效輻射的措施, 或者尋找或馴化出對弱光環境適應性更強的沉水植物品種等。另外, 雖然底質因素對苦草存活數的方差變異解釋度只有2.9%, 對根莖的生物量的方差變異解釋度只有6.3%, 但是都有顯著性影響, 所以, 底質因素也是影響苦草恢復的重要因子, 從淤泥對照組和黏土實驗組的對比來看, 黏土實驗組存活數量大于淤泥對照組, 黏土底質條件下苦草擁有更高的存活率, 并且黏土底質條件下苦草受到的脅迫損傷相對更小, 所以使用黏土實施底質改善措施對苦草的恢復有積極的作用。
4 結論
(1)在平均光強略高于苦草光補償點的極度弱光[8.3—15.8 μmol/(cm2·s)]和水深6.1—6.6 m的洱海湖底, 桶栽的苦草部分死亡, 存活數量下降, 并在形態特征和生理特征上均表現出脅迫響應, 其單株生物量和株高下降, N含量和游離氨基酸含量上升,C含量和淀粉含量下降。(2)苦草不同器官對弱光環境的響應有所差異, 葉片(地上部分)受到的脅迫影響大于根莖(地下部分)。(3)苦草對弱光環境的響應在黏土和湖底淤泥2種不同底質條件下有顯著性差異, 苦草在黏土底質上表現出更小的脅迫反應和更高的存活數量, 2種底質相比較, 黏土更適合作為苦草恢復的底質條件。研究表明, 在洱海當前的水質環境下有希望結合局部的底質改善來實現在湖心平臺的沉水植物恢復。

