樺木酸對T-2毒素誘導小鼠肝損傷的保護作用
楊成林,黃 超,劉 娟,黃衛梅,袁志航,易金娥,2,梁曾恩妮,鄔 靜,2,*
(1.湖南農業大學動物醫學院,湖南 長沙 410128;2.畜禽保健湖南省工程研究中心,湖南 長沙 410128;3.湖南省農產品加工研究所,湖南 長沙 410125)
霉菌毒素是由霉菌產生的有毒次級代謝產物,根據產生霉菌的不同又分為曲霉菌屬毒素、鐮刀菌屬毒素、青霉菌屬毒素等。自然界中,霉菌毒素能夠污染多種農作物及農產品,進而對人類健康和動物福利造成諸多危害[1]。T-2毒素屬于鐮刀菌屬中毒性最強的A型單端孢酶烯族真菌毒素,可通過口腔、腸道、皮膚等途徑進入機體,造成人體免疫系統、消化系統、神經系統、生殖系統等多種系統受損,導致飲食中毒性白細胞缺乏癥、大骨節病等[2]。同時,T-2毒素還可引起動物的慢性或急性中毒,表現為虛脫、惡心、腹痛、血便、休克等癥狀,最終引發生長遲緩、飼料排斥和胃腸道功能障礙等健康問題[3-4]。大量研究證實肝臟是T-2毒素在體內的靶器官之一,低劑量的T-2毒素即可降低抗氧化酶的活性,造成動物肝臟出現氧化應激,產生大量活性氧(reactive oxygen species,ROS)和丙二醛(malondialdehyde,MDA),引發肝臟脂質過氧化,抑制肝臟蛋白質的合成,進而導致肝細胞凋亡,可見氧化應激在T-2毒素引發的肝臟損傷過程中起著關鍵作用[5-7]。
樺木酸(betulinic acid,BA)是一種天然的五環三萜類化合物,廣泛存在于以樺屬植物白樺為主的多種植物和水果中,具有抗病毒、抗菌、抗炎、抗腫瘤和抗氧化等多種藥理作用[8-10]。前期研究已證明BA能夠緩解酒精誘導的肝損傷,調節谷丙轉氨酶(alanine aminotransferase,ALT)、谷草轉氨酶(aspartate transaminase,AST)、血清總膽固醇和甘油三酯水平,升高抗氧化酶超氧化物歧化酶(superoxide dismutase,SOD)、過氧化氫酶(catalase,CAT)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)活性,降低MDA含量[11]。BA能夠清除地塞米松誘導胸腺細胞產生的ROS,減少細胞凋亡[12]。在脂多糖誘導的急性肝損傷中,BA預處理能夠升高還原型谷胱甘肽(glutathione,GSH)含量和CAT活性,降低了MDA含量,表現出明顯的抗氧化活性[13]。因此推測BA可借助其抗氧化作用成為T-2毒素的潛在解毒劑。此外,鑒于Janus激酶/信號傳導與轉錄激活因子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)信號通路在氧化應激介導的細胞凋亡中所發揮的重要作用[14],本研究以JAK/STAT信號為切入點,探討天然產物BA對T-2毒素所致肝損傷的保護作用及其作用機理,為將BA開發為T-2毒素天然解毒劑提供理論參考。
1 材料與方法
1.1 動物、材料與試劑
60 只4~5 周齡SPF級健康雄性昆明小鼠(生產許可證號:SCXK(湘)2019-0004),飼料為M02小鼠普通飼料,均購于湖南斯萊克景達實驗動物公司。
BA、VE 美國Sigma-Aldrich公司;T-2毒素 青島普瑞邦生物工程有限公司。
ALP、AST、ALT、總蛋白(total protein,TP)、白蛋白(albumin,ALB)、球蛋白(globulion,GLB)檢測試劑 深圳邁瑞生物醫療電子有限公司; SOD、CAT、MDA、T-AOC、GSH檢測試劑盒 南京建成生物工程研究所;增強型化學發光液、TUNEL 試劑盒 江蘇凱基生物技術股份有限公司;β-actin、JAK2、STAT3、Bax、Bcl-2、p-STAT3、p-JAK2、Caspase-3抗體 美國Cell Signaling Technology公司。
1.2 儀器與設備
1.3 方法
1.3.1 實驗分組與給藥
60 只昆明小鼠適應性飼養1 周,自由采食和飲水, 溫度21~25 ℃、相對濕度50%~70%。適應性飼養結束后,將60 只小鼠隨機分為6 組,即空白對照組,T-2毒素組,BA低、中、高劑量組(0.25、0.5、 1 mg/kgmbBA+T-2毒素),VE干預組(100 mg/kgmbVE+ T-2毒素)。BA混懸于質量分數1%的可溶性淀粉溶液中,每天灌胃1 次,空白對照組和T-2毒素組僅灌胃質量分數1%的可溶性淀粉溶液,連續灌胃14 d。灌胃結束后,空白對照組小鼠按10 mL/kgmb腹腔注射體積分數75%乙醇溶液和磷酸鹽緩沖液(phosphate buffered saline,PBS)混合液(體積比1∶12.5),其余5 組小鼠均腹腔注射T-2毒素(4 mg/kgmb)誘導肝損傷模型,15 h禁食不禁水處理,10%水合氯醛腹腔注射麻醉后對小鼠進行眼眶采血和處死,解剖采集組織樣本。
1.3.2 組織樣本分離與保存
采集小鼠肝臟,拍照、稱質量,切取肝左葉固定于體積分數4%中性甲醛溶液中,其余部分分裝于-80 ℃保存備用。采集的血樣放置于4 ℃保存過夜后,冷凍離心機3000 r/min離心10 min分離血清,分離的血清置于-80 ℃保存備用。
1.3.3 血清生化指標測定
采用檢測試劑和全自動血液生化分析儀對血清中ALP、ALT、AST活力和TP、ALB、GLB質量濃度進行測定。
1.3.4 肝組織抗氧化能力測定
從及物動詞的內部分類看,“買”是只能帶體詞性賓語(名詞、代詞、數量詞)的動詞;根據語義的主要特征和與之相關的語法特征,動詞“買”屬于動作動詞中的弱持續動詞;從動作行為是有意識的還是無意識的角度看,“買”屬于自主動詞,從語義上說它是能表示有意識的或有心的動作行為的動詞,即“買”這個動作行為是能由動作發出者做主、主觀決定、自由支配的動作行為。
取肝臟組織研磨、離心(4000 r/min、10 min),吸取上清液,嚴格遵循試劑盒使用說明,檢測肝組織中T-AOC和CAT、SOD活力以及GSH、MDA含量。
1.3.5 肝臟組織病理學分析
取固定好的肝臟組織樣本,用雙蒸水沖洗,經乙醇脫水后嵌入石蠟,切成厚度5 μm的薄片并置于玻片上,二甲苯和不同體積分數乙醇脫蠟,蘇木精和伊紅染色,進行組織學觀察。
1.3.6 TUNEL法檢測細胞凋亡
用含有蛋白酶K(20 μg/mL)的PBS清洗石蠟切片,于37 ℃下孵育30 min,進行組織修復,再次用PBS沖洗3 次,隨后添加破膜工作液,常溫孵育20 min,PBS漂洗3 次,將試劑1(末端轉移酶)和試劑2(異硫氰酸熒光素(fluorescein isothiocyanate,FITC)標記的脫氧尿苷三磷酸(deoxyuridine triphosphate,dUTP))按體積比2∶29的比例進行配制,組織避光孵育2 h,4’,6-二脒基-2-苯 基吲哚(4’,6-diamidino-2-phenylindole,DAPI)標記10 min,對細胞核染色,通過熒光顯微鏡觀察。
1.3.7 Western blot法檢測蛋白表達水平
取肝組織加入裂解液后研磨,收集上清液,使用BCA蛋白檢測試劑盒測定蛋白濃度。用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離,質量分數10%分離膠。 電泳結束轉至聚偏二氟乙烯膜,用含5%脫脂奶粉的TBST緩沖液封閉1 h,加入β-actin、Bax、Bcl-2、Caspsae-3、STAT3、p-STAT3、JAK2和p-JAK2抗體孵育過夜,TBST沖洗3 次,每次10 min,加入二抗孵育1 h,TBST再次沖洗3 次,每次10 min,將聚偏二氟乙烯膜放置在凝膠成像儀暗室中,加入電化學發光試劑,使用Image軟件對目的蛋白條帶灰度值進行相對定量分析。
1.4 數據處理與分析
采用SPSS 21.0軟件進行數據統計分析,結果以平均值±標準差表示。采用單因素方差分析進行差異顯著性分析,P<0.05為差異顯著,P<0.01為差異極顯著。
2 結果與分析
2.1 BA預處理對T-2毒素致肝損傷小鼠肝臟外觀的影響
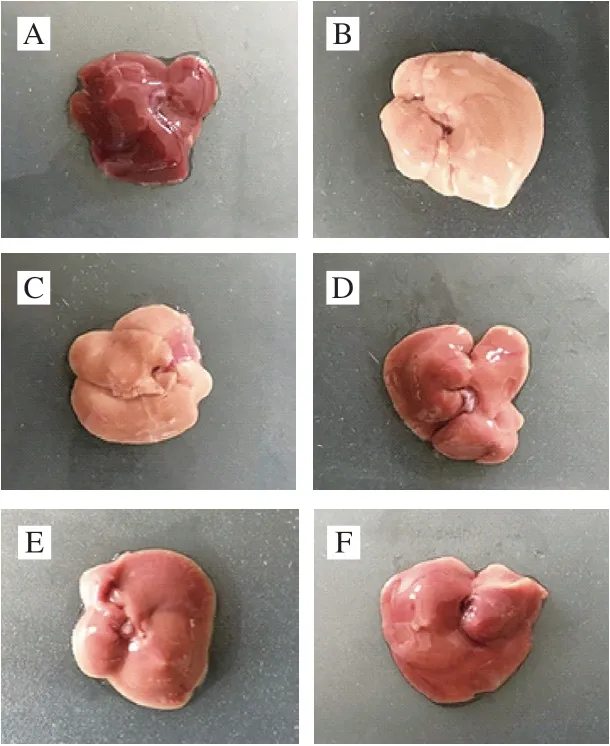
圖 1 BA預處理對T-2毒素誘導肝損傷小鼠肝臟外觀的影響Fig. 1 Effect of BA pretreatment on liver appearance in mice with liver injury induced by T-2 toxin
如圖1所示,空白對照組小鼠肝葉、肝邊緣清晰,結構正常。與空白對照組相比,T-2毒素組小鼠肝臟顏色呈粉白色,質地堅硬,有黃白色奶酪狀的壞死凸起。與T-2毒素組相比,BA預處理明顯改善了肝臟的顏色、質地,顏色由粉白色逐漸恢復正常,壞死凸起數量逐漸減少,并呈現一定的劑量依賴性,肉眼觀察BA高劑量組和陽性對照VE干預組小鼠肝臟外觀沒有明顯差異。以上結果表明,BA預處理能夠改善T-2毒素對肝臟的損傷作用。
2.2 BA預處理對T-2毒素致小鼠肝臟病理學的影響
如圖2所示,空白對照組中可見正常的肝索、肝竇結構,肝細胞索排列整齊,細胞形態正常,無炎癥變化。與空白對照組相比,T-2毒素組肝組織正常結構消失,無明顯的肝索、肝竇,并伴有炎性細胞浸潤和細胞壞死。與T-2毒素組相比,BA預處理后,小鼠肝組織中肝索、肝竇等結構逐漸恢復,炎性細胞和壞死細胞數量明顯減少,并呈現出一定的劑量依賴性。以上結果表明,T-2毒素能夠誘導肝臟損傷,并造成肝結構紊亂、細胞壞死等病理變化,而BA預處理能夠改善這些變化。
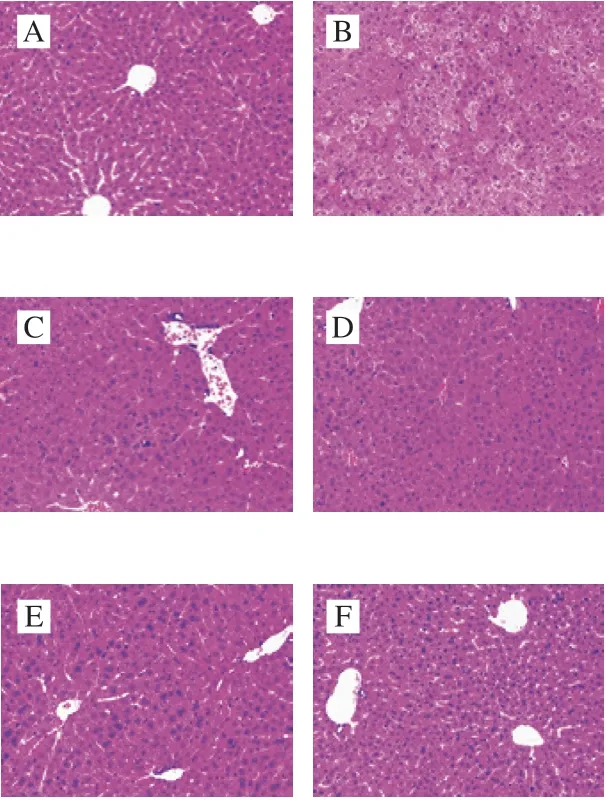
圖 2 BA預處理對T-2毒素誘導小鼠肝臟病理變化的影響Fig. 2 Effect of BA pretreatment on pathological changes of liver tissues induced by T-2 toxin in mice
2.3 BA預處理對T-2毒素致小鼠肝臟損傷血清生化指標的影響
ALP、ALT、AST活力是臨床中檢測肝損傷的重要指標,它們的異常變化表明肝臟受損。如圖3所示,與空白對照組相比,T-2毒素組小鼠血清ALP、ALT、AST活力極顯著升高(P<0.01),血清TP質量濃度、ALB/GLB比值極顯著降低(P<0.01),表明T-2毒素導致肝損傷。與T-2毒素組相比,中、高劑量的BA預處理能夠極顯著降低血清ALT、AST活力(P<0.01);高劑量的BA預處理能夠顯著降低血清ALP活力和顯著升高TP質量濃度 (P<0.05);各劑量BA預處理均能升高ALB/GLB比值,但與T-2毒素組無顯著差異(P>0.05)。以上結果表明,BA預處理能有效緩解T-2毒素引起的血清生化指標的異常變化,從而減輕肝損傷。
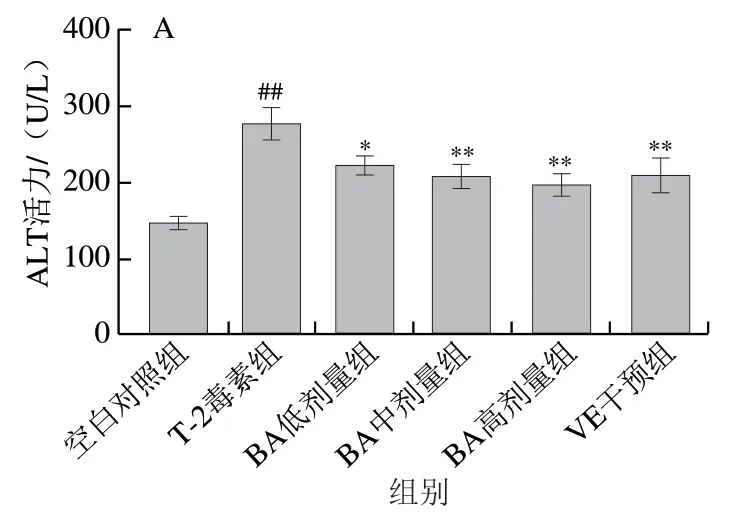

圖 3 BA預處理對T-2毒素致肝損傷小鼠肝臟功能相關血清 生化指標的影響Fig. 3 Effect of BA pretreatment on serum biochemical indexes related to liver function in mice with liver injury caused by T-2 toxin
2.4 BA預處理對T-2毒素致小鼠肝臟氧化損傷相關指標的影響
如圖4所示,與空白對照組相比,T-2毒素處理極顯著降低了小鼠肝組織中SOD、CAT、T-AOC以及GSH水平(P<0.01),極顯著升高了小鼠肝組織中MDA含量(P<0.01),表明T-2毒素造成小鼠肝臟的氧化損傷。與T-2毒素組相比,中、高劑量BA預處理極顯著升高了肝組織中T-AOC和SOD活力(P<0.01);高劑量BA預處理極顯著升高肝組織中CAT活力(P<0.01);BA預處理極顯著升高了肝組織中GSH含量,并極顯著降低了MDA含量,呈劑量依賴性。以上結果表明,BA預處理能夠通過增強機體的抗氧化酶活性降低MDA含量,從而保護肝臟免受T-2毒素造成的氧化損傷。


圖 4 BA預處理對T-2毒素誘導小鼠肝臟氧化損傷相關指標的影響Fig. 4 Effect of BA pretreatment on oxidative damage indexes of liver tissues in mice induced by T-2 toxin
2.5 BA預處理對T-2毒素致小鼠肝臟細胞凋亡的影響
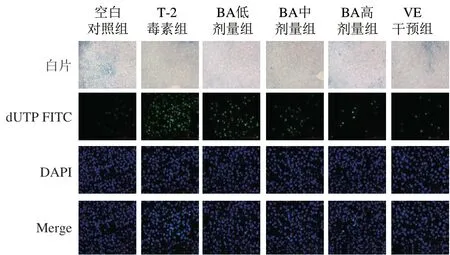
圖 5 BA預處理對T-2毒素致小鼠肝臟細胞凋亡的影響Fig. 5 Effect of BA pretreatment on apoptosis of hepatocytes in mice induced by T-2 toxin
細胞發生凋亡時會激活DNA內切酶,使DNA發生斷裂,斷裂DNA暴露的3’-OH端能夠在末端脫氧核苷酸轉移酶的催化下被綠色的熒光探針FITC所標記,進而反映細胞的凋亡情況。如圖5所示,與空白對照組相比,T-2毒素組綠色熒光標記的凋亡細胞數量明顯增多,而BA預處理后凋亡細胞數量呈劑量依賴性減少。以上結果表明,T-2毒素能夠誘導小鼠肝組織中的細胞凋亡,而BA預處理能夠減少細胞凋亡的發生。
2.6 BA預處理對T-2毒素致小鼠肝臟細胞凋亡相關蛋白表達的影響
2.6.1 BA預處理對T-2毒素致小鼠肝臟細胞中Bax、Bcl-2、Caspase-3蛋白表達的影響
如圖6所示,與空白對照組相比,T-2毒素處理極顯著升高了Bcl-2/Bax、剪切型Caspase-3/pro-Caspase-3比值(P<0.01),表明T-2毒素能夠激活促凋亡蛋白Bax的表達,抑制抗凋亡蛋白Bcl-2的表達,并激活Caspase-3,從而誘導細胞發生凋亡。與T-2毒素組相比,BA預處理呈劑量依賴性極顯著降低Bcl-2/Bax比值(P<0.01),中、高劑量BA預處理顯著降低剪切型Caspase-3/pro-Caspase-3比值 (P<0.05)。以上結果表明,T-2毒素通過激活Bax和Caspase-3誘導肝細胞凋亡,而BA預處理能夠抑制Bax和Caspase-3的激活,從而減少細胞凋亡的發生。
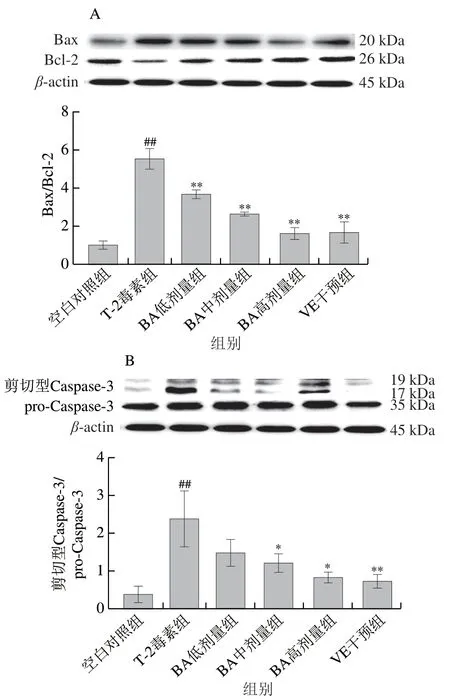
圖 6 BA預處理對T-2毒素致小鼠肝臟細胞Bax、Bcl-2、Caspase-3 蛋白表達的影響Fig. 6 Effect of BA pretreatment on the expression of Bax, Bcl-2 and caspase-3 proteins in mice induced by T-2 toxin
2.6.2 BA預處理對T-2毒素致小鼠肝臟細胞中JAK2、STAT3蛋白表達的影響

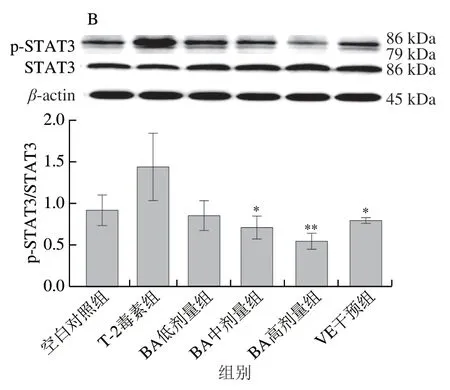
圖 7 BA預處理對T-2毒素致小鼠肝臟細胞中JAK2、STAT3 蛋白表達的影響Fig. 7 Effect of BA pretreatment on the expression of JAK2 and STAT3 proteins in hepatocytes of mice induced by T-2 toxin
如圖7所示,與空白對照組比,T-2毒素處理升高小鼠肝臟細胞中p-JAK2/JAK2及p-STAT3/STAT3比值, 提示T-2毒素激活了JAK2/STAT3信號通路。與T-2毒素組相比,低、高劑量的BA預處理極顯著降低了 p-JAK2/JAK2比值(P<0.01);與T-2毒素組相比,BA呈劑量依賴性降低了p-STAT3/STAT3比值,高劑量時差異極顯著(P<0.01),表明BA預處理抑制了JAK2/STAT3信號通路的激活。以上結果表明,BA緩解T-2毒素誘導的細胞凋亡可能與JAK2/STAT3信號通路有關。
3 討 論
血清中ALT、AST、ALP活力直接反映肝臟功能狀態和損傷程度[15-16],其水平異常是診斷肝臟病變的重要指標,ALB/GLB比值對肝臟疾病的臨床診斷和治療同樣具有重要意義[17-18]。有研究顯示,在暴露于T-2毒素的山齒鶉和肉雞肝臟中觀察到壞死和脂肪堆積,同時AST、ALP和ALT水平升高,TP含量降低[19-20]。在本研究中也得到了相似結果,T-2毒素組小鼠血清ALP、ALT和AST活力極顯著高于空白對照組,TP質量濃度和ALB/GLB比值極顯著降低,提示T-2毒素可造成小鼠的肝損傷。而T-2毒素引起中毒的重要機制是氧化應激,通過降低SOD、CAT和GSH-Px等抗氧化酶的活性,增加ROS和MDA的產生,促進脂質過氧化,最終導致細胞甚至組織的 損傷[21-23]。在本研究中,T-2毒素極顯著降低小鼠肝臟組織T-AOC,CAT、SOD活力和GSH含量,同時極顯著增加MDA含量;病理剖檢可見肝臟顏色呈粉白色,質地較硬且缺少彈性,肝臟邊緣較鈍;切片圖像觀察結果顯示肝臟中肝索和肝竇消失,炎癥細胞浸潤和肝細胞壞死,提示氧化應激在T-2毒素引發的小鼠肝損傷過程中 起著重要作用,這與Deng Yijia等[24]的研究結果一致。BA作為一種天然產物,不僅可通過增強小鼠抗氧化能力減輕乙醇對小鼠造成的肝臟損傷[25],也能夠劑量依賴性地修復T-2毒素引起的人正常肝細胞(L02)氧化損傷[26]。因此,本研究探討了BA對T-2毒素通過氧化應激導致小鼠肝細胞損傷的保護作用,結果顯示,與T-2毒素組比較,BA預處理能夠顯著升高小鼠肝組織中T-AOC,SOD、CAT活力和GSH含量,并極顯著降低MDA含量,拮抗由T-2毒素造成的肝臟氧化損傷。此外,BA預處理后可顯著降低小鼠血清ALT、AST、ALP活力,升高TP水平和 ALB/GLB比值,表明BA預處理能夠保護肝臟免受T-2毒素的毒性作用,顯著減少肝臟炎性細胞的浸潤及壞死細胞生成,改善肝臟的外觀、色澤和質地。
研究發現,T-2毒素可激活線粒體信號通路中凋亡調節蛋白Bax、Bcl-2、Caspase-3的表達,誘導L02肝細胞凋亡[27]。JAK2/STAT3信號通路是多種天然化合物和藥物的有效靶點,參與調控腫瘤細胞增殖[28-29]。Zhang Lei等[30]研究發現,抑制JAK2/STAT3信號通路可以減輕氧化 應激,下調Bax/Bcl-2比值,抑制腎細胞凋亡,促進細胞存活。本研究中,TUNEL檢測結果顯示,T-2毒素誘導了小鼠肝細胞的凋亡;Western blot檢測結果顯示,T-2毒素上調了p-STAT3/STAT3、p-JAK2/JAK2、Bax/Bcl-2比值,以及Caspase-3的表達,而BA預處理能夠顯著下調 JAK2/STAT3信號通路和Bax/Bcl-2比值,抑制Caspase-3的激活,提示JAK2/STAT3調控的細胞凋亡可能在BA對T-2毒素致肝損傷的保護過程中發揮重要作用。

圖 8 BA預處理對T-2毒素致小鼠肝損傷的保護作用及其機制Fig. 8 Protective effect of BA pretreatment on liver injury induced by T-2 toxin in mice and its underlying mechanism
本研究結果表明,BA對T-2毒素通過氧化應激所致的小鼠肝臟氧化損傷具有保護作用,而JAK2/STAT3介導的細胞凋亡可能在這一過程中發揮重要的調控作用 (圖8),以上結果為將BA開發成一種T-2毒素解毒劑提供了關鍵的實驗依據。

