應用CRISPR/Cas13a快速鑒定布魯氏菌
黃明耀,梁文立,吳婉婷,劉 足,謝淑媚,鄧穎穎,傅俊方,姜長宏,龍 軍,江凌曉
布魯氏菌病(Brucellosis)簡稱“布病”,是一種具有傳染性的人獸共患病,由布魯氏菌引起。臨床鑒定布魯氏菌的方法主要有需氧血培養和血清學檢測,其中培養是金標準。當臨床發現不明原因發熱的患者時,通常抽取10 mL靜脈血到血培養瓶進行培養,血培養報陽后轉至血平板繼續培養16~24 h,通過質譜儀或微生物鑒定系統進行鑒定,至少需要18~48 h,而且在平板培養觀察以及調制菌懸液的過程中易產生氣溶膠,存在實驗室感染風險。本研究擬建立一種基于CRISPR/Cas13a的布魯氏菌鑒定方法,該方法可以對需氧血培養陽性培養物中存在的布魯氏菌進行快速準確鑒定。
1 材料與方法
1.1材 料
1.1.1實驗菌株 布魯氏菌64株(由廣東省CDC提取DNA后提供,菌株均分離自臨床患者全血培養物),包括羊種布魯氏菌27株、豬種布魯氏菌7株、牛種布魯氏菌1株和未知亞種布魯氏菌29株。
非布魯氏菌56株:包括革蘭陰性桿菌28株(沙門氏菌2株、大腸埃希菌5株、陰溝腸桿菌1株、產氣腸桿菌1株、肺炎克雷伯氏菌3株、產酸克雷伯菌1株、鮑曼不動桿菌5株、銅綠假單胞菌3株、粘質沙雷氏菌2株、瓊氏不動桿菌1株、嗜麥芽窄食單胞菌1株、嗜水/豚鼠氣單胞菌1株、腦膜敗血伊麗莎白金菌1株、皮氏羅爾斯頓菌1株)、革蘭陽性球菌24株(無乳鏈球菌2株、化膿鏈球菌1株、星座鏈球菌1株、咽峽鏈球菌1株、表皮葡萄球菌2株、金黃色葡萄球菌3株、緩慢葡萄球菌1株、溶血葡萄球菌2株、頭部葡萄球菌2株、人葡萄球菌2株、糞腸球菌4株、屎腸球菌1株、苛養顆粒鏈菌1株、膠粘羅斯菌1株)、革蘭陽性桿菌1株(非發酵棒狀桿菌1株)、真菌1株(紅曲霉1株)以及和布魯氏菌親緣關系相近的人蒼白桿菌1株和流感嗜血桿菌1株[1-2]。以上菌株均經過VITEK 2或VITEK MS鑒定,并由本室保存。
1.1.2人類DNA 人類DNA購自索萊寶科技有限公司(中國北京)。
1.1.3臨床樣本 臨床收集的57例成人需氧陽性血培養瓶,包括55例靜脈血培養的培養瓶和2例關節積液培養的培養瓶,來自41個患者。其中36例報陽時間≥2.0 d,21例報陽時間為1.5~2.0 d。
1.1.4引物、crRNA和ssRNA 正向引物BCSP31-F6(5′→3′):5′-TAATACGACTCACTATAGGGGGGCGCTCTGGAGTCCGGCTTTACGC-AGTC-3′。反向引物BCSP31-R6(3′→5′):3′-GACCGATTTGATGTTTGCATCCTTACGCGC-AACGA-5′。crRNA:5′-GGGGAUUUAGACUA-CCCCAAAAACGAAGGGGACUAAAACGGU-AAAGCGUCGCCAGAAGGCGCAAAUC-3′。ssRNA探針:5′-6-FAM-UUUUUC-BHQ1。
1.1.5Cas13a蛋白 Cas13a的開放閱讀框(open reading frame, ORF)是優化密碼子后合成的,然后將Cas13a ORF克隆到表達載體Pc013中,并轉染到大腸桿菌BL21中。大腸桿菌BL21首先在37 ℃下生長,然后與IPTG在16 ℃下孵育。再使用Ni-NTA方法從裂解細菌中純化蛋白,將純化蛋白樣本等分保存在-80 ℃下[3]。其他試劑如重組酶聚合酶、NTP、Buffer A和Buffer B等購自生工生物工程股份有限公司(中國上海)。
1.1.6儀器 Real-Time PCR儀Gentier 48E購自天隆科技有限公司(中國西安)。
1.2方 法
1.2.1陽性血培養瓶處理 用注射器抽取符合時間要求的需氧陽性血培養瓶菌液1.2 mL,其中0.1 mL(約2滴)接種至血平板,常規培養16~24 h,進行VITEK 2或VITEK MS鑒定;剩余菌液轉移至1.5 mL EP管中,100 ℃ 30 min滅活,以3 000 r/min離心3 min后取500 μL上清菌液,存-20 ℃備用。
1.2.2 核酸提取
1.2.2.1實驗菌株核酸提取 將凍存的56株非布魯氏菌菌株復蘇,分別接種至血平板,培養16~24 h后取單個菌落,用1 mL生理鹽水洗脫至1.5 mL EP管中。隨后再將菌液以13 000 r/min離心10 min,棄上清余下50 μL沉淀。震蕩混勻后100 ℃ 10 min,再次13 000 r/min離心10 min,取2.5 μL的上清液作為CRISPR/Cas13a-Brucella模板。
1.2.2.2陽性血培養瓶凍存菌液核酸提取 -20 ℃凍存上清菌液500 μL,13 000 r/min離心10 min,棄上清余下50 μL沉淀。震蕩混勻后100 ℃ 10 min,再次13 000 r/min離心10 min,取2.5 μL上清液作為CRISPR/Cas13a-Brucella模板。
1.2.3CRISPR/Cas13a-Brucella分析 CRISPR/Cas13a-Brucella分析包括重組酶聚合酶擴增(Reverse-transcription Recombinase Polymerase Amplification, RPA)、T7轉錄以及Cas13a檢測[3]。
擴增體系(25 μL):每個反應包含2.5 μL模板、正反引物各0.5 μL(濃度均為10 μmol/L)、20.75 μL的Buffer A、1.25 μL的Buffer B(濃度為14 mmol/L醋酸鎂)和RPA酶混合物。每個反應共有25 μL混合物。
反應體系(4 μL):每個反應包含crRNA 1 μL(濃度為33.3 nmol/L)、Cas13a蛋白1 μL(濃度為66.7 nmol/L)、0.25 μL的T7 RNA聚合酶(安諾論生物科技有限公司,北京)、1.25 μL的NTP(濃度為10 mmol/L)和ssRNA探針0.5 μL(濃度為166 nmol/L)。每個反應共有4 μL CRISPR/Cas13a反應混合物。
檢測:首先將配好的擴增體系置于37 ℃恒溫金屬浴中孵育30 min,然后添加4 μL CRISPR/Cas13a反應混合物。即刻用PCR儀進行熒光信號檢測,每分鐘檢測1次熒光信號,持續收集30 min熒光信號。每批實驗以無核酸酶水為陰性質控NC,以0.46 ng/μL 的布魯氏菌提純DNA為陽性質控。
結果判讀:首先根據待測樣本的終點熒光值和初始熒光值計算待測樣本的擴增趨勢值(Amplification trend value,AT),AT=待測樣本終點熒光值/待測樣本初始熒光值;然后根據待測樣本終點熒光值與陰性質控NC的終點熒光值計算待測樣本的熒光倍數變化值(Fluorescence multiple change value,FC),FC=待測樣本終點熒光值/NC終點熒光值。當FC≥2且AT≥2時,判斷為陽性;當FC≥2而1
1.2.4檢測下限(LOD)評估 布魯氏菌純DNA通過Qubit(Thermo Fisher,Massachusetts)測定濃度,使用以下公式計算基因組拷貝數:拷貝數=(6.02×1023)×(DNA濃度×10-9)/(DNA長度×660)。用無核酸酶的水進行10倍梯度稀釋至1 fg/μL,每個滴度取2.5 μL用作模板。進行10次重復試驗,評估CRISPR/Cas13a方法的檢測下限。
2 結 果
2.1檢測下限 梯度稀釋實驗結果(圖1)顯示本方法檢測下限為10 fg/μL(約1 copy/μL)。

圖1 不同濃度樣本擴增曲線
2.2敏感性和特異性 根據鑒定結果判讀標準,64株布魯氏菌CRISPR/Cas13a方法鑒定為陽性,且陽性最小FC值為2.1;56株非布魯氏菌和人DNA為陰性,陰性最大FC值是1.9,設定2.0為截斷值以完全區分陽性組和陰性組(圖2)。計算敏感性和特異性均為100%。
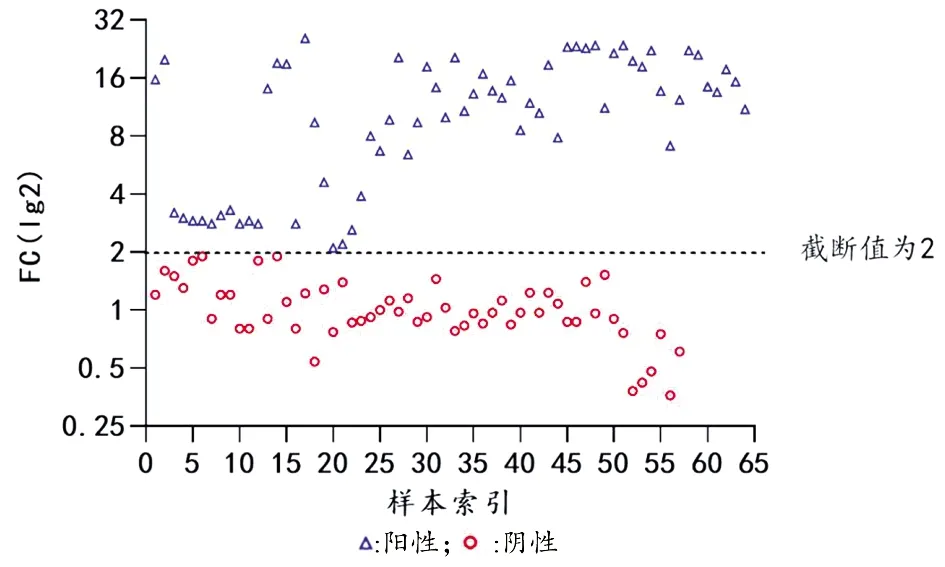
圖2 從敏感性和特異性試驗中獲得的FC
2.3臨床樣本檢測 57例臨床需氧血培養陽性菌液以培養鑒定結果為金標準,檢測結果為CRISPR/Cas13a方法的敏感性和特異性均為100%。
3 討 論
由于畜牧業的發展和檢疫制度的不健全,全球每年新增布魯氏菌病患超過50萬例[4],在我國,布魯氏菌病已成為近年來報告發病數上升速度最快的傳染病之一[5]。人類主要通過接觸被布魯氏菌污染的動物制品而感染,被感染者可出現布魯氏菌病的典型癥狀,如持續發熱、出汗、疲勞和關節痛[6]。
臨床常見鑒定布魯氏菌的方法有需氧培養、血清學檢測、核酸擴增試驗[7]和二代測序分析,以細菌培養最常用,培養鑒定布魯氏菌是診斷布魯氏菌病的金標準,但是布魯氏菌是生長緩慢的革蘭陰性、需氧和兼性胞內桿菌[8],需氧血培養瓶報陽時間通常為2.5~3.5 d,有時甚至更長,報陽后轉血平板培養和鑒定至少還需要18~48 h,且存在極大的實驗室感染風險,由氣溶膠導致的實驗室污染時有發生,嚴重威脅工作人員的身心健康。血清學檢測也比較常用,但是該方法缺乏特異性,而且對于慢性感染、再感染、復發及反復暴露于布魯氏菌的人群其檢查結果解讀較為困難,難以區分活動性感染與既往感染[5]。近年來分子診斷布魯氏菌被認為是理想的診斷工具,核酸擴增試驗敏感性和特異性較好,并且可區分急性、慢性、再感染和復發[9],但普通熒光PCR檢測方法擴增程序較復雜,所以在臨床上難以推廣。二代測序分析可以同時檢測多種病原體,但敏感性低于普通熒光PCR,測序時間較長且依賴昂貴的設備及生信分析技術,目前主要用于鑒定疑難、危重病例樣本的檢測,尚不能作為常規診斷方法[10]。臨床急需新的分子診斷方法,應用于布魯氏菌的快速診斷。
自2017年張鋒團隊首次報道應用以CRISPR/Cas13a為基礎的診斷方法檢測寨卡病毒和登革病毒以來[11],該技術展示了良好的臨床應用前景。該方法的原理是以病原體基因的靶標區域設計特異的引物,對靶標區域進行RPA恒溫擴增,擴增產物經過T7逆轉錄酶轉錄得到靶標RNA(target RNA),target RNA與Cas13a-crRNA復合物的crRNA結合后激活Cas13a酶的側切活性,切割ssRNA熒光探針[12],利用熒光檢測器檢測樣本熒光變化值。2019年張文宏團隊也報道了應用該技術檢測結核分支桿菌,并且顯示與GeneXpert分析方法具有相當的敏感性[13]。為了滿足臨床需求,我們應用這個技術建立了快速鑒定布魯氏菌的方法。
基于CRISPR/Cas13a的布魯氏菌鑒定方法,可以對需氧血培養陽性培養物中存在的布魯氏菌進行快速準確鑒定,大約2 h即可完成,為患者爭取早診斷、早治療的寶貴時間。該方法也較為簡便,不依賴昂貴的設備和復雜的技術,用于檢測樣本初始熒光值和終點熒光值的熒光PCR儀可以使用Qubit核酸定量儀替代。而且該方法鑒定布魯氏菌時樣本先經過滅菌處理,操作過程中安全性高,極大地減少實驗室氣溶膠感染的風險。此外,依據本實驗中已知樣本的鑒定結果顯示,該方法鑒定布魯氏菌的敏感性和特異性可達100%,檢測下限接近10 fg/μL,且對布魯氏菌不同生物型如羊種布魯氏菌、豬種布魯氏菌和牛種布魯氏菌均可鑒定。本實驗在對57份需氧血培養報陽后的菌液樣本和120份純菌落樣本的鑒定中未出現假陰性和假陽性結果,但是由于受非疫區條件限制,檢測樣本數量有限,該方法的敏感性和特異性需要在臨床實踐中進行進一步驗證,并且由于無法獲取布魯氏菌污染的肉類或奶制品等樣本,檢測該類型樣本時的敏感性和特異性有待進一步評估。此外,基于CRISPR/Cas13a的鑒定方法實驗室成本估計為每個樣品35元,可以在工業化規模上更便宜。由于該方法復雜性很低,因此將整個測試整合到緊湊的臺式儀器中進行自動進樣報告分析是非常可行的。
利益沖突:無

