頭頸腫瘤游離皮瓣修復術后高凝狀態的影響因素分析
魯 明,洪育明,鄭朝暉,陳曉芳,梁振源
福建醫科大學附屬第二醫院耳鼻咽喉科,福建 泉州 362000
為了徹底切除中晚期頭頸部腫瘤,臨床上常采用擴大根治性切除的手術方法,但術后遺留較大的軟組織缺損,由于頭頸部解剖結構的特殊性,傷口不能直接對拉縫合,創面修復與重建成為了困擾醫師的難題。自20世紀80年代首例游離皮瓣應用于臨床,經過30余年的發展,該技術的應用水平取得了飛速的進步,越來越多的游離皮瓣在頭頸腫瘤領域廣泛使用,成功率達85.0%~97.5%[1],但仍有少部分皮瓣出現壞死。研究[2]表明,頭頸腫瘤游離皮瓣修復術皮瓣不成活的主要原因為血管危象,即皮瓣血管蒂血栓形成,導致皮瓣供血不足或回流不暢,引起皮瓣缺血壞死。據報道,血液高凝狀態在腫瘤術后普遍存在[3],而高凝狀態是引起血管危象的主要原因。臨床上引起腫瘤術后高凝狀態的因素眾多,部分病因隱匿,不易被發現,常被忽視。以往關于腫瘤術后的高凝狀態研究主要集中在結腸癌、肺癌等,而頭頸腫瘤研究較少,有關頭頸腫瘤游離皮瓣修復術后的研究尤其缺乏。本研究旨在探討頭頸腫瘤游離皮瓣修復術后高凝狀態的影響因素。
1 資料和方法
1.1 一般資料
選取福建醫科大學附屬第二醫院耳鼻咽喉科2017年4—2020年7月收治的頭頸腫瘤且實施手術行游離皮瓣修復的243例患者作為研究對象,其中,男性161例,女性82例;年齡28~83歲,平均為(58.0±10.4)歲。納入標準:①經臨床病理學診斷確診為頭頸惡性腫瘤,且行手術游離皮瓣修復者;② 有完整可靠的臨床病歷資料;③術前未放化療;④ 圍手術期未使用抗凝或促凝藥物。排除標準:①既往有血液系統、免疫系統及慢性感染等疾病;② 術前半年內有血栓性或出血性疾病者;③合并有嚴重心、肝、腎等臟器疾病者。本研究病例手術均在全麻下進行,根據頭頸腫瘤臨床分期及病理學類型,切除腫瘤及相應的安全范圍,再根據組織缺損的大小,選擇合適的游離組織瓣進行修復,主要包括前臂皮瓣、股前外側皮瓣、腓骨瓣、耳廓復合組織瓣等。
1.2 檢測方法
所有患者于術后3 d內行血常規、生化全套、凝血功能檢查,抽取患者清晨7:00~8:00空腹靜脈血2~5 mL 3管,肝素鈉抗凝,送檢驗科分別應用法國思達高公司自動血液分析儀檢測血常規,采用日本希森美康公司全自動生化分析儀測定生化指標,采用上海太陽生物技術有限公司凝血常規分析儀檢測凝血功能。
1.3 觀察指標
1.3.1 高凝狀態
正常參考值:凝血酶原時間(prothrombin time,PT)為11.0~15.0 s,活化部分凝血活酶時間(activated partial thromboplasting time,APTT)為24.0~36.0 s,血漿纖維蛋白原(fibrinogen,Fig)測定為2.0~4.0 g/L,凝血酶時間(thrombin time,TT)為14.0~21.0 s,血漿D-二聚體測定(D-dimer,D-D)為0~0.5 μg/mL,血小板計數(platelet,PLT)為100×109~300×109/L。高凝狀態標準:PT<11.0 s,APTT<24.0 s,Fig>4.0 g/L,TT<14.0 s,D-D>0.5 μg/mL,PLT>300×109/L,出現其中至少兩項視為高凝狀態。根據評估結果,將患者分為高凝組和非高 凝組。
1.3.2 危險因素
查閱相關文獻,了解術后高凝狀態的常見影響因素。參考患者病例資料及化驗檢查單,收集頭頸腫瘤游離皮瓣修復術后高凝狀態的影響因素,包括性別、年齡、體重指數(body mass index,BMI)、酗酒史、吸煙史、高血壓史、糖尿病史、高脂血癥史、腫瘤原發部位、腫瘤分期、術中因素(修復方式、出血量、輸血量、手術時間)和術后化驗檢查[白細胞、血紅蛋白、紅細胞比容、白蛋白、總膽固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白及鈣離子(Ca2+)]。
1.4 統計學處理
2 結果
2.1 頭頸腫瘤游離皮瓣修復術后高凝狀態的發生情況
243例頭頸腫瘤游離皮瓣修復患者,術后高凝狀態的發生率為52.7%(128/243),其中術后凝血指標兩項異常為73.4%(94/128),3項異常為21.1%(27/128),4項異常為5.5%(7/128)。
2.2 頭頸腫瘤游離皮瓣修復術后高凝狀態的影響因素單因素分析
單因素分析得出:性別、年齡、酗酒、糖尿病、腫瘤分期、修復術式、術中出血量、術中輸血量、手術時間、術后白細胞水平、術后甘油三脂、術后高密度脂蛋白水平、術后Ca2+水平為術后高凝狀態的可能影響因素(均P<0.05,表1)。
2.3 頭頸腫瘤游離皮瓣修復術后高凝狀態的影響因素多因素logistic回歸分析
根據單因素分析結果,將有意義的變量納入多因素logistic回歸分析得出:糖尿病(OR=1.823,95% CI:1.246~4.719)、腫瘤分期(OR=2.155,95% CI:1.126~4.126)、術后白細胞計數(OR=1.346,95% CI:1.068~2.979)、術后甘油三脂水平(OR=3.583,95% CI:1.539~8.343)是術后高凝狀態的獨立影響因素(P<0.05,表2)。
3 討 論
高凝狀態又稱為血栓前狀態,是由手術、外傷及病理生理等因素引起的血管內皮細胞損傷、凝血活性增強、抗凝及纖溶活力降低,導致機體凝血系統功能失調,引起血液凝固性增高,具有易引起血栓形成的血液流變學狀態[4]。法國學者Armand Trousseau在1865年通過分析胃癌患者深靜脈血栓形成的原因,首次提出了惡性腫瘤患者可能存在凝血功能異常,引起了學者們的廣泛關注。據統計[5],90%的惡性腫瘤患者存在高凝狀態,4%~30%的惡性腫瘤患者發生血栓性疾病。血栓性疾病是引起術后游離皮瓣壞死的直接原因。Biben等[6]的一項meta分析顯示,游離皮瓣術后高凝患者血栓發生率為13.0%,皮瓣壞死發生率為10.3%。本研究著重觀察頭頸腫瘤游離皮瓣修復患者術后高凝狀態的影響因素,為術后高凝狀態的防治提供新的理論依據。
本研究通過分析243例頭頸腫瘤游離皮瓣修復患者臨床資料,術后出現高凝狀態128例,發生率為52.7%,高于曹波等[7]報道的腹腔鏡手術術后血液高凝狀態發生率為29.63%,但低于徐勇等[8]關于直腸癌報道的73.86%。有關各研究高凝狀態發生率存在差異的可能原因為:與納入標準、樣本量大小、疾病種類、手術方式、評估標準等多種因素有關。關于惡性腫瘤患者的高凝狀態的病理機制十分復雜,目前尚未完全闡明。雖然影響因素眾多,但術后高凝狀態的獨立危險因素仍不明確。
本研究表明,糖尿病是頭頸腫瘤游離皮瓣修復術后高凝狀態的影響因素之一,與既往研究結論大致相同[9]。血小板具有黏附、聚集和分泌的功能,在凝血過程中發揮重要的作用。Hess 等[10]研究認為,在高糖條件下,血小板表面糖蛋白易被糖化,糖化可引起蛋白結構的改變,增強表面P選擇蛋白和GP受體的表達,激活血小板,活化的血小板后可釋放凝血因子Ⅴ、血栓素A2、β-血栓球蛋白等物質,易使血小板與纖維蛋白原結合形成血小板-纖維復合物,血液的凝固性增加,形成血栓前狀態。最近一項研究報道,通過應用胰島素使2型糖尿病血糖控制于低血糖水平,發現在低血糖狀態下,血小板的活性降低,進一步證實了血糖對凝血功能的影響[11]。美國弗雷明漢心臟研究中心也發現,血糖、胰島素對血漿纖溶酶原激活物抑制劑1(plasminogen activator inhibitor 1,PAI-1)具有調節作用,高濃度的葡萄糖能增強PAI-1 mRNA的轉錄水平,促使PAI-1在內皮細胞表達,使血漿PAI-1濃度升高,引起血漿纖溶酶原激活物減少,進而引起纖溶酶含量降低,纖溶酶降解纖維蛋白的作用減弱,導致血漿纖維蛋白增多,有利于血液高凝狀態的形成[12]。
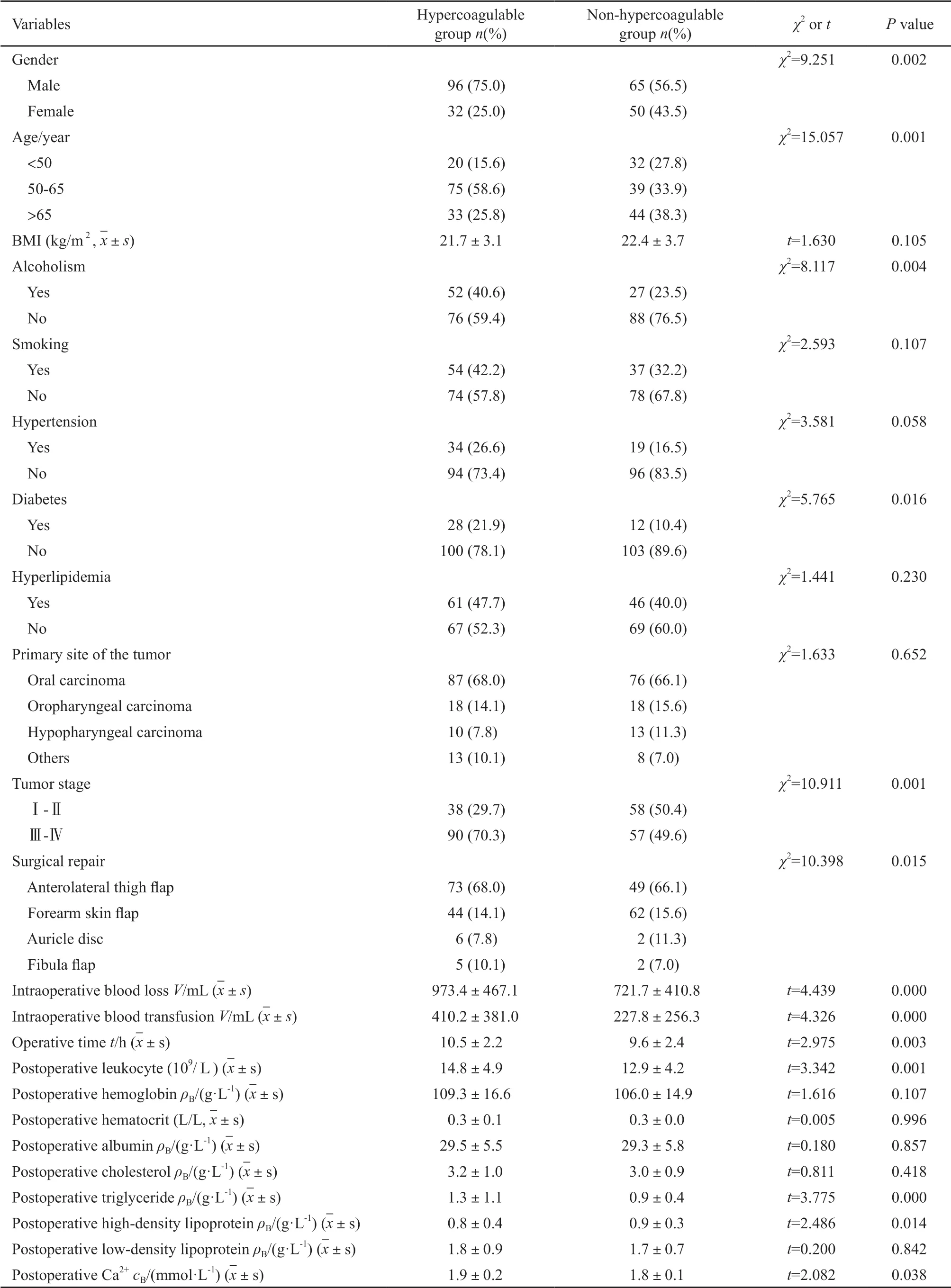
表1 頭頸腫瘤游離皮瓣修復術后高凝狀態的影響因素單因素分析Tab.1 Single factor analysis of risk factors for postoperative hypercoagulability of free flap reconstruction for head and neck tumor
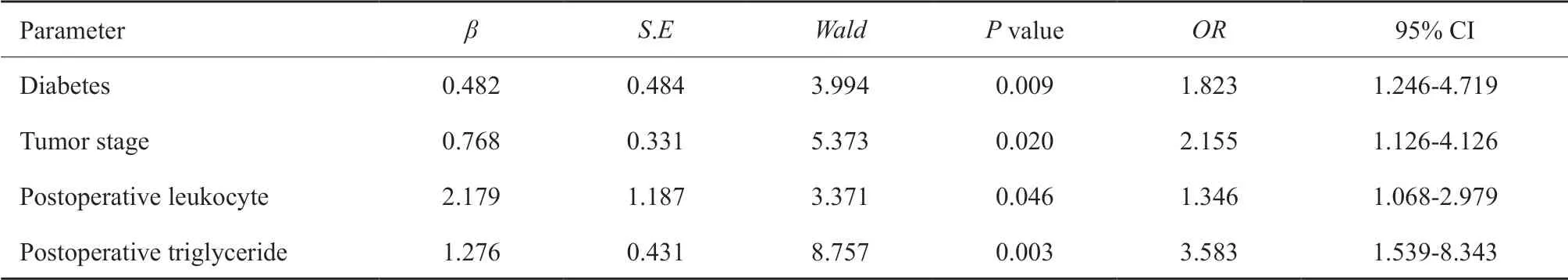
表2 頭頸腫瘤游離皮瓣修復術后高凝狀態的影響因素多因素logistic分析Tab.2 Multivariate factor logistic regression analysis of risk factors for postoperative hypercoagulability of free flap reconstruction for head and neck tumor
本研究發現,頭頸腫瘤游離皮瓣修復術后高凝狀態與腫瘤分期明顯相關,Ⅲ、Ⅳ期術后高凝狀態發生率明顯高于Ⅰ、Ⅱ期,與赫莉等[13]的研究結果一致,其通過對105例喉癌患者研究發現,喉癌患者的高凝狀態與臨床分期有關,早期喉癌患者的血小板、纖維蛋白原含量無明顯改變,隨著腫瘤的發展,血小板、纖維蛋白原呈明顯增加趨勢。Donati等[14]通過對腫瘤40年的研究發現,晚期或者轉移性癌癥患者高凝狀態發生率明顯高于早期患者,隨著腫瘤的臨床分期增加,癌細胞損傷血管內皮細胞越嚴重,產生和釋放的組織因子(tissue factor,TF)、炎性細胞因子、促凝物質越多,凝血活性越強,高凝狀態越嚴重。
本研究發現,白細胞計數升高是術后高凝狀態的獨立危險因素,炎癥反應引起高凝狀態原因是多方面的,主要包括以下幾個方面:①血管內皮損傷:癥反應可刺激白細胞產生和釋放白細胞介素-1(interleukin-1,IL-1)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)等炎性因子,損傷血管內皮細胞,引起血管局部出血壞死、血管內微血栓形成,啟動內、外源性凝血途徑。Schmidt等[15]通過實驗發現,炎癥反應可引起全身微循環障礙,微循環改變可激活白細胞,促進白細胞與血管內皮細胞的黏附作用,加重內皮細胞的損傷;② 血液高度濃縮:由于頭頸腫瘤游離皮瓣修復手術創傷大,時間長,且常需行氣管切開,術后易出現肺部及傷口感染,導致全身炎癥反應,引起體液大量丟失,加上術中體液丟失太多及術前飲水少,導致血液呈高度濃縮狀態。由于血液濃縮,血小板及纖維蛋白濃度提高,增加了血小板的黏附和聚集作用,促進高凝狀態的形成[16];③抗凝作用減弱:活化蛋白C(protein C,PC)和凝血酶調節蛋白(thrombomodulin,TM)是抗凝作用中的兩種主要物質,活化的PC、TM可滅活凝血因子FⅤa和FⅦa,進而抑制FⅩa和凝血酶的生成,還可通過抑制PAI-1進而增強纖溶活性。在炎癥狀態下,TM和PC的表達和活化受抑制,對凝血反應的抑制作用降低,使得抗凝作用減弱,造成血液高凝狀態[17]。
高甘油三酯血癥是高凝狀態重要的影響因素,這一觀點得到了較多學者的證實,本研究也發生甘油三脂高是頭頸腫瘤游離皮瓣修復術后高凝狀態的危險因素。多項研究發現,血脂,尤其是甘油三酯水平的改變是凝血及纖溶改變的主要因素之一。血漿FⅦ的活性隨著血漿中的甘油三酯、膽固醇、低密度脂蛋白的濃度升高而增加。其可能的機制為:甘油三酯濃度增高時,從三酰甘油核中釋放出來的游離脂肪酸能提高激活的接觸面,使脂蛋白表面的電荷密度增加,易與血漿FⅦ接觸,并使之激活,啟動凝血過程[18]。Chi等[19]通過對家兔的研究發現,血脂高的家兔體內凝血因子(Ⅱ、Ⅴ、Ⅶ、Ⅷ及Ⅹ)水平顯著高于血脂正常的家兔,而抗凝血酶Ⅲ(antithrombin Ⅲ,AT-Ⅲ)、PC低于對照組,說明血脂能使家兔的凝血活性增強,抗凝作用降低,增加了血液的凝固性。
綜上所述,頭頸腫瘤游離皮瓣修復術后高凝狀態處于較高水平,糖尿病、腫瘤分期、術后高甘油三脂血癥、術后白細胞高均為其危險因素。因此,對于糖尿病患者,特別是腫瘤晚期患者,術后應控制血糖在良好范圍,應動態觀察甘油三脂、白細胞,若發現甘油三脂、白細胞高,應采取積極措施,有利于減少術后高凝狀態的發生,從而預防血栓形成事件的發生,避免皮瓣壞死,提高手術的成功率,改善患者的生活質量。

