發酵溫度對黃酒釀造及風味物質形成影響研究
盛鳳云,徐俊敏,宋科峰,周嘉琪,陳 雙
(1.無錫市振太酒業有限公司,江蘇無錫 214092;2.江南大學生物工程學院,江蘇無錫 214122)
黃酒是我國民族特色酒精飲料,伴隨中華文明發展,是千百年來深受國人喜愛的飲品。黃酒釀造采用獨特的曲法釀造,邊糖化邊發酵高濃釀造工藝,賦予了黃酒芳香濃郁,口味醇厚的風格特征。在黃酒發酵過程中會釋放大量的熱量,熱量的聚集會快速提高發酵醪液的溫度,從而影響酵母的發酵活性。在黃酒發酵過程中通常采用“開耙”工藝來控制發酵醪液的溫度。目前黃酒發酵最高溫度一般在28~33 ℃之間,屬于常溫發酵。這一溫度區間處于酵母的最適生長發酵溫度區間,酵母生長和代謝十分旺盛,從而能夠快速發酵產生乙醇和其他代謝副產物。但發酵酒精飲料的生產并不同于工業乙醇的生產,在追求生產效率的同時還要兼顧產品的品質。其中風味品質是黃酒產品品質的重要組成部分。由于黃酒發酵醪液營養豐富,加之采用常溫發酵工藝,黃酒酵母在快速的生長發酵過程中會代謝產生大量高級醇類物質。高級醇被認為是引起黃酒飲后上頭的重要因素之一[1]。有研究表明酵母在較高的溫度下進行生長發酵,其代謝產生高級醇的能力要明顯高于低溫發酵。溫度是調控酵母代謝產生高級醇的重要手段之一[2]。同時有研究表明,較高的發酵溫度并不利于酵母胞內對于酯類物質的代謝生成[3]。為了提高酒精飲料的產品品質,采用低溫發酵工藝是酒精飲料釀造過程中普遍采用的一種方式。啤酒、日本清酒及白葡萄酒均是采用較低的發酵溫度,使酵母代謝產生有利的風味成分,以提高酒的風味品質。而目前黃酒釀造過程中還少有采用低溫發酵工藝的嘗試。為了降低黃酒中高級醇的含量和提高黃酒的香氣品質,本研究探索了低溫發酵工藝在黃酒釀造過程中的可行性和對黃酒風味品質的影響。
1 材料與方法
1.1 材料、試劑及儀器
1.1.1 菌種及麥曲
釀酒酵母菌株ZT-1(S.cerevisiae-ZT-1)。酵母菌株經YPD斜面培養基30 ℃培養24 h后于4 ℃下保存。使用前經新鮮YPD斜面培養基于30 ℃下活化24 h后使用。麥曲由無錫市振太酒業有限公司生產。
1.1.2 主要試劑
酵母浸膏、蛋白胨、葡萄糖、氯化鈉、乳酸、氫氧化鈉、亞甲基藍、二硝基水楊酸(DNS)等試劑均為分析純,購于中國醫藥集團化學試劑有限公司。香氣化合物定量分析所用標準樣品均購于上海Sigma-Aldrich貿易有限公司,所有化合物純度均>5%。糯米為企業黃酒釀造生產原料。頂空固相微萃取用2 cm 50/30 μm固相微萃取頭divinylbenzene/carboxen/poly (dimethylsiloxane) (DVB/CAR/PDMS)購于上海Sigma貿易有限公司。
1.1.3 儀器設備
氣相色譜質譜聯用儀(GC 6890N-MS 5975),美國Agilent公司;德國Gerstel MPS 2多功能自動進樣器,德國Gerstel公司;生化恒溫培養箱BSP-250,蘇州江東精密儀器有限公司;AB204-E分析天平,瑞士Mettler-Toledo公司;無菌超凈工作臺,蘇州凈化設備廠;高速冷凍離心機Avanti J-E,美國Beckman公司;光學顯微鏡SZ40,日本奧林巴斯公司;酶標儀,美國Thermo公司。
1.1.4 培養基與溶液
YPD培養基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸膏10 g/L,瓊脂20 g/L,經121 ℃滅菌30 min后制成YPD斜面培養基和YPD平板培養基。
糖液培養基:以大米和麩皮為原料,添加酶制劑進行蒸煮、糖化。糖液用紗布壓榨過濾后,調節糖液濃度至13 Brix,用乳酸將糖液pH值調至4.0后制得糖液培養基。糖液培養基經108 ℃滅菌20 min后使用。
1.1.5 酵母菌的培養
釀酒酵母種子液制備:挑取一環經新鮮YPD斜面活化后的酵母菌泥接種至5 mL YPD液體試管,將接種后的試管于30 ℃恒溫培養箱中靜置培養24 h后作為酵母種子液使用。
不同溫度條件下酵母生長曲線測定:配制新鮮糖液培養基,將糖液培養基采用膜過濾(0.22 μm濾膜)除菌后分裝至10×18 cm無菌試管(裝液量5 mL)。準確吸取同一試管中的種子液(100 μL)至糖液試管。將接種后的糖液試管分別置于15 ℃、20 ℃、25 ℃、30 ℃環境中靜置培養,每一培養溫度設置10個平行樣品。培養過程中每12 h取不同溫度培養試管(2支)測定菌體生長情況。酵母菌體生長情況以OD600表示。
1.2 試驗方法
1.2.1 黃酒釀造試驗
工業小試規模釀酒試驗:參照陳雙等[4]中論述的方法進行。首先將酵母菌種于5 mL YPD液體試管中活化培養24 h。將培養好的YPD種子液接種于500 mL滅過菌的糖液培養基中(1000 mL三角瓶),將接種后的三角瓶糖液培養基于30 ℃下靜置培養24 h后作為釀酒用種子液。實驗過程中采用發酵小試罐為發酵容器模擬黃酒發酵流程。試驗過程中主要設置兩個控溫工藝,一是低溫發酵控溫工藝,該工藝中通過在發酵小試罐中的冷卻夾套對發酵醪液進行降溫,控制整個發酵周期醪液中溫度為20 ℃±3 ℃,該發酵體系標記為20 ℃黃酒釀造;二是采用正常發酵工藝,前發酵過程中控制發酵溫度為30 ℃±3 ℃,完成前發酵過程后將發酵醪液溫度降低至18 ℃進行后發酵,整個發酵周期為20 d。完成發酵過程后將黃酒發酵醪液經紗布過濾,濾液以10000 r/min、4 ℃離心后取上清液(黃酒新酒)進行分析。
1.2.2 黃酒常規理化指標分析
黃酒理化指標分析參照趙光鰲編著的《黃酒生產分析檢驗》和黃酒國標GB/T 13662—2018所述方法進行。
1.2.3 黃酒樣品風味組分分析
(1)酒樣及發酵液揮發性組分的提取。酒樣和發酵液揮發性組分的提取采用頂空固相微萃取法進行,具體方法參照文獻方法進行[4]。采用50/30 μm DVB/CAR/PDMS萃取頭(Supelco,Inc.,Bellefonte,PA)對黃酒樣品中的揮發性和半揮發性風味成分進行萃取。具體操作過程如下:在20 mL頂空瓶中加入8 mL黃酒樣品,3 g NaCl和5 μL內標溶液(2-辛醇,70 mg/L)后插入SPME萃取頭。以50 ℃預熱5 min后進行萃取吸附45 min。完成萃取過程后將萃取頭于GC進樣口解吸5 min(250 ℃),用于GC-MS分析。
(2)GC-MS分析。GC條件:進樣口溫度250 ℃,載氣He,流速2 mL/min。不分流進樣。樣品采用DB-FFAP毛細管色譜柱(60 m × 0.25 mm i.d.,0.25 μm film thickness,Agilent,Torrance,CA)進行分離。升溫程序:50 ℃恒溫2 min,以6 ℃/min的速度升溫至230 ℃,保持10 min。
MS條件:EI電離源,電子能量70 eV,離子源溫度230 ℃,掃描范圍30.00~350.00 amu。
(3)定性及定量分析。化合物的鑒定首先通過質譜檢索結果與文獻RI值比對進行初步鑒定;再通過與標準物質的質譜圖及RI值比對進行最終的驗證。香氣化合物的定量分析采用內標標準曲線法進行,將不同濃度目標風味化合物配置于模擬黃酒(含5.0 g/L乳酸的15%vol乙醇水溶液,調節pH至4.0)分別進行相應分析。根據目標物與相應內標的濃度及響應比制作標準曲線,并根據標準曲線計算化合物的濃度。
2 結果與討論
2.1 黃酒酵母低溫耐受性研究
為了考察黃酒低溫釀造工藝的可行性,我們首先對黃酒酵母菌株的低溫耐受性進行了研究。比較黃酒酵母在不同溫度條件下的生長情況(圖1)可以看出,隨著培養溫度的降低酵母的生長速率明顯減慢。25 ℃和30 ℃條件下黃酒酵母保持了較快的生長速度,隨著溫度的降低15 ℃和20 ℃條件下酵母生長速率降低十分明顯。但比較培養48 h酵母菌體濃度可以看出20 ℃、25 ℃、30 ℃條件下酵母菌體濃度并沒有顯著的差異,而15 ℃條件下酵母培養48 h仍無法達到穩定期,這將對酵母后期的發酵產生一定的影響。由以上結果可以看出,黃酒酵母在20 ℃條件下雖然生長速度受到抑制,但經過48 h的培養酵母能夠進入穩定期,且酵母菌體最大濃度與30 ℃條件下培養基過并無顯著的差異。說明20 ℃條件可以作為酵母低溫發酵工藝試驗的溫度條件。
2.2 黃酒低溫發酵過程研究
通過實驗室對黃酒酵母生長溫度耐受性試驗結果可知,黃酒酵母在20 ℃低溫條件下能夠較好的進行生長繁殖。為了進一步驗證低溫黃酒發酵工藝的可行性,在工業條件下進行了黃酒模擬發酵小試驗。在發酵過程中跟蹤分析酵母數量的變化過程如圖2所示。結果表明,30 ℃發酵過程中酵母生長迅速,在20 h內即達到最大數量進入穩定期。但在較高溫度條件下隨著發酵過程的進行酵母衰老迅速,在發酵60 h時醪液中的活酵母數量開始減少,在前發酵結束時發酵醪液中酵母數量降低到接近2.21×108CFU/mL。常溫發酵過程糖化發酵速率較快,前酵結束時醪液中的乙醇含量能夠超過13 %vol[5]。乙醇是酒精飲料發酵過程中酵母細胞面臨的主要環境脅迫之一,較高的乙醇濃度會對酵母細胞產生極大的傷害,而較高的溫度會加強乙醇對酵母細胞的破壞作用[6-7]。黃酒常溫釀造過程中高濃度乙醇的快速積累可能是造成酵母細胞過早衰亡的主要原因。
而在20 ℃較低的發酵溫度條件下酵母前期生長較為緩慢,經過50 h的生長醪液中的酵母數量才達到最大值。但是在低溫發酵條件下發酵醪液中酵母的活力得到了較好的保持,在較長的時間內醪液中活酵母的數量一直維持在3.2×108CFU/mL左右,這一結果也與前期實驗室酵母低溫生長過程數量變化的趨勢相一致。
圖3顯示了不同發酵溫度工藝條件下醪液中還原糖變化過程。從發酵醪液中還原糖濃度的變化規律可以看出,30 ℃環境是酵母較為適宜的發酵溫度,酵母耗糖迅速,醪液中還原糖濃度在24 h內降低十分明顯,在發酵6 d時醪液中還原糖濃度已經低于10 g/L。而在20 ℃低溫條件下酵母發酵速率相對較低,醪液中殘糖濃度在發酵50 h的時候接近峰值(120 g/L)。但50 h后隨著酵母數量接近峰值(見圖2),醪液中還原糖濃度開始迅速下降。從圖3還可以看出雖然20 ℃條件下酵母發酵速率相對降低,但相對于30 ℃條件時發酵速率的峰值差距并不是十分顯著。在發酵6 d時醪液中的殘糖濃度已經低于10 g/L。這一結果顯示在較低溫度下酵母仍然能夠較快的利用發酵體系中的糖分。采用低溫黃酒釀造方式整體發酵周期并沒有延長。
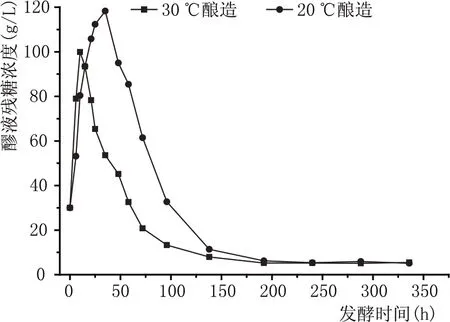
圖3 不同溫度黃酒釀造試驗醪液中殘糖濃度變化過程
進一步比較最終釀制黃酒理化指標(見表1)可以看出,兩種不同溫度控制條件下釀制的黃酒在酒精、殘糖及甘油含量指標上并沒有顯著性差異。但是20 ℃條件下釀制的黃酒pH值和總酸含量要略低于30 ℃條件下釀制的黃酒。這可能是因為低溫條件抑制了發酵體系中產酸雜菌的繁殖。在α-氨基氮含量指標上20 ℃條件下釀制的黃酒也低于30 ℃條件下釀制的黃酒。黃酒中氨基酸態氮主要由原料蛋白質的降解及酵母自溶生成[8]。30 ℃發酵條件下酵母較高的死亡率造成的細胞自溶可能是最終釀制黃酒中α-氨基氮含量高的主要原因。
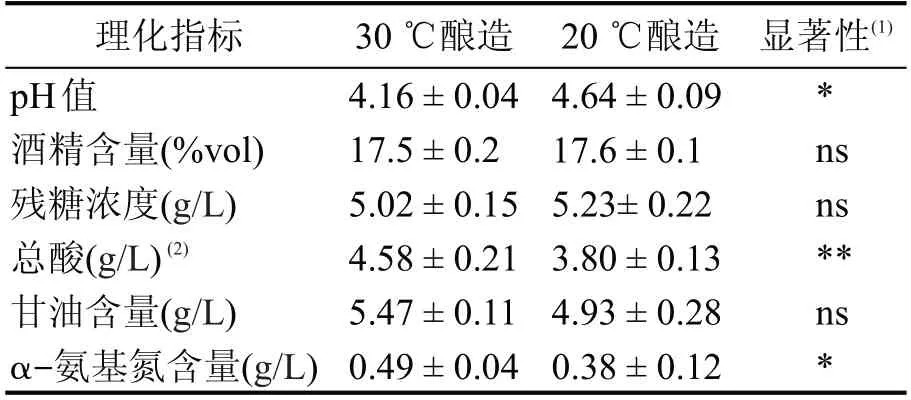
表1 不同溫度條件釀造黃酒理化指標比較
通過對不同溫度控制工藝條件下黃酒釀造過程的跟蹤及理化指標分析結果可以看出,在較低的發酵溫度條件下雖然初始發酵速率降低,但總的發酵時間和最終釀造黃酒理化指標與常溫發酵工藝并無顯著的差異,說明在實際工業生產中采用低溫黃酒釀造工藝是完全可行的。
2.3 低溫發酵工藝對黃酒揮發性香氣特征影響研究
低溫釀造是啤酒、日本清酒及白葡萄酒釀造過程中提高風味品質的重要工藝措施[9-10],但低溫黃酒釀造對黃酒風味品質的影響目前還沒有相關的研究。本研究在工業小試規模順利完成低溫黃酒釀造工藝的基礎上對釀制黃酒風味特征進行了深入的研究。從風味分析結果(表2,圖4)可以看出,低溫發酵對黃酒中高級醇的含量產生了明顯的影響。比較20 ℃和30 ℃條件釀制黃酒高級醇含量可以看出,20 ℃條件釀制的黃酒總高級醇含量要顯著低于30 ℃條件釀制的黃酒。采用低溫發酵工藝釀造的黃酒總高級醇含量降低了22%。高級醇被認為是引起黃酒飲后上頭的主要原因之一[1],本研究證明通過低溫釀造工藝的應用能夠有效的降低黃酒中高級醇的含量,從而提高黃酒的飲用舒適度。圖4結果顯示,低溫釀造工藝對黃酒中重要風味物質β-苯乙醇的含量并沒有造成影響。20 ℃和30 ℃條件釀制的黃酒中β-苯乙醇的含量并沒有顯著的差異。
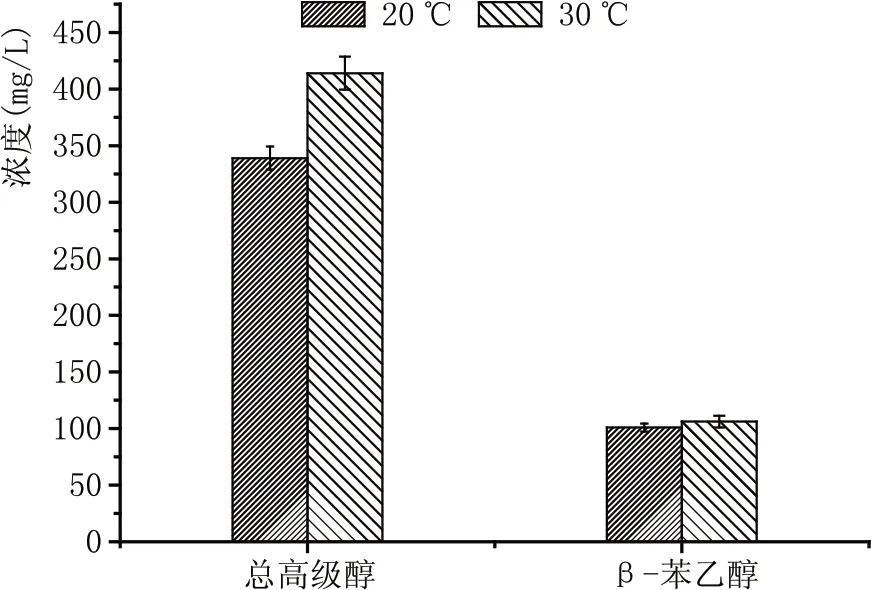
圖4 不同發酵溫度釀制黃酒高級醇含量比較(總高級醇不包含β-苯乙醇)
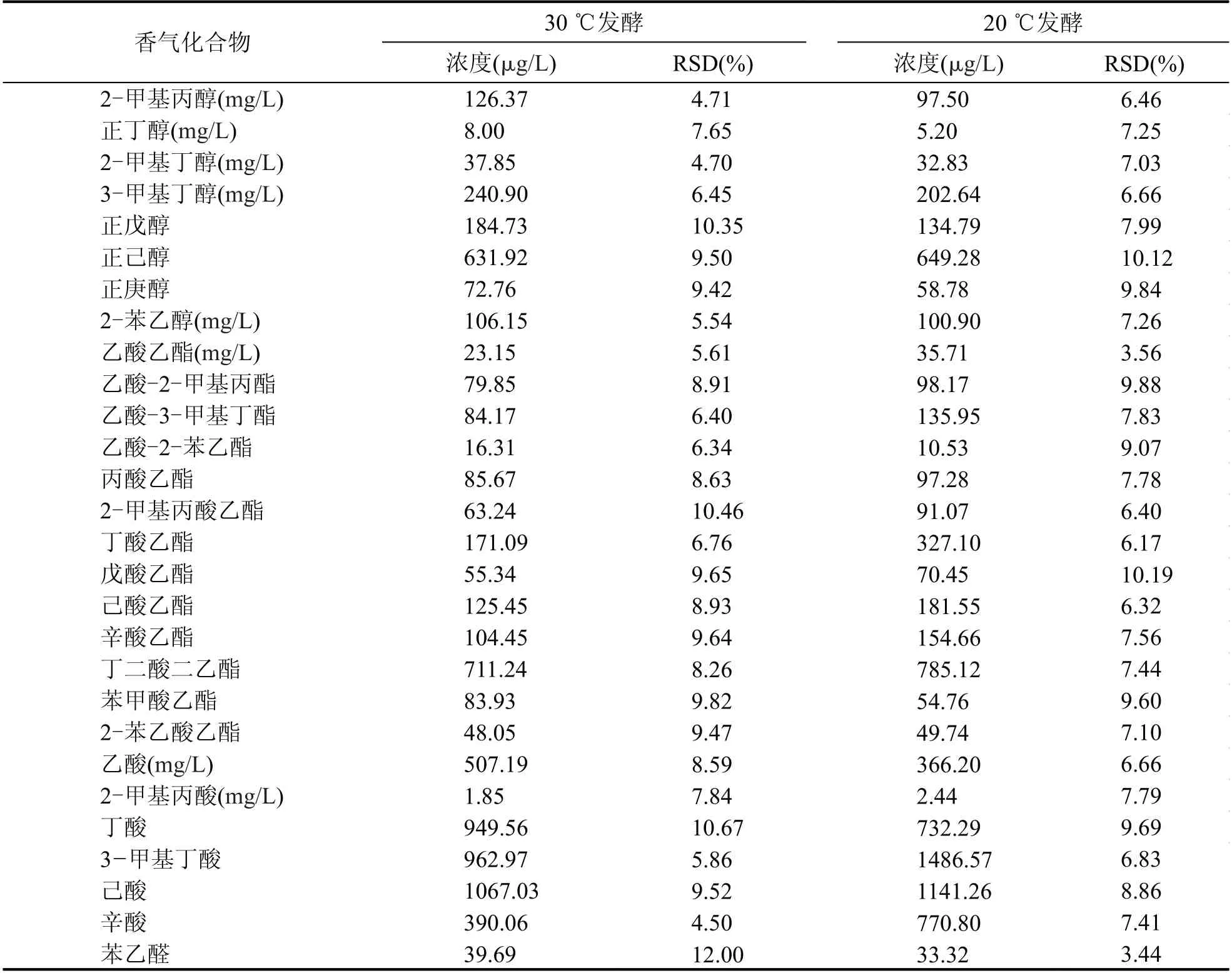
表2 不同發酵溫度工藝條件下釀制黃酒香氣成分比較
酯類物質作為酒精飲料重要的有益風味物質一直是釀酒科學研究的重點。圖5結果顯示,低溫釀造工藝生產的黃酒中乙酸乙酯含量和總酯含量均要高于常溫釀造工藝的黃酒。酯類化合物由于其較低的香氣閾值和愉悅的水果香、花香的香氣特征是黃酒風味成分中最主要也是最重要的一類化合物[4]。較高的酯類物質含量能夠提高黃酒酯香的香氣特征。這一結果也得到感官分析的驗證,通過感官分析比較兩種工藝釀制的黃酒發現,采用低溫發酵工藝釀制的黃酒果香、花香的香氣特征要明顯優于常溫發酵工藝釀制的黃酒。
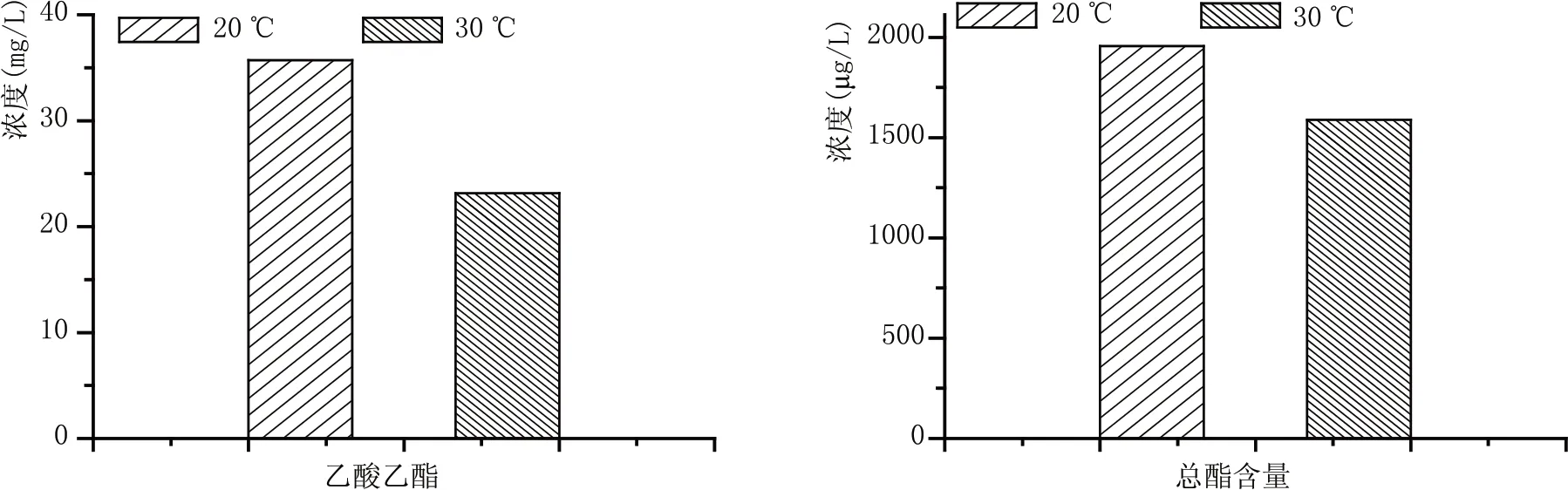
圖5 不同發酵溫度釀制黃酒酯類物質含量比較(總酯含量不包含乙酸乙酯)
3 結論
通過比較黃酒酵母在不同溫度條件下的生長情況確認了黃酒低溫釀造的可行性及適宜的低溫工藝條件。試驗中開發出的黃酒低溫釀造工藝相對于常溫釀造過程發酵時間并沒有增加。低溫發酵釀制的黃酒主要理化指標也保持了黃酒的特征。通過低溫釀造工藝的運用,所釀制的黃酒香氣特征較常溫釀制黃酒有了顯著的提升。低溫釀制的黃酒中總高級醇含量要顯著低于常溫釀制的黃酒,能夠有效減少黃酒飲后上頭的影響。同時低溫釀制黃酒整體香氣品質特別是水果香花香的香氣特征要顯著優于常溫釀制黃酒。通過本研究結果說明,黃酒釀造過程低溫釀造工藝完全可行,且通過低溫黃酒釀造能夠有效提高黃酒產品的風味品質。

