吡咯喹啉醌產生菌的篩選和菌種鑒定
朱道洋,魏春雨,余曉斌
(江南大學 生物工程學院,工業生物技術教育部重點實驗室,江蘇 無錫,214122)
吡咯喹啉醌(pyrroloquinoline quinone,PQQ),作為許多細菌脫氫酶(甲醇脫氫酶,乙醇脫氫酶和葡萄糖脫氫酶等)的輔助因子于1964年首次被發現[1],它是繼吡啶核苷酸和核黃素之后的第3種氧化還原酶的輔酶[2]。PQQ在生物界的分布極為廣泛,在動植物和微生物細胞中均發現其存在[3],但僅有部分革蘭氏陰性細菌能合成PQQ[4-6]。在具有合成PQQ能力的細菌中,絕大部分只能合成痕量的PQQ以供給細胞生長,只有少部分可以生產過量的PQQ,并將其排泄到培養基中[7-8],其中以甲基營養菌的合成能力最強,如甲基菌屬(Methylobacill),甲基單胞菌屬(Methylomonas),嗜甲基菌屬(Methylophilus)和甲基桿菌屬(Methylobacterium)等[9-12]。此外,在納豆、青椒和獼猴桃等植物體內也含有微量的PQQ,并且牛奶和人類的母乳中也存在較高濃度的PQQ[13-16]。近幾十年來的研究發現PQQ具有多種生理功能,它是許多細菌脫氫酶的輔助因子,參與細胞的電子呼吸鏈傳遞[17];PQQ可以提高微生物細胞的抗逆性,并提高宿主菌的抗氧化能力[18];PQQ還是動植物刺激或生長因子[19];此外,PQQ與葡萄糖脫氫酶(glucose dehydrogenase,GDH)結合形成PQQ-GDH全酶,可用作檢測葡萄糖的生物傳感器,也可用作生物燃料電池[20-21]。
由于目前PQQ化學合成步驟復雜,副產物多,而微生物發酵生產PQQ成本低,步驟少,產物分離更容易,因此微生物發酵法成為最有前景的工業化生產路線[22-23]。雖然對PQQ的研究已有幾十年,但其生物合成的具體過程尚未完全闡明,從環境中篩選高產野生菌依然是必不可少的。1992年,司振軍[9]篩選到1株PQQ產生菌,經鑒定為生絲微菌Hyphomicrobiumsp.TK0441,優化培養基后在30 L發酵罐上發酵14 d后PQQ產量可達到1 g/L。SI等[22]從土壤中篩選到1株甲基營養菌,經鑒定為Methylobacillussp.zju323,未經優化的PQQ搖瓶產量為23.2 mg/L,在已報道的研究中屬于高水平。本研究建立了一種高效液相色譜法用來快速檢測PQQ,從土壤樣品中篩選得到1株PQQ高產菌,并對其進行了菌種鑒定和培養基優化,為后續進行PQQ的生產研究提供依據。
1 材料與方法
1.1 材料與試劑
細菌樣品來自于無錫生產甲醇工廠附近的土壤和污水;PQQ標準品,Sigma公司;其他試劑,國藥集團。
1.2 儀器與設備
G180T滅菌鍋,美國致微儀器有限公司;高速冷凍離心機,美國賽默飛世爾科技公司;酶標儀,美國BioTek公司;Agilent-1260高效液相色譜儀,美國安捷倫科技公司。
1.3 培養基
篩選培養基:甲醇30 mg/L,(NH4)2SO43 g/L,Na2HPO4·12H2O 3 g/L,MgSO4·7H2O 1.5 g/L,KH2PO41.4 g/L,微量元素液 1 mL/L。固體培養基添加2%(質量分數)的瓊脂粉。
種子培養基:甲醇10 mg/L,(NH4)2SO43 g/L,Na2HPO4·12H2O 3 g/L,MgSO4·7H2O 1.5 g/L,KH2PO41.4 g/L,微量元素液 1 mL/L;微量元素液配方(mg/L):CaCl2·2H2O 30,MnCl4·4H2O 5。
發酵培養基:在種子培養基的基礎上加入1 mL維生素液;維生素液配方(mg/L):核黃素200,對氨基苯甲酸200,鹽酸硫胺素400,煙酸400,鹽酸吡哆醇400,泛酸鈣400,葉酸2,生物素2,肌醇2 000。
1.4 實驗方法
1.4.1 PQQ產生菌初篩方法的確立
光譜法:對PQQ標準品進行全波長掃描,發現其在249和330 nm處有2個吸收峰,將200 μL PQQ標準品溶液或發酵離心上清液轉移至96孔板中,用酶標儀檢測 OD330與 OD249,并將空白培養基以同樣的條件處理和檢測,從而減去培養基吸光值的干擾。
1.4.2 HPLC法檢測PQQ
由于PQQ的結構上連有3個—COOH,因此易溶于水,極性較大,在普通的C18反相色譜柱上不保留。目前采用較多的是離子色譜對法來檢測PQQ,但是離子色譜對平衡時間長,操作復雜且對柱子也有局限性;還有采用加酸調節pH來使PQQ保留在色譜柱上,但這使得峰形拖尾嚴重并且重現性不好。為此本實驗選擇親水色譜柱來解決PQQ難以在色譜柱上保留的問題。以水為流動相,通過COSMOSIL Packed Column 5 C18-PAQ反相色譜柱,測定PQQ在249和330 nm的吸光值,根據出峰面積確定其濃度。利用安捷倫1260系列高效液相色譜儀測定PQQ含量,進樣量20 μL,溫度30 ℃,流動相為V(0.05 mol/L乙酸)∶V(0.05 mol/L乙酸銨)=30∶70,流速1 mL/min,在249和330 nm下檢測PQQ標準品和樣品含量。
1.4.3 菌株的篩選
將樣品制成適當濃度梯度的稀釋液,涂布于甲醇篩選培養基平板上,30 ℃培養3~5 d,分別挑取不同形態的單菌落接種到種子培養基中,30 ℃,200 r/min 培養3~5 d,將發酵液離心取上清液,用光譜法快速檢測PQQ含量,再用HPLC法對PQQ產量較高的菌株進行復篩。
1.4.4 菌種的鑒定
將PQQ產量最高的菌株在固體培養基上劃線,30 ℃培養3~5 d,利用普通光學顯微鏡觀察菌體形態特征。取單菌落接種到搖瓶培養基中,30 ℃培養,當菌體OD600為0.5~1時,取3 mL發酵液,10 000 r/min 離心1 min,棄去上清液,收集菌體,按照細菌基因組DNA提取試劑盒提取DNA,利用細菌通用引物 27F:5′-AGAGTTTGATCMTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′,通過PCR反應擴增該菌株的16S rDNA序列,將產物委托上海生工測序,將測序結果在NCBI網站中進行BLAST比對,用軟件MEGA進行系統進化樹的構建。
1.4.5 甲醇含量對菌體生長和PQQ產量的影響
對培養基中的唯一碳源甲醇進行優化,研究甲醇的不同添加量(0.5%、1%、1.5%、2%、2.5%,3%、3.5%和4%,體積分數)對菌體生長和PQQ產量的影響。
2 結果與分析
2.1 光譜法檢測PQQ
研究建立了基于光譜法檢測PQQ的快速篩選方法,通過全波長掃描發現PQQ在249和330 nm左右有2個吸收峰。考慮到發酵液中含有蛋白,核酸等在249 nm左右有吸收值的物質,而在330 nm處有吸收值的物質較少,因此,本實驗選擇研究PQQ濃度和OD330的關系。通過酶標儀檢測不同濃度 PQQ標準品的OD330(檢測樣品時要減去空白發酵培養基的吸光值以除去干擾),發現在330 nm下PQQ濃度與OD330關系為y=0.021 8x-0.035 4(R2=0.995 7)。當PQQ質量濃度在2.5~50 mg/L時,兩者呈現良好的線性關系,由于野生菌產PQQ量多在1~20 mg/L左右,因此使用本方法進行高通量篩選的初篩具有良好的可行性。
2.2 HPLC法檢測PQQ
本實驗首先研究了其他色譜柱檢測PQQ,結果發現普通C18柱無法使PQQ有效保留,更換流動相甲醇和乙腈,或者是梯度洗脫都不能保留PQQ。另外發現改變pH可以使PQQ有所保留,但峰形較差,且拖尾嚴重,并且不能很好地分離樣品發酵液中的PQQ。考慮到PQQ極性較大,因此采用耐100%水的COSMOSIL Packed Column 5C18-PAQ反相色譜柱來使PQQ有很好的保留。將準備好的7個不同質量濃度的PQQ標準品(100、50、25、12.5、6.125、5和2.5 mg/L)進行HPLC檢測,每個質量濃度連續進樣3次,每次進樣20 μL。結果如圖1所示,不同濃度的PQQ均在3.56 min左右出峰。隨著PQQ濃度的增加,峰面積也逐漸增加。因此PQQ濃度與峰面積呈正相關的關系。以PQQ濃度為橫坐標,色譜峰面積為縱坐標,繪制標準曲線,線性關系為y=30.27x+7.32,R2=0.999 8,說明線性關系良好。采用COSMOSIL Packed Column 5C18-PAQ反相色譜柱檢測PQQ,運行時間短,PQQ出峰時間早,檢測效率高。本實驗建立的HPLC法檢測PQQ具有良好的可行性,可作為菌種產PQQ的復篩方法。

圖1 不同濃度PQQ標準品的HPLC測定Fig.1 The HPLC determination of PQQ standards with different concentrations
2.3 菌株的篩選和鑒定
經光譜法初篩,從100多個樣品中篩選到50多株PQQ產生菌,大多數的產量在2~5 mg/L,少數可以達到10 mg/L左右,HPLC復篩后其中PQQ產量最高的1株為20.6 mg/L,峰圖如圖2所示,PQQ在3.57 min出峰,這是未經優化已報道的搖瓶較高產量。
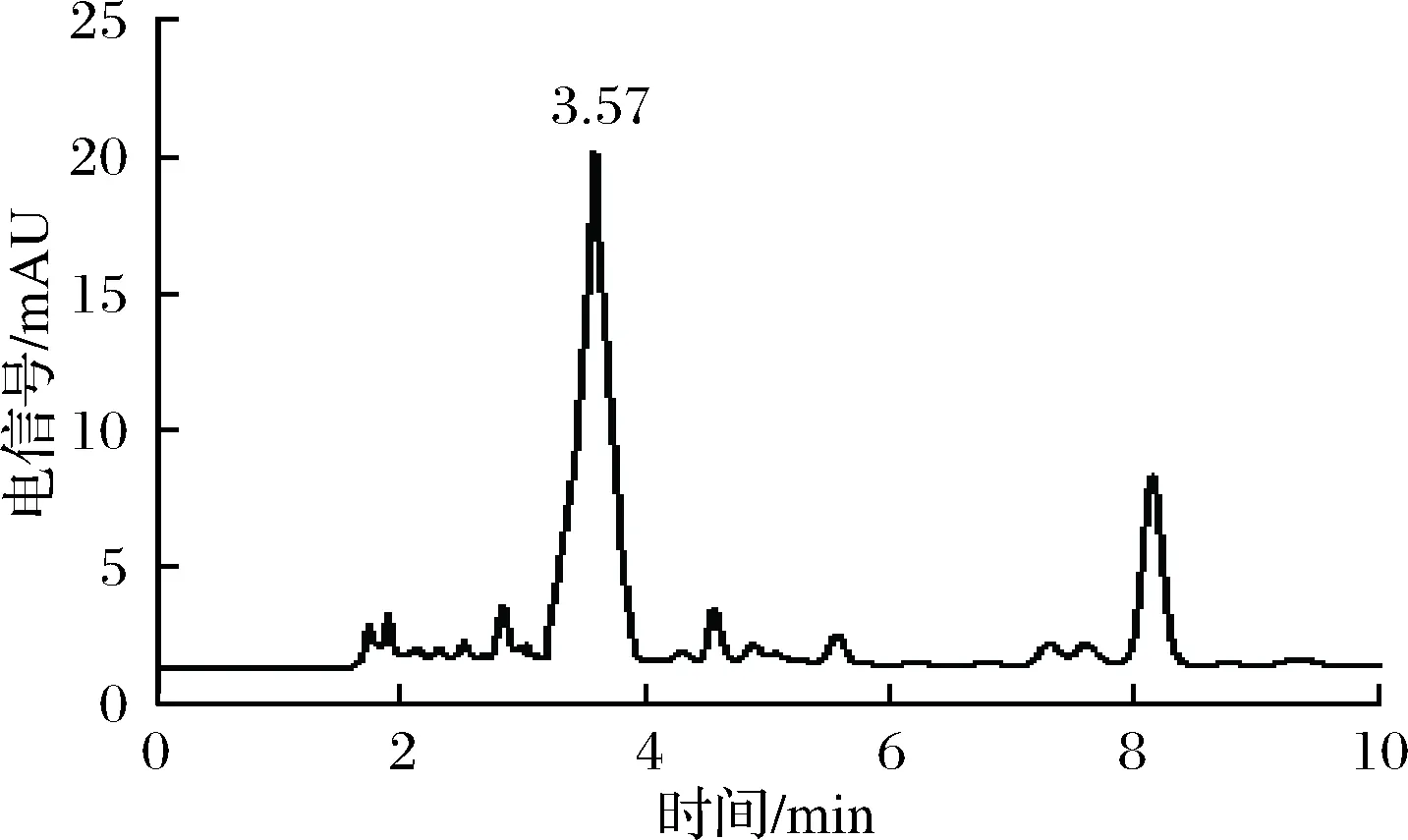
圖2 Methylopila sp.Z1發酵液的HPLC圖Fig.2 The HPLC chart of the fermentation broth of Methylopila sp.Z1
該菌株的菌落在甲醇培養基平板上為乳白色,黏稠,邊緣整齊,直徑較小,為1~2 mm。菌體細胞為球狀,革蘭氏陰性,不產芽孢,有莢膜,無鞭毛。該菌株在以甲醇和甲胺為碳源的培養基中能夠良好生長,能利用D-葡萄糖,蔗糖,果糖和木糖。在以銨鹽、硝酸鹽、牛肉膏、蛋白胨和酵母膏為氮源的培養基中能良好生長。采用PCR技術擴增該菌株的16S rDNA 基因序列,經上海生工測序。通過在 NCBI網站中進行同源性序列搜索及比對,從中選取同源性較高菌株的16S rDNA基因序列,以集團外菌種作對照,通過MEGA軟件,用鄰接法(Neighbor-Joining)構建系統發育樹。結果如圖3所示,該菌株與Methylopilahenanensisstrain LYBFD3-16A2的同源性最高,為99%。綜合菌落及菌體形態特征、16S rDNA序列分析, 鑒定該菌株為Methylopilasp.菌株,命名為Methylopilasp.Z1。
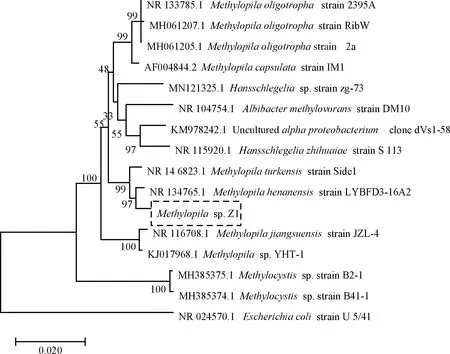
圖3 Methylopila sp. Z1的系統發育樹Fig.3 The phylogenetic tree of Methylopila sp.Z1
2.4 甲醇含量的優化
研究甲醇的不同添加量(0.5%、1%、1.5%、2%、2.5%、3%、3.5%和4%,體積分數)對OD600和PQQ產量的影響,結果如圖4所示。在0.5%~2.5%,隨著甲醇體積分數的提高,菌體OD600和PQQ產量也逐漸提高,當甲醇體積分數為2.5%時,OD600和PQQ產量均達到最高,繼續增加甲醇,OD600和PQQ產量均有明顯下降。這是因為甲醇作為細菌生長的唯一碳源,并且還是細菌細胞甲醇脫氫酶的底物,在其濃度較低時,不足以提供能量使細胞生長,也無法生產過量的PQQ排泄到培養基中,導致PQQ合成效率非常低。當甲醇體積分數逐漸提高時,細胞所能利用的碳源增加,菌體OD600和PQQ產量也逐漸增加;當甲醇體積分數超過2.5%時,由于甲醇的毒性使細胞損傷,并且底物濃度過高抑制甲醇脫氫酶的活性,導致菌體OD600和PQQ產量下降。因此甲醇體積分數為2.5%對于菌體生長和PQQ合成是最佳選擇。

圖4 不同甲醇濃度對PQQ合成和生物量的影響Fig.4 Effect of different methanol concentration on PQQ synthesis and biomass
3 結論
目前PQQ的檢測方法主要有重組酶法,氧化還原法,光譜法和HPLC[24],其中重組酶法所用到的葡萄糖脫氫酶提取繁瑣,純化過程復雜,且得到的酶活不高,不足以支持大量的菌種篩選;氧化還原法中用到的顯色劑氯化硝基四氮唑藍易受培養基中其他成分的干擾,造成陰性結果。光譜法操作簡單,檢測快速,但也可能受到培養基中具有相似波長吸光度的影響,但本實驗采用的是甲醇無機培養基,并通過HPLC檢測樣品發現基本沒有干擾,因此光譜法作為PQQ產生菌的初篩是高效可行的。本實驗還建立了新的HPLC法檢測PQQ,采用親水色譜柱COSMOSIL Packed Column 5C18-PAQ,使得PQQ有很好的保留,并且樣品運行時間短,PQQ在3.56 min出峰,出峰時間早,檢測時間短,峰形無拖尾,為PQQ檢測提供一種新的改進方法。
由于PQQ的生物合成機理沒有得到完全闡釋,通過基因工程和代謝改造提高PQQ的產量遠低于野生菌的產量,因此從環境中篩選具有高產PQQ能力的菌種是十分必要的。本實驗從樣品中篩選到1株PQQ高產菌,經鑒定為Methylopilasp.,命名為Methylopilasp.Z1,未經優化的搖瓶產量達到20.6 mg/L,屬于已報道的較高水平。Z1菌株耐受較高甲醇,在培養基甲醇體積分數為2.5%時,PQQ產量達26.7 mg/L,相比于初始濃度提高了28%。Z1是一株有高產PQQ潛力的菌株,后續發酵罐培養和優化工藝將進一步提高PQQ產量。

