等離子體作用結合氧限制模型選育輔酶Q10高產菌株
張幸子, 王曉惠, 王澤建, 陳必欽, 李 丹, 郭美錦, 儲 炬, 莊英萍
(1. 華東理工大學生物反應器工程國家重點實驗室,國家生化工程技術研究中心(上海),上海 200237;2. 內蒙古金達威藥業有限公司,呼和浩特 010000)
輔酶Q10(Coenzyme Q10)是一種廣泛存在于生物體細胞膜上的脂溶性化合物,又稱為泛醌(Ubiquinone),它作為線粒體呼吸鏈上的電子載體,負責將電子從復合物I(或復合物II)傳遞至復合物III[1-3]。研究表明,輔酶Q10具有抗氧化、清除體內自由基以及促進ATP (三磷酸腺苷)合成等生理功能[4-6],它可以降低體內氧化應激風險[7],臨床上常與他汀類藥物聯用治療心血管疾病[8-9],近二十年來其市場需求逐步增加,通過微生物法生產輔酶Q10市場潛力巨大[10]。
微生物雖然可以產生輔酶Q10,但對于自然界中的野生型菌株來說,其輔酶Q10的天然產量都較低,需要通過選育高產菌株、優化發酵工藝和提高分離純化效率等手段,最大限度地提高輔酶Q10的產量,才能滿足工業生產的需求[11-12]。類球紅細菌(Rhodobacter sphaeroides)是近年來常用的輔酶Q10生產菌株,不少研究者從誘變育種、基因改造、代謝工程等角度出發來提高菌株產量[13-14]。扶教龍等[15]利用菌株對維生素K3、疊氮化鈉和對羥基苯甲酸的復合抗性作為篩選標記,對類球紅細菌使用亞硝基胍進行化學誘變,成功篩選出一株遺傳穩定的高產菌株。Zhu等[16]通過表達類球紅細菌中光合作用基因的轉錄調控因子ppsR和催化GGPP合成的crtE,增強了輔酶Q10生物合成中異戊二烯側鏈前體(GGPP)的供應,使得改造菌RspPE的產量提高到73.2 mg/L,比野生菌提高了47%。
常溫常壓等離子體(Atmospheric and Room Tem–perature Plasma,ARTP)是由工作氣體在外加射頻電場的作用下,產生的溫度在25~40 ℃之間的等離子體射流,其中包含了大量的活性粒子(如電子、離子、激發態原子、分子等),可以在常壓下處理微生物,使DNA等遺傳物質的分子結構發生改變[17],ARTP常溫常壓的工作條件有效降低了非致畸致變性處理的損傷與致死效應[18]。ARTP對活細胞DNA的損傷強度遠高于其他誘變源,在一定范圍內,DNA損傷強度與誘變率正相關,因此ARTP誘變比傳統誘變手段更為高效,已成功用于100多種微生物的誘變育種[19-20]。對于誘變獲得的大量突變株,需要選擇合適、高效的篩選壓力進行快速選育,大多誘變育種是采用前體、抗生素或結構類似物作為選擇壓力篩選[21-23]。在類球紅細菌發酵過程中,供氧一直是影響菌體生長和產物合成的關鍵因素。高的氧消耗速率才能保證菌體的快速生長和產物合成速率的提升,但生產過程中動力能源的消耗過大會增加企業的生產成本;同時,菌體在一定的氧限制條件下才會快速進入次級代謝并開始啟動大量合成輔酶Q10。Kien等[24]通過在發酵前期降低通氣,限制供氧水平,有效提高了輔酶Q10產量。在相對低供氧情況下,如何篩選到菌體的比生長速率、氧親和力和產物合成速率均較高的生產菌株是提升生產效率的關鍵。
本文通過 ARTP 作用的方式獲得輔酶Q10的高產突變株,在建立的高通量培養平臺上進行培養,根據菌體產物的合成特性,采用降低生長環境中氧供應的方法,構建氧限制模型,即通過在平板培養基中添加無水亞硫酸鈉,脅迫菌體在氧限制的平板上生長的策略,快速篩選出了輔酶Q10高產的突變株,并在5 L反應器進行了驗證。
1 實驗材料與方法
1.1 原料和試劑
1.1.1 菌株及主要試劑 類球紅細菌(Rhodobacter sphaeroides)J-1作為出發菌株,由內蒙古金達威藥業有限公司提供;輔酶Q10由浙江新和成有限公司提供。
1.1.2 實驗儀器 常壓室溫等離子體誘變儀(北京思清源生物技術公司,ARTP-II S型);5 L反應器(上海國強生化工程裝備有限公司);高效液相色譜儀(美國Agilent Technologies Inc, Agilent 1100 series);尾氣質譜儀(美國Extrel公司,MAX300-LG型);葡萄糖測定儀(山東省科學院生物研究所,SBA-50B型);可見分光光度計(上海棱光技術有限公司,721型)。
1.1.3 培養基
(1)平板培養基(g/L):酵母提取物15,磷酸氫二鉀1,氯化鈉2,硫酸亞鐵0.1,硫酸鎂0.15,瓊脂粉20,輔液2 mL;pH 7.0~7.2。
(2)種子培養基(g/L):硫酸銨3,酵母提取物8,谷氨酸鈉0.8,玉米漿干粉0.748,葡萄糖10,磷酸氫二鉀1.5,硫酸亞鐵0.25,硫酸鎂1.8,氯化鈉2,碳酸鈣8,輔液2 mL;pH 7.1~7.2。
(3)發酵培養基(g/L):硫酸銨3,谷氨酸鈉3.5,玉米漿干粉4.2,磷酸二氫鉀1.6,硫酸亞鐵0.8,硫酸鎂10,氯化鈉3,氯化鈣0.07,葡萄糖32.5,碳酸鈣10(搖瓶培養),輔液2.5 mL;pH 6.5~6.6。
(4)輔液(g/L):鹽酸硫胺1 ,生物素0.015 ,煙酸1[15]。
1.2 培養方法
1.2.1 平板培養 無菌條件下,從培養6~7 d的新鮮平板上挑取外觀飽滿、大小適中的菌落8~10個,放入裝有10 mL無菌生理鹽水的試管中,充分打散制成菌懸液,按照10倍梯度依次稀釋至母液的10?6倍,吸取0.1 mL菌液于平板均勻涂布后,放于32 ℃培養箱培養6~7 d,培養過程中需避光。
1.2.2 種子培養 用無菌竹簽從新鮮培養的平板上挑取2~3個單菌落,接種于裝有50 mL種子培養基的500 mL三角搖瓶中,在32 ℃、220 r/min轉速下振蕩培養28 h。當種子液吸光度OD700達到6時,轉接至發酵培養基中。
1.2.3 發酵培養 按16%的接種量將種子液轉接到500 mL三角搖瓶或5 L反應器中。搖瓶培養基裝液量45 mL,添加碳酸鈣穩定pH 值,在32 ℃、220 r/min轉速下振蕩避光培養48 h。5 L反應器培養基裝液量2 L,在32 ℃避光培養106 h,初始轉速400 r/min,發酵過程中用氨水控制pH 值為6.5~6.6,根據發酵液中殘糖的消耗速率流加葡萄糖,控制殘糖質量濃度不低于8 g/L。
1.2.4 孔板培養方法 無菌條件下,用10 μL移液槍從培養6~7 d的新鮮平板上挑取一個外觀飽滿、大小適中的菌落,直接打入24孔板中,加入培養基后蓋上蓋子,在32 ℃、220 r/min轉速下振蕩培養20 h。按16%的接種量用8孔道移液器將種子液接入裝有發酵培養基的24孔板中進行發酵,在32 ℃、220 r/min轉速下振蕩避光培養48 h。
1.3 ARTP誘變步驟
按1.2節中方法制備菌懸液,在無菌條件下吸取10 μL菌液涂于金屬載片上,使菌液均勻覆蓋在載片表面。用鑷子夾住載片放置在載物臺上相應的孔位,把裝有990 μL無菌水的2 mL離心管卡入對應的孔位下方。關閉艙門,設置好工作條件,進行誘變。待照射結束后,金屬載片會自動落入下方的離心管中。將離心管置于旋渦振蕩器上劇烈振蕩1 min,使載片上的菌液洗脫完全,即得誘變后的菌懸液。
1.4 參數檢測
1.4.1 輔酶Q10含量檢測 由于利用類球紅細菌生產輔酶Q10基本上都是在胞內的,所以檢測首先要將胞內的輔酶Q10提取(酸化、有機溶劑提取)后進行檢測。
標準曲線的繪制:準確稱取0.1 g輔酶Q10標準品置于100 mL容量瓶中,用無水乙醇定容至刻度,配制成1 g/L的標品溶液,然后用無水乙醇將其稀釋至10、20、30、40、50 mg/L,再用0.22 μm有機相過濾頭過濾,供高效液相色譜儀分析。流動相為乙醇與甲醇(體積比1∶1)的混合液,色譜條件:檢測波長275 nm,流速1.1 mL/min,進樣量20 μL,柱溫35 ℃。色譜柱:Hypersil ODS C18(150 mm×4.6 mm, 5 μm)。以峰面積為縱坐標,標品質量濃度為橫坐標,繪制標準曲線。
搖瓶反應器中發酵液效價的檢測:發酵結束后,取5 mL發酵液置于50 mL容量瓶中,加6 mol/L鹽酸溶液1滴,輕微振搖,再加無水丙酮10 mL、9.8 mol/L雙氧水1 mL,用無水乙醇定容至刻度,超聲提取45 min。用0.22 μm濾頭過濾,吸取1 mL置于液相小瓶中供液相檢測,根據標準曲線計算發酵液效價。
孔板中發酵液效價的檢測:發酵結束后,用8孔道移液器吸取0.5 mL發酵液,轉移至另一個與孔板相對應的位置中,加6 mol/L鹽酸溶液50 μL,輕微振蕩搖孔板,加入無水丙酮1 mL、9.8 mol/L雙氧水100 μL,再加入3.35 mL無水乙醇,蓋上蓋子,超聲提取45 min。用0.22 μm濾頭過濾,吸取1 mL置于液相小瓶中供液相檢測,根據標準曲線計算發酵液效價。
1.4.2 菌濃檢測和菌體干重測定 通過比濁法測定發酵液中的菌體濃度:取發酵液 5 mL,稀釋至合適梯度振蕩均勻后,用分光光度計在700 nm波長處測OD700即得菌濃。
發酵70 h后,以干重表征菌濃:將定量濾紙置于105 ℃烘箱中烘2 h,取出準確稱量濾紙質量。取5 mL發酵液于濾紙上抽濾,將沉淀用去離子水清洗3次后,置于烘箱中烘至恒重得沉淀質量,除以取樣體積即得菌體干重(g/L)。
1.4.3 發酵液殘糖檢測 將發酵液在12 000 r/min轉速下離心10 min,取上清用去離子水稀釋至合適梯度后,用葡萄糖測定儀檢測。
1.4.4 在線攝氧率OUR檢測 發酵過程中采用質譜儀對尾氣進行檢測,使用Biostar軟件對數據進行采集,在線計算得到攝氧率OUR如下[25]:
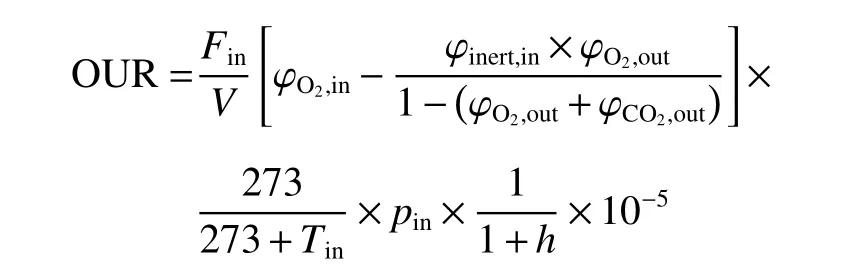
其中,Fin為進氣流量(mmol/L),V為發酵液體積(L),φinert,in, φO2,in, φO2,out和 φCO2,out分別表示進氣中惰性氣體、氧氣和尾氣中氧氣、二氧化碳的體積分數,pin表示進氣氣壓(Pa),Tin為溫度(℃),h為進氣的相對濕度(%),所有上述變量除Tin、h外均為在線檢測獲得,Tin、h為離線測定所得。
2 結果與討論
2.1 24孔板高通量培養方法的確定
2.1.1 孔板供氧水平和發酵時間對輔酶Q10發酵的影響 輔酶Q10發酵過程是好氧發酵,使用24孔板培養時,不同的培養基裝液量會引起供氧水平的差異,從而影響產物合成。選取1.0、1.5、2.0、2.5、3.0 mL和3.5 mL的裝液量,以同一瓶種子瓶進行接種,接種量16%、發酵48 h,考察孔板供氧水平對菌體生長和產物合成的影響。由圖1可以看出,隨著裝液體積的提高,菌濃不斷增加。孔板發酵過程中蒸發量大,裝液量越低蒸發越嚴重,從而導致發酵液黏度上升,因此不利于菌體生長。當裝液量為3.5 mL時,培養環境相對穩定,菌體生長情況最好,發酵結束時的OD700可達22.9。但隨著裝液量的提高,氧傳遞系數KLa逐漸減小[26],影響培養過程中的氣液傳質效果,且每個孔板的裝液比變高使得空氣含量減少,會進一步降低供氧水平,所以效價則呈現不同的變化趨勢,裝液量較高時,發酵結束的效價單位卻比較低。綜合考慮,選擇2.0 mL的孔板裝液量作為后續誘變初篩的培養體積。
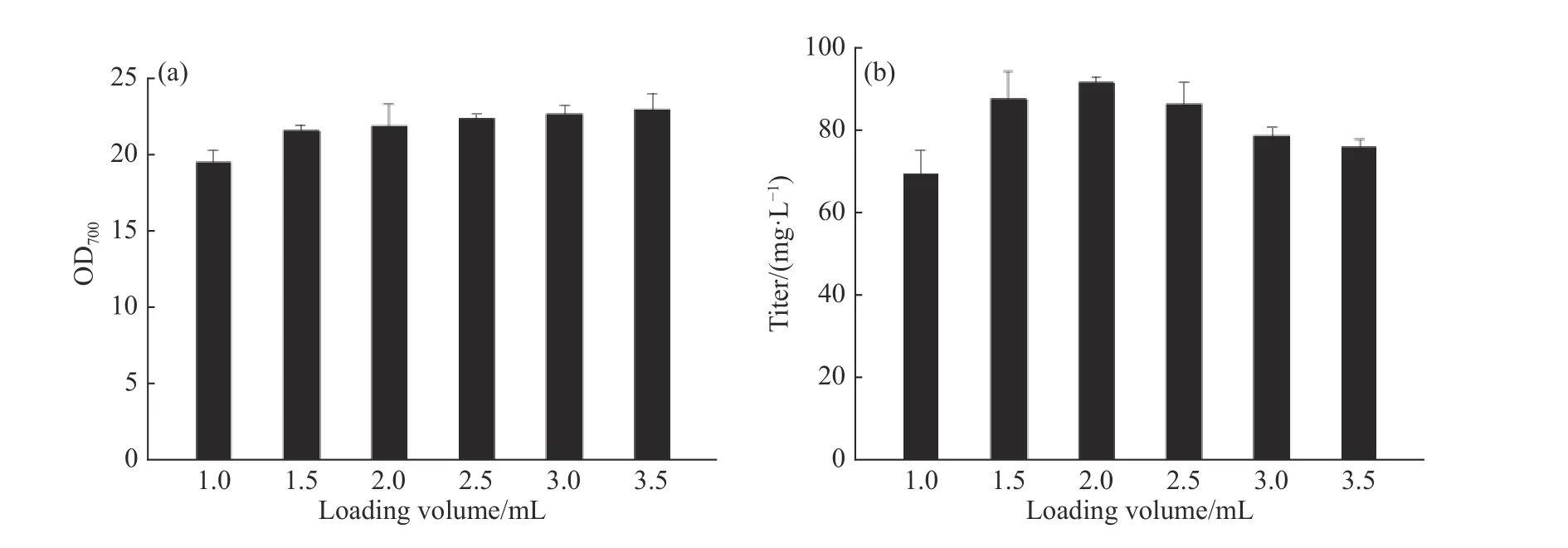
圖1 不同裝液量對類球紅細菌菌濃和效價的影響Fig. 1 Effect of different loading volume on R. sphaeroides growth and titer
2.1.2 孔板培養平行性分析 確定裝液量后,對孔板培養平行性進行評價(表1和表2)。結果表明24孔板發酵培養類球紅細菌時,同一孔板各行列效價的相對標準偏差(RSD)最大為5.70%,平均為4.01%,不同孔板間效價的RSD最大為6.27%,平均為5.11%。該結果表明孔板培養的平行性良好,各行列之間的誤差較小,將24孔板用于誘變菌株的初篩引起培養誤差較小。
2.1.3 孔板培養與搖瓶培養一致性考察 24孔板培養中每一個孔板的體積小,供氧水平、剪切程度和營養傳遞等與搖瓶存在差異,取同一種子液,采用孔板和搖瓶同時進行發酵,比較了菌濃、效價、pH和殘糖對兩者發酵結果的影響,分析了孔板微量培養代替搖瓶培養的可行性,培養結果如表3所示。發酵結束時,培養基中的葡萄糖基本被消耗完全,所以兩種培養模式下的pH 值和殘糖濃度相近。總體結果顯示孔板培養的菌濃和輔酶Q10含量略低于搖瓶培養,推斷與孔板培養的透氣膜孔小,蒸發量相對較大有關。但單位菌體的產率(Yp/x)非常一致,誤差低于2%,說明孔板培養條件下,菌體的合成代謝能夠反映搖瓶培養的結果,尤其是在初篩菌株時是完全可以用孔板替代搖瓶進行高通量篩選的。
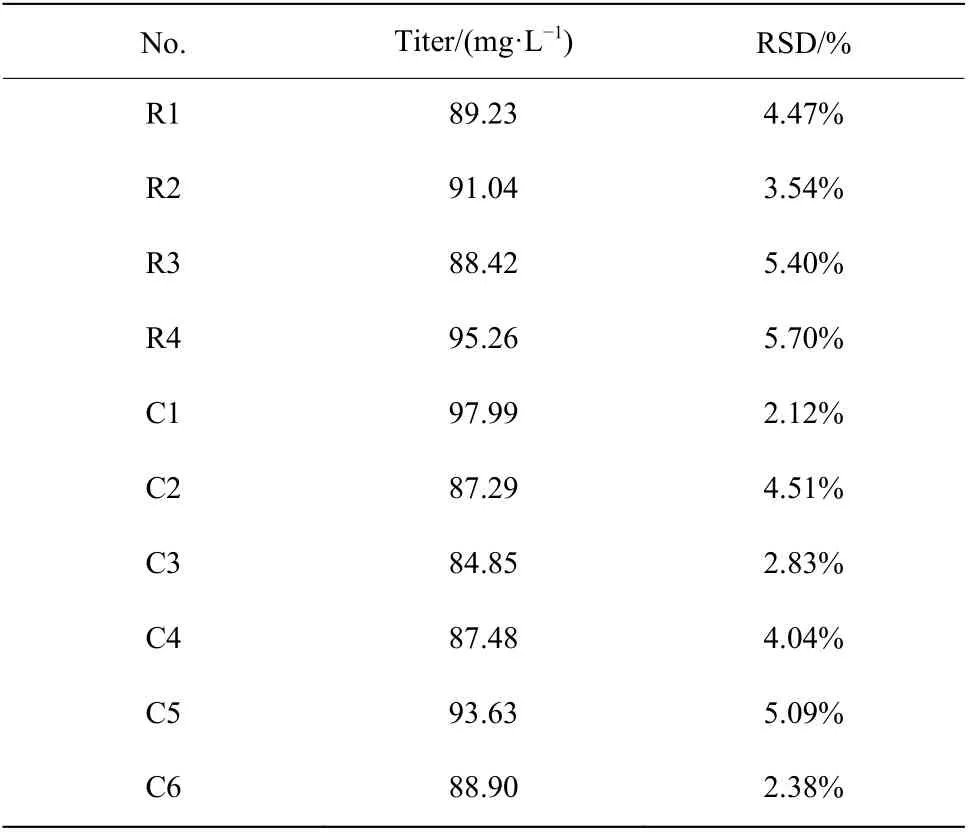
表1 同一塊孔板各行列平均效價差異Table 1 Difference of titer between rows and columns in one plate
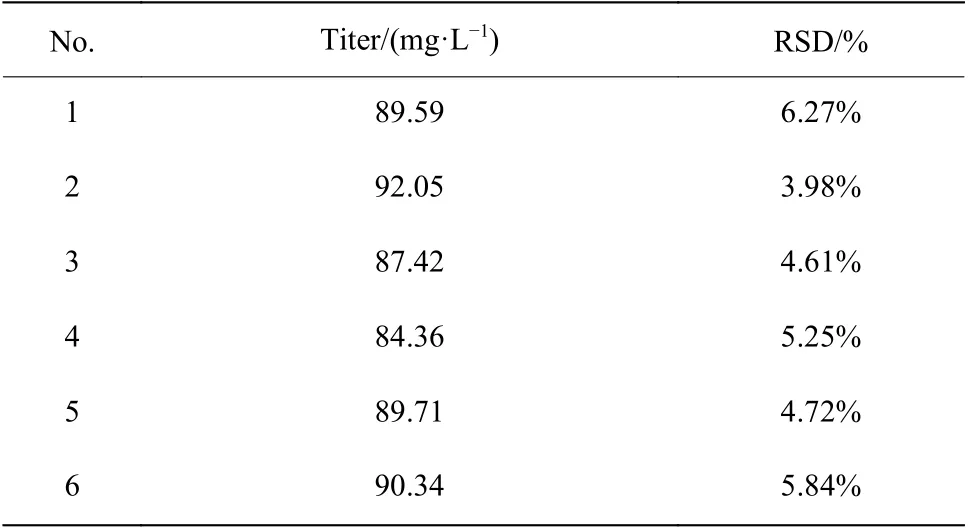
表2 不同孔板平均效價差異Table 2 Difference of titer in different plates
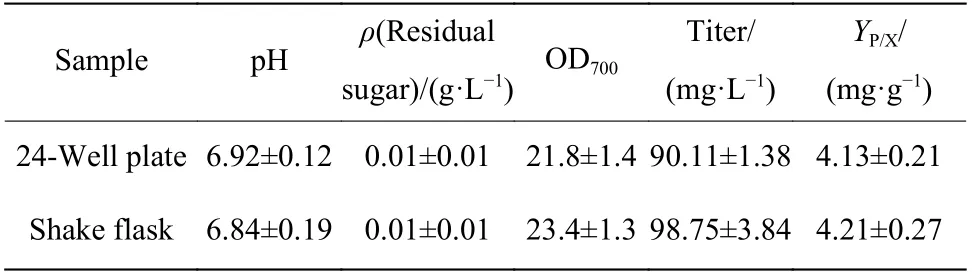
表3 24孔板和搖瓶發酵情況對比Table 3 Comparison of fermentation conditions in 24-well plate and shake flask culture
為進一步考察孔板培養和搖瓶培養的一致性,延長發酵時間,選取2.0、2.5、3.0、3.5 mL的孔板培養與搖瓶培養(50 mL)對比,分析48 h和60 h培養周期下產物合成的差異,結果如圖2所示。當發酵時間延長至60 h時,培養基中的碳源基本被消耗完全,營養限制使得菌體發生裂解,導致不同發酵體積的菌濃均有所下降。圖2(b)結果表明在糖耗盡時,還有一些積累的中間代謝物參與了產物的合成,所以60 h時孔板和搖瓶的效價都呈現增長趨勢,且孔板和搖瓶中效價的增長幅度相似(R2=0.902 6),表明孔板能夠反映常規搖瓶培養的結果。因此在后續實驗中,以孔板培養替代搖瓶培養,實現高通量菌株發酵性能篩選的方法是可行的。
2.2 高產菌株的誘變篩選
2.2.1 ARTP致死率曲線 ARTP誘變儀采用純度99.99%以上的高純度氦氣作為工作氣體,工作時可變參數有3個:功率、載氣量和時間,一般來說儀器的功率是固定的,主要改變載氣量和工作時間。為了尋找最佳的菌體誘變條件,在10 L/min的載氣量下,設定不同的工作時間(0、10、15、20、25、30、35 s和40 s)進行誘變處理。將不同處理時間得到的菌液進行梯度稀釋(一般稀釋至10?4倍),取100 μL涂布于固體平板上,每個樣品做3個平行,32 ℃避光培養6~7 d,根據平板上的菌落數目繪制致死率曲線(見圖3)。隨著誘變時間的增加,致死率不斷上升,當誘變時間為30 s時,致死率能夠達到99.04%,而其他微生物如白色鏈霉菌誘變420 s時的致死率為94.4%[27],可見類球紅細菌對等離子體的致死作用較為敏感。一般情況下,致死率越高菌株越容易發生突變,致死率在80%~90%時較為合適,因此為了獲得更多的突變株,本實驗選擇25 s作為最佳誘變時間,此時的致死率為86.02%。
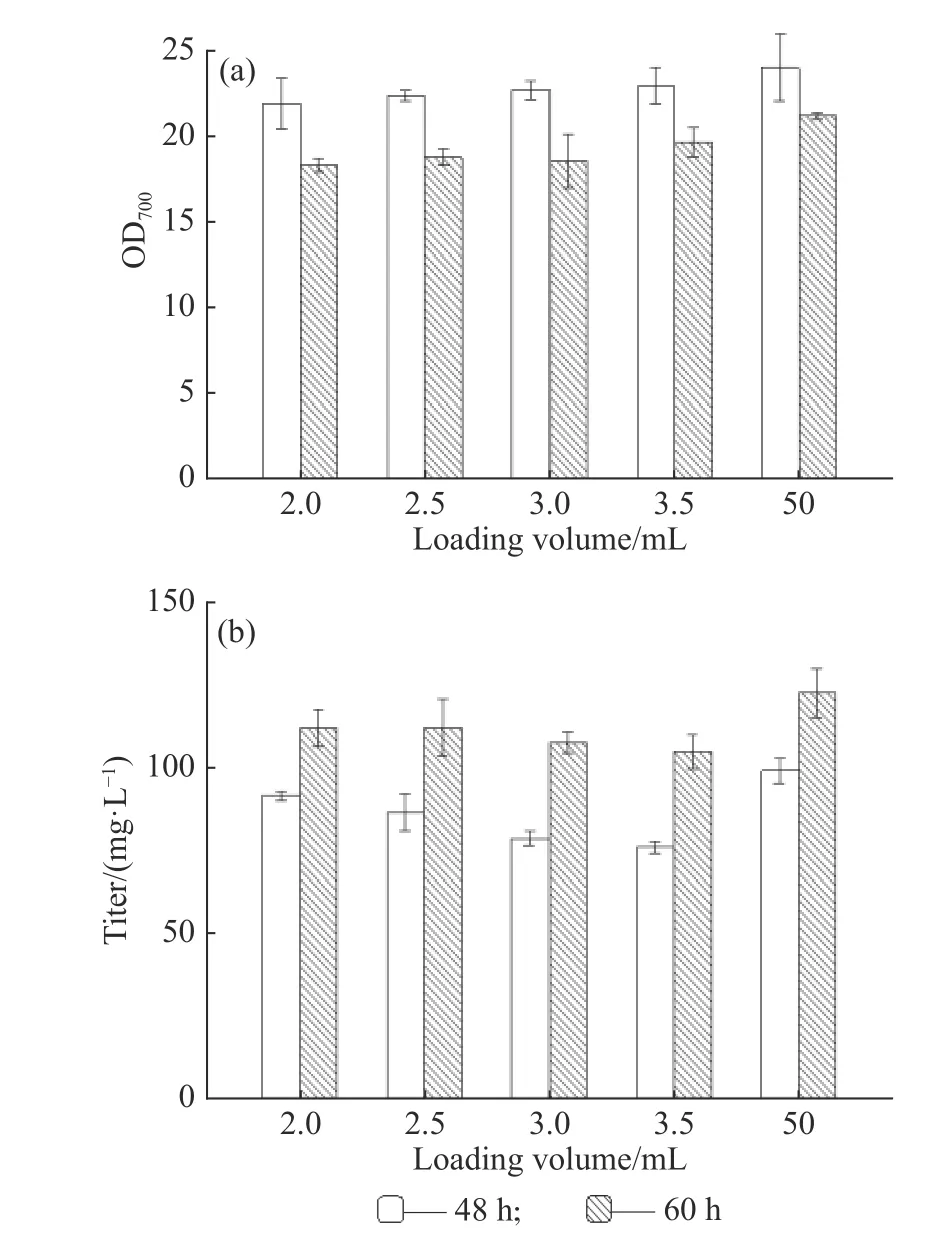
圖2 類球紅細菌發酵48 h和60 h菌濃和效價的對比Fig. 2 Comparison of R. sphaeroides growth and titer between 48 h and 60 h fermentation
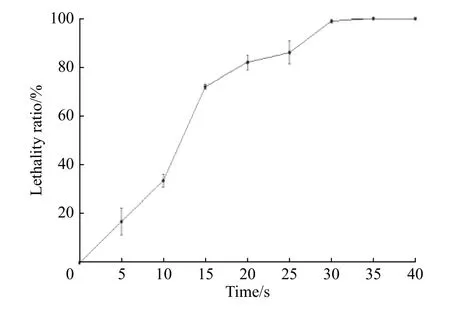
圖3 類球紅細菌的ARTP致死率曲線Fig. 3 Lethality curve of R. sphaeroides treated by ARTP
2.2.2 氧限制模型的構建 供氧受限能夠促進細胞內輔酶Q10的積累。無水亞硫酸鈉還原性極強,易溶于水,可與水中的氧氣發生氧化反應,降低培養環境空間的氧濃度。通過在平板培養基中添加無水亞硫酸鈉構建氧限制模型,可以篩選出在氧限制條件下能夠正常生長和合成產物的菌株。將出發菌株的菌懸液涂布于含有不同質量濃度無水亞硫酸鈉的平板上,每個濃度做3個平行,32 ℃避光培養6~7 d,統計各質量濃度平板上的菌落個數。從表4中可以看出,平板中無水亞硫酸鈉的質量濃度達到0.4 g/L時,已無菌落長出。比較菌株在原始平板和添加0.2 g/L無水亞硫酸鈉的平板上的菌落形態(圖4)可以看出,原始平板上長出的菌落直徑較大,且前期采用原始平板傳代時,菌株會發生退化導致菌落變為黃色,退化菌落發酵后輔酶Q10的產量很低,而氧限制平板上長出的菌落顏色變為更深的墨綠色,直徑較小且邊緣整齊清晰,黃色菌落出現的概率大大減小。推測在該模型下長出的菌落有較強的氧親和力,胞內呼吸代謝旺盛因而能夠耐受低氧環境,具備輔酶Q10高產的潛力。因此為了提高篩選效率,將突變株在含有0.4 g/L無水亞硫酸鈉的氧限制模型下生長。

表4 不同質量濃度的無水亞硫酸鈉對菌落生長情況的影響Table 4 Effects of different mass concentrations of sodium sulfite on R. sphaeroides colony forming units (CFU)
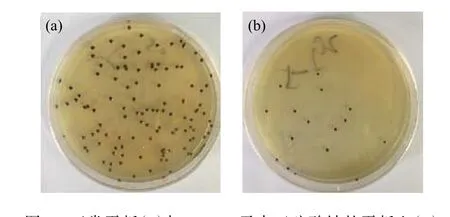
圖4 正常平板(a)與0.2 g/L無水亞硫酸鈉的平板上(b)培養菌落形態對比Fig. 4 Morphological comparison of colonies on normal plate (a)and 0.2 g/L sodium sulfite plate (b)
2.2.3 ARTP誘變結合氧限制模型篩選高產菌株 將用ARTP誘變25 s的類球紅細菌菌懸液進行梯度稀釋,涂布到無水亞硫酸鈉質量濃度為0.4 g/L的平板上,培養6~7 d,在平板上可以生長的即為在氧限制環境下呼吸能力較強的突變菌株,從中挑選顏色鮮艷、外觀飽滿的單菌落,進行孔板初篩,培養體積2 mL,發酵48 h,產物采用HPLC檢測。共篩選了506株菌,結果如圖5所示。
2.2.4 高產菌株搖瓶復篩及遺傳穩定性驗證 選取孔板初篩效價提高25%以上的6株突變株,分別為R. sphaeroidesF3C21、R. sphaeroidesF4B01、R. sphaeroidesF4E15、R. sphaeroidesF5D13、R. sphaeroides
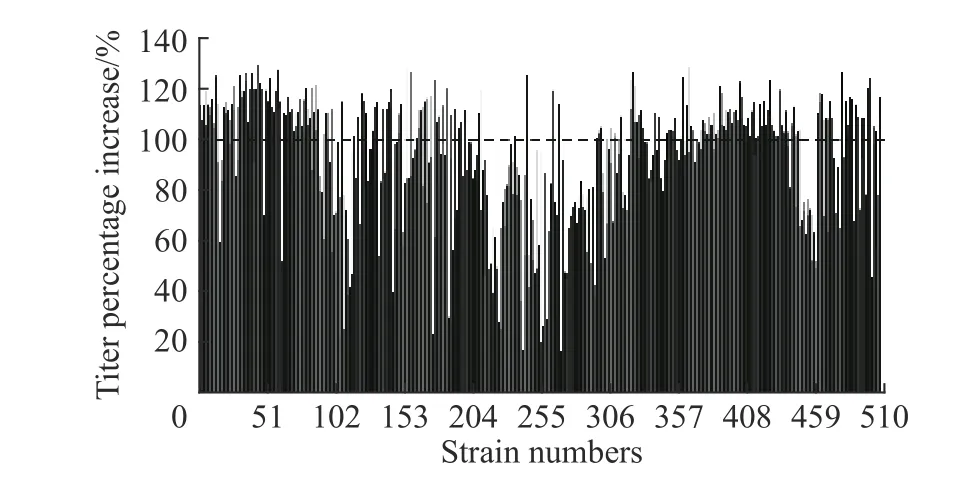
圖5 突變株24孔板初篩結果Fig. 5 Preliminary screening results of mutants by 24-well plates
F6F19和R. sphaeroidesF6G16,連續傳代培養并進行搖瓶發酵,驗證高產菌株遺傳穩定性,結果如圖6所示。從圖中可以看出,隨著傳代的進行,突變株的效價略有下降,其中R. sphaeroidesF3C21退化較大,R.sphaeroidesF5D13、R. sphaeroidesF4B01和R.sphaeroidesF6G16的遺傳穩定性較好,R. sphaeroidesF5D13傳代5代后的效價最高,為111.8 mg/L,比出發菌株(86.2 mg/L)提高了29.7%。
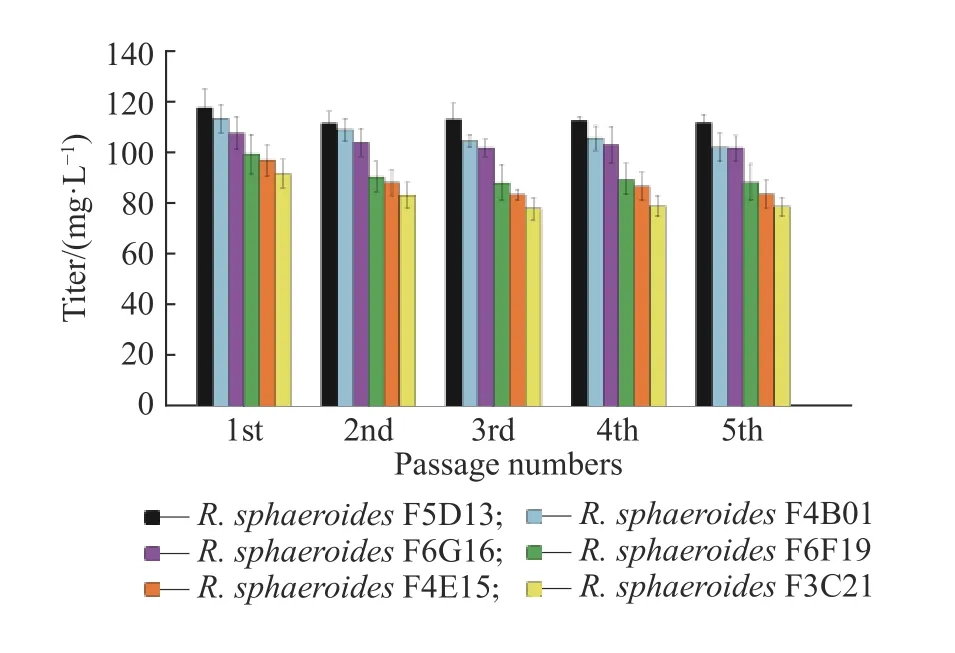
圖6 菌株遺傳穩定性驗證Fig. 6 Verification of genetic stability of the strain
2.2.5 高產菌株和出發菌株的生理代謝特性參數比較 為了進一步評估高產菌株R. sphaeroidesF5D13的生產能力,本文在5 L反應器中開展了高產菌株和出發菌株的發酵培養,并對過程中的參數進行采集,進一步分析高產菌株和出發菌株在菌體生長和產物合成之間的差異,結果如圖7和表5所示。在菌體生長方面,發酵前期(0~36 h),菌體快速生長,菌濃不斷提高,32 h時高產菌株R. sphaeroidesF5D13菌濃比出發菌株R. sphaeroidesJ-1菌濃明顯高14.5%,R.sphaeroidesF5D13的最大比生長速率為0.092 2 h?1,比R. sphaeroidesJ-1高了6.84%,表明在進入產物合成期前(48 h),R. sphaeroidesF5D13累積了較高的生物量進行產物合成。比較發酵中后期(48~100 h)兩者的效價增長趨勢(圖7b),R. sphaeroidesF5D13的初始效價明顯高于R. sphaeroidesJ-1,后期兩者的差異越來越大,發酵結束時高產菌株的效價為770.06 mg/L,較出發菌株的652.69 mg/L提高了18.0%,糖轉化率也較高。觀察發酵過程的攝氧率OUR曲線(圖7c)可以看出,前期R. sphaeroidesF5D13的OUR較早進入爬升期,隨后下降進入穩定期,最終維持在80左右;而R. sphaeroidesJ-1穩定期的OUR維持在60左右,明顯低于R. sphaeroidesF5D13。推測是前期高產菌R. sphaeroidesF5D13活力高、耗氧快,促進菌濃增加,OUR較早進入高點開始合成產物,因而初期的起步效價也較高;當產物大量合成,即OUR進入穩定期時,高產菌株對氧親和力強,呼吸代謝較出發菌株更為旺盛,更有利于維持產物的合成,氧消耗速率OUR也穩定在較高水平。結合比耗氧速率QO2變化(圖7d),高產菌株的QO2一直高于出發菌株,尤其是在產物合成的發酵中后期,進一步表明次級代謝階段高產菌株細胞活力優于出發菌株,產物合成能力較強。
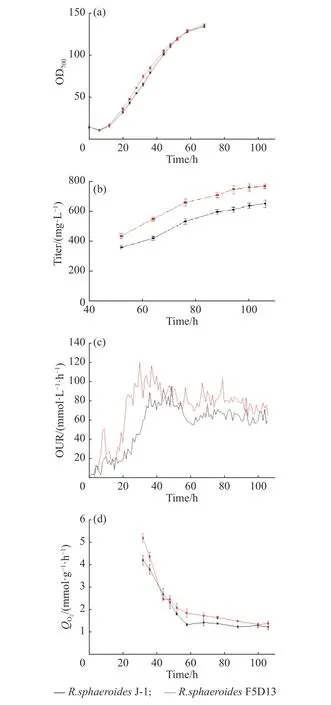
圖7 5 L反應器中出發菌株和高產菌株發酵過程變化的差異Fig. 7 Difference of fermentation process between the high-yield strain and the parent strain in 5 L fermentation reactor
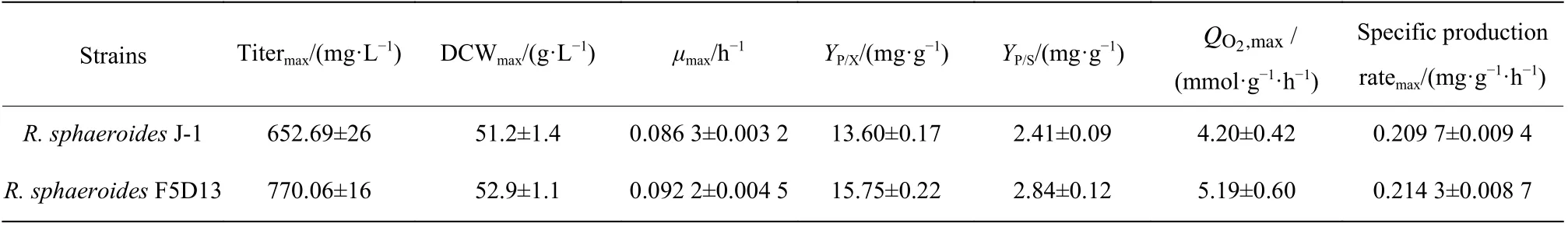
表5 出發菌株和高產菌株R. sphaeroides F5D13發酵過程參數Table 5 Calculated parameters of the fermentation conditions by R. sphaeroides J-1 and R. sphaeroides F5D13
3 結束語
為提高突變菌株的篩選效率,簡化培養過程,本文以孔板代替搖瓶進行突變株的初篩,探究了不同供氧水平對菌體細胞代謝特性的影響,對孔板中不同體積的培養結果進行了評價。結果顯示裝液量為2.0 mL、發酵周期為48 h時,孔板的菌濃和效價都和搖瓶結果相近,不同孔板位置培養的差異在實驗誤差范圍內,因此孔板可以用于類球紅細菌突變菌株的高通量培養。
ARTP作為一種新興的誘變手段,相較于傳統誘變技術更為高效,釋放的等離子體射流中包含的活性粒子可以引起細胞DNA的斷裂,進一步引發DNA易錯性修復機制,從而可以在短時間內處理生物細胞產生大量的突變體,提高突變率[28]。本文將ARTP技術應用于類球紅細菌的誘變,并針對產物合成特性,首次采用無水亞硫酸鈉構建氧限制模型篩選突變株。篩選得到高產菌株R. sphaeroidesF5D13,其傳代5次以后的搖瓶效價為111.8 mg/L,比出發菌株的86.2 mg/L提高了29.7%,遺傳穩定性良好。在5 L反應器中的培養結果顯示,高產菌株R. sphaeroidesF5D13發酵前期生長快,發酵中后期則表現出更強的氧親和力,耗氧速率明顯維持在一個較高水平,最終輔酶Q10的效價較出發菌株提高了18.0%,達到了770.06 mg/L。
綜上所述,利用ARTP對類球紅細菌進行誘變,結合氧限制模型進行篩選,可以有效篩選出輔酶Q10的高產菌株。后續可針對篩選得到的高產菌株,從供氧、補料等方面進行發酵條件的進一步優化,以期取得產能的再提升。

