基于“要素拼裝”的思維模型建構(gòu)
——以各類滴定計算為例
廣東省佛山市教育局教學(xué)研究室(528000) 潘 紅
廣東省佛山市高明區(qū)教師發(fā)展中心(528500) 雷范軍
滴定法是將一種標準溶液滴加到待測物質(zhì)溶液中,直到與待測物質(zhì)按化學(xué)計量關(guān)系定量反應(yīng)為止,然后根據(jù)標準溶液的濃度和消耗的體積,計算待測物質(zhì)含量的方法。滴定法作為一種化學(xué)分析方法,具有便捷、快速、準確度高等優(yōu)點,在工業(yè)分析和日常生活中有廣泛應(yīng)用,如食醋中乙酸含量的測定、碘量法測水中溶解氧、EDTA法測Mg2+含量等。根據(jù)滴定反應(yīng)原理的不同,可以將滴定法分為四大類型:酸堿中和滴定、氧化還原滴定、沉淀滴定和配位滴定。
本文通過對全國卷高考真題中常見滴定實驗考查角度的分析,聚焦各類滴定分析對于計算的考查。以兩例氧化還原滴定試題為例,梳理出解答滴定計算的一般思路,建構(gòu)了基于“要素拼裝”的解題思維模型。應(yīng)用模型對涉及酸堿中和滴定和配位滴定的高考真題進行快速解答,驗證了該解題模型的廣泛適用性,并反思了建構(gòu)基于“要素拼裝”的解題模型的意義。
1 考題分析
從高考命題來看,氧化還原滴定、沉淀滴定和配位滴定均是建立在酸堿中和滴定原理的基礎(chǔ)之上進行考查,試題情境一般是從化工生產(chǎn)或生活中取材,綜合考查元素化合物知識、滴定實驗基本操作、滴定終點判斷以及滴定計算。
其實,各類滴定分析方法在歷年高考真題中都有涉及,筆者通過對近4年高考真題中滴定方法的考查進行了統(tǒng)計,發(fā)現(xiàn)氧化還原滴定的考查最為常見,僅近三年全國卷中的考查就達6次之多。酸堿中和滴定和沉淀滴定考查較少,在2020年全國II卷27題有涉及。配位滴定由于反應(yīng)原理和實驗藥品對于學(xué)生有較大陌生度,僅在浙江、江蘇卷中曾經(jīng)出現(xiàn)過。
近三年高考全國卷試題中滴定實驗考查內(nèi)容見表1。從表中不難發(fā)現(xiàn),滴定分析考查角度主要集中在以下三個方面:①滴定終點的現(xiàn)象描述;②定量計算;③滴定誤差分析。
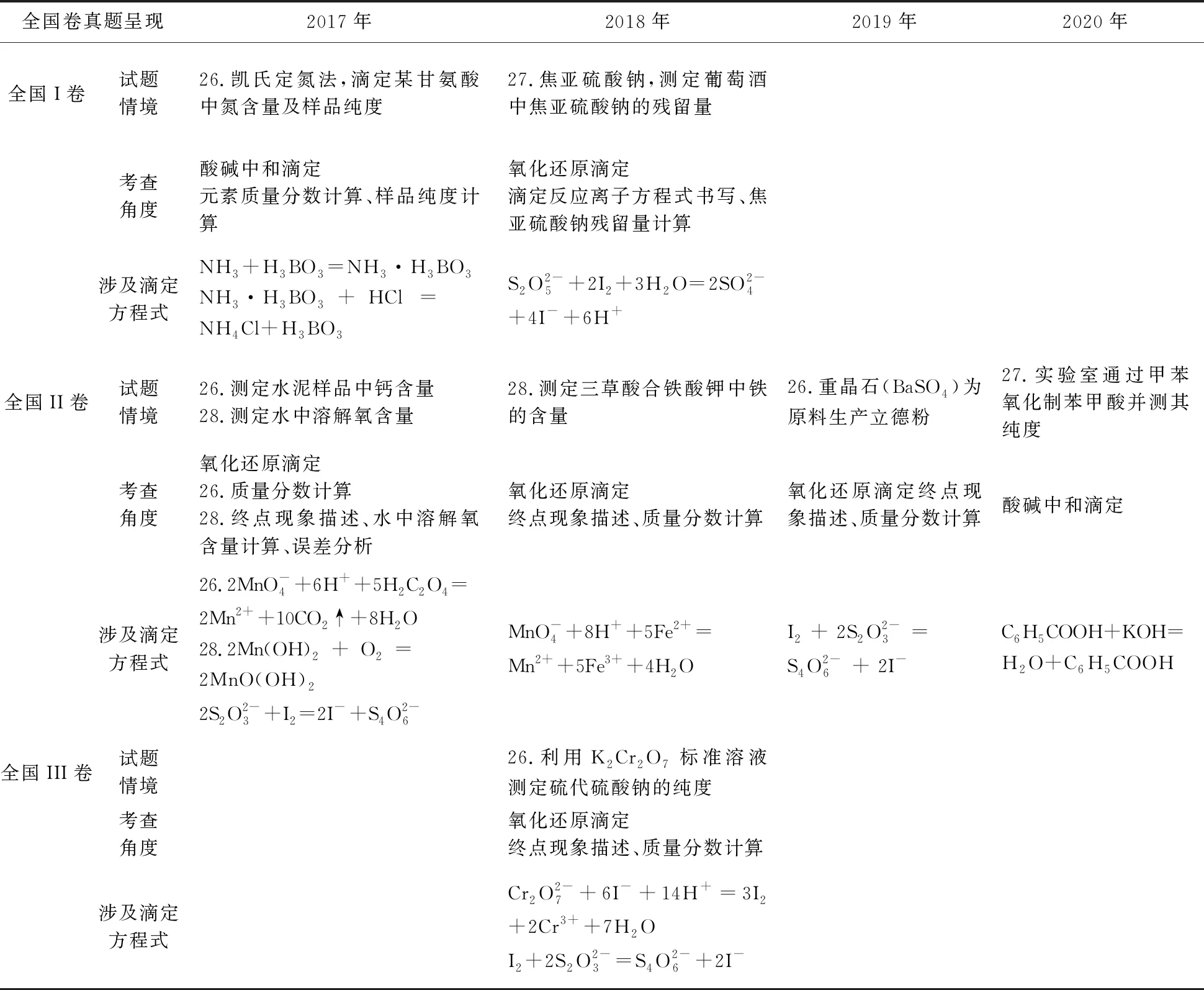
表1 近三年全國卷高考滴定實驗考查統(tǒng)計
2 突破滴定計算的一般思路
高考試題中區(qū)分度高的題目一般都會涉及相關(guān)定量計算,而滴定計算每年都會涉及,是名副其實的高頻考點。2017年全國II卷甚至考查了兩道滴定計算,但學(xué)生解題情況卻實在不盡人意,甚至大多數(shù)學(xué)生在此題留空。快速、準確答對定量計算題目,是學(xué)生奪取高分考上名校的現(xiàn)實需要。
課堂教學(xué)中,教師如果能幫助學(xué)生將復(fù)雜的思維過程進行梳理,去偽存真、去粗取精,并從中提取能準確描述該過程的核心元素或核心參數(shù),找出它們之間的正確關(guān)系,就可以幫助學(xué)生形成思考這一類問題的思維路徑或模型。
筆者基于對學(xué)生面對化學(xué)計算的畏難心理及解題困難點的分析,構(gòu)建了基于“要素拼裝”的解題思維模型,幫助學(xué)生有序思維快速破題,以求快速準確地突破各類滴定計算。
例1(2018年全國I卷27題):Na2S2O5可用作食品的抗氧化劑。在測定某葡萄酒中Na2S2O5殘留量時,取50.00 mL葡萄酒樣品,用0.01 000 mol·L-1的碘標準液滴定至終點,消耗10.00 mL。滴定反應(yīng)離子方程式為________該樣品中Na2S2O5的殘留量為________g·L-1(以SO2計)。
解析:
(2)尋找“待測液”與“標準液”反應(yīng)的定量關(guān)系。
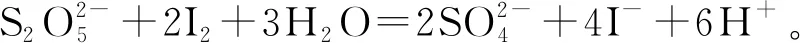
(3)由標準液的定量,結(jié)合定量關(guān)系換算待測液的定量。
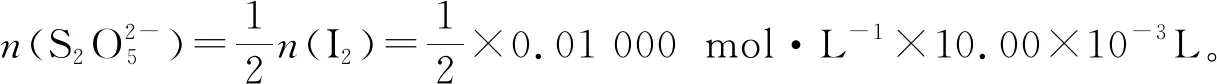
(4)結(jié)合題目要求,得出結(jié)果。
例2(2019年10月浙江十校聯(lián)考):保險粉樣品中Na2S2O3·5H2O的純度(質(zhì)量分數(shù))可通過氧化還原滴定法測定,相關(guān)反應(yīng)方程式為2Na2S2O3+I2=2NaI+Na2S4O6。準確稱取W g樣品于錐形瓶中,用適量蒸餾水溶解,并滴加淀粉溶液作指示劑,用0.1 000 mol/L碘標準溶液進行滴定。到達終點時測得消耗碘標準溶液體積為18.10 mL,產(chǎn)品的純度為:____(設(shè)Na2S2O3·5H2O相對分子質(zhì)量為M)。
解析:
(1)明確“待測液”為Na2S2O3,“標準液”為I2。
(2)由反應(yīng)方程式2Na2S2O3+I2=2NaI+Na2S4O6得到“待測液”與“標準液”反應(yīng)的定量關(guān)系為2Na2S2O3~I2,用數(shù)字表示為2。
(3)由標準液的定量,結(jié)合定量關(guān)系換算待測液的定量。
(4)結(jié)合題目要求,得出結(jié)果。
保險粉樣品中Na2S2O3·5H2O的純度為:
結(jié)合例1和例2的分析,可以總結(jié)得出解答滴定計算的一般思路如圖1所示。
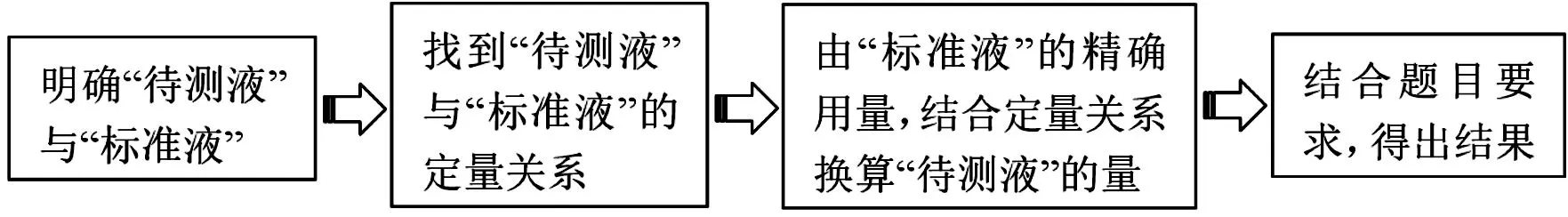
圖1 解答滴定計算的一般思路
3 基于“要素拼裝”的解題思維模型的建構(gòu)
對比觀察例1和例2中滴定計算的表達式,就可以發(fā)現(xiàn)它們都有5個要素,分別用①②③④⑤表示。
例1:
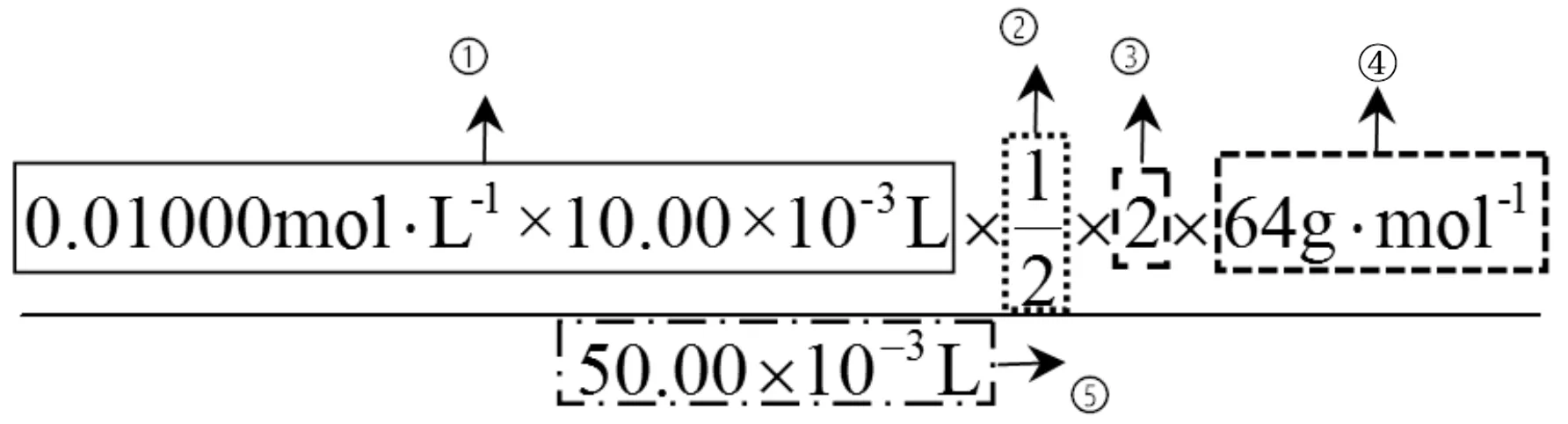
例2:
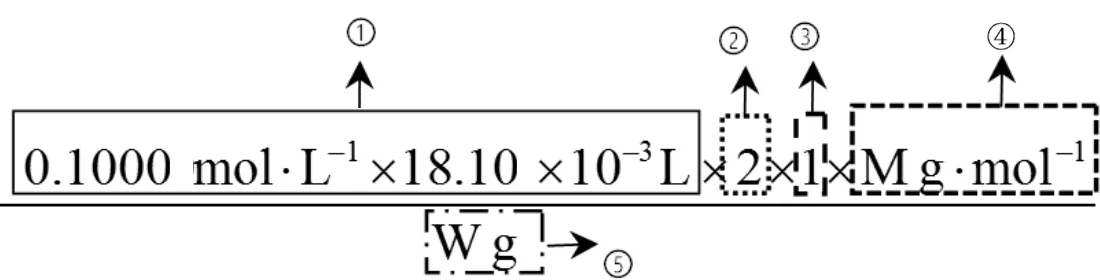
下面筆者就“5要素”分別作解讀:
①中式子由3個數(shù)相乘,即c標×V標×10-3,表示標準液的用量n標,單位mol。
②是一個分數(shù)或整數(shù),表示“待測液”與“標準液”反應(yīng)的定量關(guān)系。
找準此“定量關(guān)系”是整個計算表達式中是核心而關(guān)鍵的一個要素,直接影響到最終計算結(jié)果的正確表達。對于氧化還原滴定反應(yīng)來說,有時候題目未給出具體的滴定反應(yīng),那么此時就需按照氧化還原反應(yīng)的原理從元素價態(tài)入手進行分析,找準待測液、標準液與氧化劑、還原劑的對應(yīng)關(guān)系,再分析清楚“氧化劑→還原產(chǎn)物”和“還原劑→氧化產(chǎn)物”的物質(zhì)變化,最后根據(jù)得失電子守恒和原子守恒等原則書寫出正確的反應(yīng)方程式,從而快速準確地突破“待測液”與“標準液”反應(yīng)的定量關(guān)系。對于沉淀滴定、酸堿中和滴定和配位滴定,此“定量關(guān)系”一般來說較為簡單。
③表示取量關(guān)系。如例1中由①×②求得了待測樣品中Na2S2O5的物質(zhì)的量,而題目要求樣品中Na2S2O5的殘留量以SO2計。由于n(SO2)=2n(Na2S2O5),所以定“取量關(guān)系”為2。
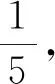
④是待測物的摩爾質(zhì)量,單位g·mol-1。有些題目會在題干給出(如例2),沒有直接給出(如例1)就需要根據(jù)試卷中“可能用到的相對原子質(zhì)量”計算。
⑤表示樣品用量,一般是取樣的體積或質(zhì)量。如例1中要求樣品中Na2S2O5的殘留量單位為g·L-1,所以表達式的分母上就要將葡萄酒樣品50.00 mL換算成50.00×10-3L。
至此,可將滴定計算中出現(xiàn)最多的樣品純度計算表達式,基于“要素拼裝”,用一個模型表示如下:

從確定各要素的復(fù)雜性和重要性角度,用一句口訣可以概括如下:n標表達很簡單,定量關(guān)系最關(guān)鍵,取量倍數(shù)憑口算,摩爾質(zhì)量看題干,樣品用量最簡單,直接照搬分母攤。
4 基于“要素拼裝”的解題思維模型的應(yīng)用
有了以上基于“要素拼裝”的滴定計算解題模型,就可以迅速地幫助學(xué)生快速破解各類滴定計算的奧秘。現(xiàn)再舉酸堿中和滴定和配位滴定兩類常見的滴定情境,體現(xiàn)此模型的適用性。
例3(2017年全國I卷26題):取某甘氨酸(C2H5NO2)樣品m g進行測定,滴定裝置中吸收時消耗濃度為c mol·L-1的鹽酸V mL,則樣品中氮的質(zhì)量分數(shù)為___%,樣品的純度≤___%(已知:NH3+H3BO3=NH3·H3BO3;NH3·H3BO3+HCl=NH4Cl+H3BO3)。
解析:此滴定情境為酸堿中和滴定。由題意知,甘氨酸(C2H5NO2)樣品中的N元素在濃硫酸作用下轉(zhuǎn)化為NH3,NH3被H3BO3吸收,反應(yīng)方程式為NH3+H3BO3=NH3·H3BO3,再用鹽酸對NH3·H3BO3進行滴定,滴定反應(yīng)方程式為NH3·H3BO3+HCl=NH4Cl+H3BO3。
①n標=cV×10-3mol;
②由滴定反應(yīng)方程式可以看出待測液與標準液的“定量關(guān)系”為1;
③樣品“全量”進行反應(yīng),所以“取量關(guān)系”為1;
④氮的摩爾質(zhì)量為14 g·mol-1;樣品的摩爾質(zhì)量為75 g·mol-1;
⑤“樣品用量”為m g。
例4(2012年天津卷):探究小組用滴定法測定CuSO4·5H2O(Mr=250)含量。取a g試樣配成100 mL溶液,每次取20.00 mL,消除干擾離子后,用c mol·L-1EDTA(H2Y2-)標準溶液滴定至終點,平均消耗EDTA溶液b mL。滴定反應(yīng)如下:Cu2++H2Y2-= CuY2-+ 2H+,寫出計算CuSO4·5H2O質(zhì)量分數(shù)的表達式ω=________。
解析:此滴定情境為配位(絡(luò)合)滴定。
①n標=cb×10-3mol;
②由滴定反應(yīng)方程式可以看出待測液與標準液的“定量關(guān)系”為1;
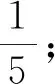
④摩爾質(zhì)量為250 g·mol-1;
⑤“樣品用量”為a g。
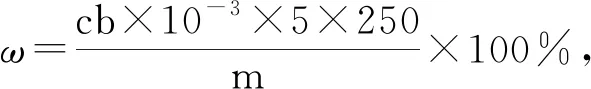
5 建構(gòu)解題思維模型的意義
“模型認知”是高中學(xué)生在系統(tǒng)學(xué)習(xí)了化學(xué)、數(shù)學(xué)、物理等科學(xué)課程后所應(yīng)具備的核心素養(yǎng)。課堂教學(xué)應(yīng)促進學(xué)生通過分析、推理等方法認識研究對象的本質(zhì)特征、構(gòu)成要素及其相互關(guān)系,建立認知模型,并能運用模型解釋化學(xué)現(xiàn)象,揭示現(xiàn)象的本質(zhì)和規(guī)律。思維建模是將學(xué)習(xí)者內(nèi)在的思維過程顯現(xiàn)化、模式化,這一過程就是,經(jīng)過篩選理清主線,并簡化為具有廣泛意義的思維模型。
在二輪復(fù)習(xí)備考過程中,教師針對高考高頻考點的穩(wěn)定題型進行解題思維模型建構(gòu),可以幫助學(xué)生精準篩選有用信息,快速排除干擾因素,迅速準確地入題、破題、解題,也利于培養(yǎng)學(xué)生學(xué)習(xí)化學(xué)的“模型認知”意識和素養(yǎng),提高篩選整合信息的能力、分析和解決化學(xué)問題的能力。
理科綜合考試題量大、思維跳躍性強,學(xué)生大多感覺時間不夠用,遇到計算相關(guān)題目更是或“望而卻步”,或“望風而逃”或“望洋興嘆”,考場之上必須果斷入題、快速破題。教師如能幫助學(xué)生解構(gòu)計算過程,進行要素分析,再反向?qū)⒁仄囱b,建立解題模型,這樣就能消除學(xué)生對于化學(xué)計算的畏懼心理,增強奪分意識,在高考選拔性上占據(jù)主動。

