冷藏期間鮮食核桃霉菌總數變化及主要種類鑒定*
李勇鵬,潘莉,寧德魯,耿樹香,張艷麗
(云南省林業和草原科學院,云南 昆明 650201)
核桃是重要的干果和木本油料樹種,我國的主要栽培種有普通核桃(Juglansregia)和深紋核桃(J.sigillata)2個種[1],其中深紋核桃主要分布在云南、貴州、四川西部和西藏雅魯藏布江中下游地區[2],是西南地區的核桃主要栽培種。隨著核桃栽培面積和產量的不斷提升,核桃產品呈現多樣化的發展趨勢。核桃鮮果由于具有獨特的風味和口感,且營養價值優于核桃干果,越來越受到消費者的喜愛,有很好的市場前景[3]。然而核桃鮮果由于水分含量較高,極易發生霉變而失去商品價值[4]。關于引起核桃霉變的病原菌及其抑制措施已有一些研究,但研究材料主要為普通核桃[5-7],關于深紋核桃霉變的研究尚未見報道。云南省核桃種植面積已超286.67×104hm2,其種植面積和產量均居全國第一,主栽品種漾濞泡核桃為深紋核桃[1]。本文以新鮮的漾濞泡核桃為研究對象,研究了在冷藏(2±1 )℃條件下核桃鮮果霉菌數量的變化及主要的霉菌種類,以期為云南鮮食核桃的貯藏提供理論依據和技術指導。
1 材料與方法
1.1 材料
供試材料 漾濞泡核桃,2019年9月11日采自云南省大理州漾濞縣馬廠核桃林場,脫去青皮后用清水漂洗,晾干果殼表面的水分。
孟加拉紅培養基 蛋白胨5 g,葡萄糖10 g,磷酸二氫鉀1 g,硫酸鎂0.5 g,瓊脂15 g,孟加拉紅0.033 g,氯霉素0.1 g,加入水至1 000 mL,121 ℃滅菌20 min。
馬鈴薯葡萄糖瓊脂培養基(PDA) 馬鈴薯200 g,葡萄糖20 g,瓊脂15 g,加水至1 000 mL,121 ℃滅菌20 min。
1.2 材料處理
本實驗在云南省林業和草原科學院木本油料工程中心實驗室進行,對核桃殼果采用兩種試劑進行處理:處理P試劑為ClO2,配制成濃度為80 mg/L的水溶液;處理Q試劑為核桃青皮提取物,青皮提取物的制備方法參考王小雙等[8]的方法,配制成濃度為10 g/L的水溶液。將核桃樣品分別浸泡于兩種溶液中10 s,取出后晾干表面水分。設對照組(CK),不用試劑處理。每個處理100個核桃殼果,重復3次,處理好的新鮮核桃裝筐后套上硅窗保鮮袋放入冷庫保存。實驗至新鮮核桃果殼表面發生明顯霉變時終止。
1.3 霉菌總數的測定方法
參照GB 4789.15—2016 《食品安全國家標準食品微生物學檢驗霉菌和酵母計數》[9]的方法進行,采用平板菌落計數法。樣品在冷庫保存20 d后,每隔10 d取一次樣。稱取25 g樣品,加入無菌水制成1︰10的樣品溶液。(1)核桃殼果樣品:將殼果與無菌水充分振搖,制成菌懸液;(2)核桃仁樣品:核桃仁加入無菌水后用果蔬攪拌機打成勻漿。
取1 mL的1︰10樣品溶液加入裝有9 mL無菌水的試管中,充分混勻得到1︰100倍的樣品溶液。根據樣品的污染程度,制作10倍梯度稀釋樣品溶液,選擇3個稀釋度的樣品溶液,分別吸取1 mL樣品勻液放入2個無菌平皿內,及時將20~25 mL冷卻至約46 ℃的孟加拉紅瓊脂傾注平皿,充分混勻,置水平臺面待培養基完全凝固。同時分別取1 mL無菌水注入于2個無菌平皿,傾注培養基作空白對照。瓊脂凝固后,置于28 ℃的培養箱中培養,觀察并記錄培養至第5 d的結果。結果以菌落形成單位(colony-forming units,CFU)表示,用肉眼觀察記錄菌落數。
1.4 霉菌分離與種類鑒定
1.4.1 核桃殼果主要霉菌的分離、純化及保存
霉菌的分離采用梯度平板稀釋法,結合霉菌計數實驗開展,觀察孟加拉紅培養基長出的各菌落的形態、顏色及菌絲形狀,挑取數量和頻率都較高的菌落邊緣菌絲,轉接于PDA培養基上。觀察菌落在PDA培養基上正反面的形態,對不純的菌落轉接純化。純化后的菌種接種于PDA試管斜面保存。
1.4.2 菌株的形態學特征鑒定
從純化培養的菌落上挑取少許菌絲制片,在光學顯微鏡下觀察真菌特征。主要包括菌絲顏色、有無隔膜,孢子形態、大小及著生狀態等,根據《真菌鑒定手冊》[10]等資料鑒定霉菌的種類。
1.4.3 菌株的分子生物學鑒定
將純化后的菌株在PDA培養基上培養一段時間后,刮取約0.1 g菌絲體,置于2.0 mL的滅菌離心管中,采用(Biospin Fungus Genomic DNA Extraction Kit)方法提取菌株的DNA。用真菌通用引物ITS4(5′-TCC TCC GCT TAT TGA TAT GC-3′)、ITS1-F(5′-CTT GGT CAT TTA GAG GAA GTA A -3′)對菌株的DNA進行PCR擴增,擴增片段包括ITS1-5、8S-ITS2片段。PCR擴增體系為:25 μL的2×TSINGKE Master Mix,濃度為10 μM的引物ITS4和ITS1-F各1 μL,模板DNA 2 μL,加dd H2O至總體積為50 μL。擴增條件為94 ℃預變性4 min,94 ℃變性30 s,53 ℃退火40 s,72 ℃延伸1 min,30次循環,最后72 ℃延伸7 min。PCR產物經1%的瓊脂糖凝膠電脈檢測,將亮度清晰且條帶范圍在500~1 600 bp的PCR產物送上海生工(生物工程技術服務有限公司)測序。測序結果首先運用DNASTAR軟件中SeqMan程序對測序結果的膠圖進行校正,去掉兩端信號不好的部分,保存校正后序列。重新使用SeqMan程序,將所有校正后序列導入軟件,進行相似度比對。將所有序列按97%的相似度進行聚類,保存聚類結果。選取每個聚類組的代表序列進行在線NCBI 的Blast檢索系統進行同源性比對,選取相似度高的參考序列。將聚類組的代表序列和參考序列導入MEGA 7軟件,構建系統進化發育樹。
1.4.4 致病性測定
為驗證分離的真菌是否會引起核桃霉變,將菌絲接種于消毒好的核桃仁表面。將核桃破殼取仁,將核桃仁放在75%的酒精中消毒5 min,再用無菌水沖洗4次,隨后置于滅菌的平板中。挑取少許菌絲置于核桃仁的表面接種,以不接菌的核桃仁為對照。將平板貼好封口膜,置于28 ℃的培養箱中培養,觀察霉變情況。
2 結果與分析
2.1 不同處理對核桃殼果霉菌生長的影響
核桃果在貯藏初期的霉菌數量較低,隨著貯藏時間的增加而增長。核桃殼表面的霉菌數量初期較低,在40 d后開始快速增長(圖1)。后期的霉菌數量為CK>ClO2處理組(處理P)>核桃青皮提取液處理組(處理Q),表明用ClO2和核桃青皮提取物處理核桃殼果,都對核桃殼果表面的霉菌生長有一定的抑制作用,而且核桃青皮提取物對霉菌的抑制效果更好。
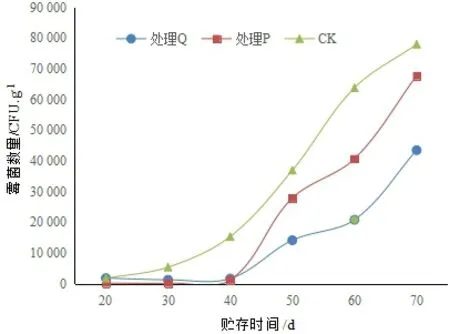
圖1 核桃殼果表面不同時間下的霉菌數量注:處理P試劑為ClO2,處理Q試劑為 核桃青皮提取物,CK為對照組,圖2同。Fig.1 Number of mould on the surface of walnut husk during storage
核桃仁的霉菌數量在貯藏的前50 d保持在較低的水平,之后開始快速增長,2個處理組與對照組的霉菌數量相差不大(圖2)。與果殼表面的霉菌數量相比,核桃仁的霉菌數量較少。用青皮提取物(處理Q)和ClO2(處理P)處理殼果的表面,對殼果表面的霉菌數量有抑制作用,而對核桃仁的霉菌數量無明顯的抑制作用,可能是由于果殼的保護作用,殼表面的霉菌和仁的霉菌沒有緊密的關聯。
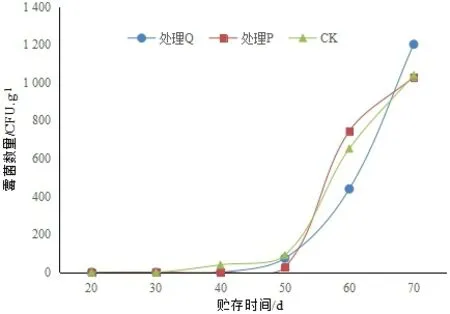
圖2 核桃仁的霉菌總數Fig.2 Number of mould in the walnut kernel during storage
2.2 主要霉菌種類分離鑒定及致病性驗證
2.2.1 形態鑒定
從核桃殼果和核桃仁分離的真菌種類較多,出現頻率最多的有2種菌,標記為HTM1-1和HTM1-2。HTM1-1在PDA培養基上生長較快,菌落邊緣為白色絨毛狀,中間為灰綠色粉粒狀霉層,表面干燥。分生孢子梗無色,帚狀分枝,孢子灰綠色,卵圓形串生(圖3)。根據其形態特征,初步將HTM1-1鑒定為擴展青霉(Penicilliumexpansum)。HTM1-2在PDA培養基上生長很快,菌絲致密,氣生菌絲較長,菌絲初期白色,后菌落中間呈現粉色或黃褐色,菌落表面呈現環紋。HTM1-2的新生菌絲無色,成熟菌絲黃褐色,菌絲有明顯的隔膜,成熟菌絲的分隔膨大呈連續的節狀。在PDA培養基上HTM1-2未觀察到大型分生孢子,而在核桃仁培養的菌絲具有典型的鐮刀菌屬(Fusarium)的大型分生孢子、小型分生孢子和厚垣孢子(圖4)。根據其形態特征,將HTM1-2鑒定為木賊鐮刀菌(Fusariumequiseti)。
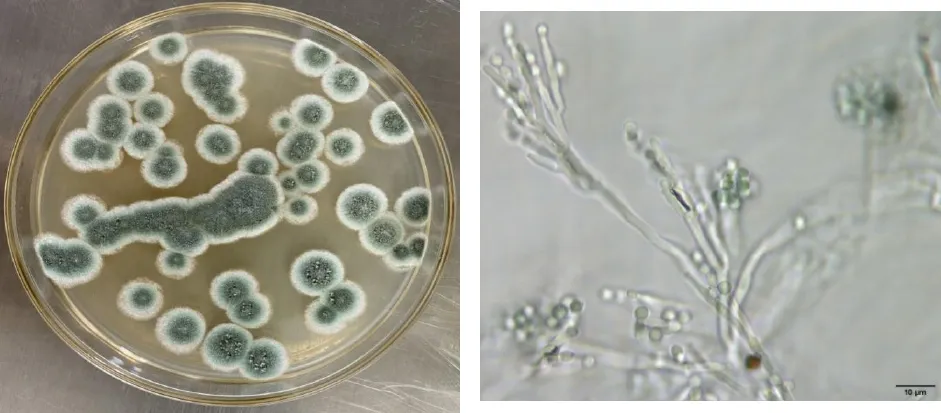
圖3 擴展青霉在PDA培養基生長形態及其顯微形態(×100)

圖4 木賊鐮刀菌在PDA培養基的形態及其顯微形態(×100)
參照管斌等[11]等的方法,將2種霉菌分別接種于消毒后的核桃仁,對其致病性進行驗證。經過一段時間的培養,接種了霉菌的核桃仁出現了和鮮果貯藏后期相同的霉變,未接種的核桃仁沒有發生霉變(圖5)。接種了擴展青霉的核桃仁表面長出了灰綠色的霉層,接種了木賊鐮刀菌的核桃仁長出了白色長絲狀菌絲。將霉變核桃仁上的霉菌分離并在PDA培養基上培養,得到了與接種菌株形態特征相同的菌株,證實了擴展青霉和木賊鐮刀菌是引起核桃鮮果長出青黑色霉點和白色霉點的致病菌。
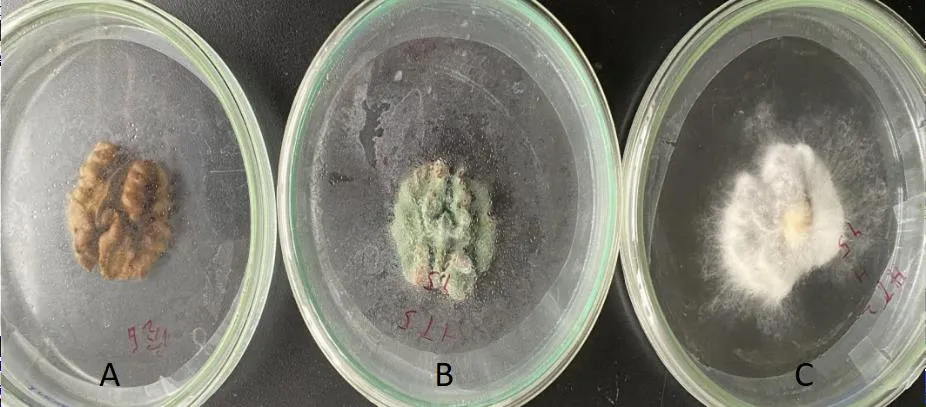
圖5 核桃仁接種霉菌后的霉變情況注:A為CK,B為擴展青霉,C為木賊鐮刀菌Fig.5 The pathogenecity of isolated fungi
2.2.2 霉菌rDNA-ITS序列分析及鑒定
將HTM1-1和HTM1-2進行分子生物學鑒定,測序得其ITS序列。測序結果在NCBI進行比對,發現它們分別與擴展青霉(Penicilliumexpansum)和木賊鐮刀菌(Fusariumequiseti)的相似性達到99.83%和100.00%。將分離菌株的序列和參考序列用Mega 7.0軟件構建NJ系統發育樹(圖6),這2種分離菌株的序列分別與對應的參考序列聚為一枝。綜合分子比對結果和形態特征鑒定,將這2種霉菌鑒定為擴展青霉和木賊鐮刀菌。
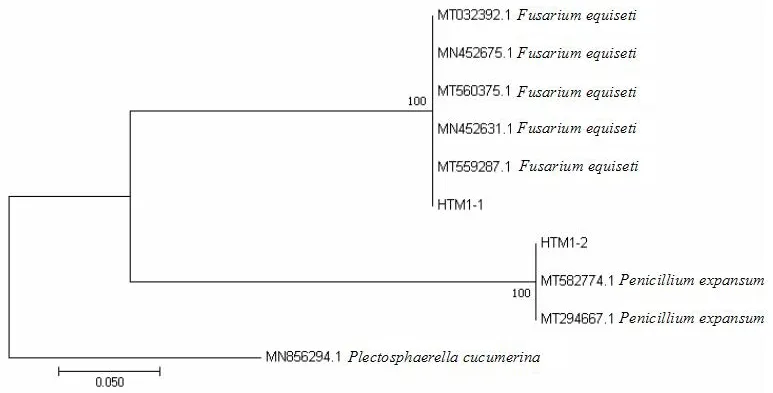
圖6 分離菌株基于ITS序列構建的NJ系統發育樹Fig.6 Phylogenetic tree based on ITS sequences of isolated fungi
3 結論與討論
本研究結果表明,在低溫貯藏條件下新鮮核桃殼果表面的霉菌數量在40 d后開始快速增加,核桃仁的霉菌數量50 d后開始快速增加。用核桃青皮提取物和ClO2溶液處理核桃殼果,對核桃仁霉菌生長的影響不明顯,但對殼果表面的霉菌生長都有明顯的抑制作用,其中核桃青皮提取物的抑菌效果優于ClO2。已有研究表明,核桃青皮提取物有較好的抑菌活性[12-13],而且具有一定的藥用保健價值[8]。云南核桃的殼果表面紋路較深,果殼凹陷處易發生霉變影響商品的品質。核桃青皮提取物能較好的抑制殼果表面霉菌的生長,而且材料易得,價格低廉,具有良好的開發應用前景。
核桃鮮果由于水分含量高,在冷藏過程中極易發生霉變,防止霉變是核桃鮮果貯藏中需要特別重視的問題。本研究對低溫貯藏條件下引起深紋核桃鮮果霉變的主要霉菌種類進行了分離、純化、形態學和分子生物學鑒定,并對分離的霉菌開展了致病性測定,結果表明引起核桃霉變的主要種類為擴展青霉和木賊鐮刀菌。擴展青霉會在核桃種殼和內種皮上形成灰綠色的霉點和霉層,木賊鐮刀菌引起白毛狀霉變。擴展青霉可導致多種水果腐敗變質,引發蘋果(Malussieversii)、櫻桃(Cerasuspseudocerasus)、油桃(Prunuspersicavar.nectarina)、水蜜桃(Prunuspersica)等水果的青霉病,造成生產和采后損失[14]。擴展青霉會分泌展青霉素,展青霉素可引起細胞氧化損傷,甚至誘發癌癥,若殘留在食品中,會對食用者健康造成極大危害[15]。鐮刀菌是一類重要的植物病原菌,可引起植物的根莖葉果實腐爛,造成嚴重的經濟損失[16]。引起鮮食核桃霉變真菌的主要種類已有相關報道,耿陽陽等[7]從貴州省貯藏期霉爛的鮮核桃上分離的霉菌有毛霉屬(Mucor)、鐮孢菌屬(Fusarium)、曲霉屬(Aspergillus),黃凱等[17]分離鑒定了陜西省鮮食核桃貯藏過程的霉菌,得出主要的致病菌為擴展青霉。由于生長環境和品種的不同,引起鮮食核桃發生霉變的霉菌類型會有所不同。云南核桃栽培歷史悠久,品種繁多,各栽培區氣候條件差異較大。本文以云南核桃主栽品種為研究對象,研究了云南核桃鮮果主產區的果實在貯藏期間的霉變情況和霉菌種類,其他品種和栽培區的霉菌種類和霉變情況有待進一步的研究。本研究通過分離鑒定,發現云南核桃主栽品種漾濞泡核桃在貯藏期間引起霉變的主要真菌為擴展青霉和木賊鐮刀菌。由于這2種真菌都是產毒素真菌,在將來的鮮食核桃貯藏研究中,需針對這2種霉菌的生長繁殖特性進一步開發抑制果實霉變的方法。

