分化抑制因子1和3通過Wnt/ β聯蛋白和Shh通路共同調節結直腸癌細胞的干性
黃傳鐘*,孫艷霞*,于 悅,陳 韡,陳淑萍,林萬松,葉韻斌1,,3
(1.福建醫科大學附屬腫瘤醫院,福建省腫瘤醫院,腫瘤免疫學研究室,福建 福州 350014;2.福建醫科大學基礎醫學院,福建 福州 350100;3.福建省腫瘤轉化醫學重點實驗室,福建 福州 350014)
結直腸癌(colorectal cancer,CRC)是世界范 圍內常見的消化系統惡性腫瘤,在我國的發病率和死亡率呈上升趨勢[1]。越來越多的證據表明,CRC干細胞可能在CRC的進展和轉移過程中發揮了至關重要的作用。高度的自我更新能力和上皮-間充質轉化(epithelial-mesenchymal transition,EMT)的腫瘤干細胞可產生化療抵抗和癌癥轉移,從而導致預后不良[2]。從臨床角度講,確定維持細胞干性的分子調控機制從而建立有效的CRC靶向治療策略是非常必要的。分化抑制因子(inhibitors of differ?entiation,Id)屬于螺旋-環-螺旋轉錄因子(helixloop-helix,HLH)家族中的一員,其中 Id1(又名DNA結合抑制因子1)在多種腫瘤組織呈高表達,如前列腺癌[3]、乳腺癌[4]、卵巢癌[5]、胃癌[6]、食管癌[7]和結直腸癌[8]等,并與癌癥的侵襲轉移和不良預后具有相關性[9-13]。而Id1已被證實在胚胎干細胞、內皮細胞以及神經干細胞樣細胞中具有維持其自我更新的功能[14-15],同時Id3和Id1具有高度的序列相似性,故在許多組織中具有廣泛重疊的生物學功能,它們的功能常被認為是相互促進的[16]。我們前期研究發現,Id3在CRC干細胞特性的維持過程中也同樣具有重要作用[17]。最近,O′Brien 等[18]發現,Id1和Id3可通過限制P21驅動的細胞周期來共同調節CRC干細胞的自我更新,但相關信號轉導機制尚未完全闡明。本研究通過單敲減和雙敲減HCT116的Id1和Id3基因的表達,探索Id3是否協同Id1調控CRC干性及其可能的機制。
1 材料與方法
1.1 細胞、主要試劑和儀器
CRC細胞HCT116(上海細胞庫)。RPMI 1640培養基、胎牛血清(FBS)和胰蛋白酶(Gibco公司,美國);d1短發夾RNA質粒(short hairpin RNAId1,shRNA-Id1)、shRNA-Id3和陰性對照質粒慢病毒(上海吉凱基因化學技術有限公司);嘌呤霉素(Merck公司,美國);Trizol裂解液(Invitrogen公司,美國);RNA逆轉錄試劑盒(Promega公司,美國);Id1、Id3和β肌動蛋白引物(北京梓熙生物科技有限公司);熒光定量檢測試劑盒和化學發光試劑盒(Thermo Fisher Scientific公司,美國);AnnexinⅤ/PI檢測試劑盒、BCA法蛋白定量試劑盒、牛血清白蛋白標準品和基質膠(Bio-Rad公司,美國);NC膜(Amersham公司,美國);Wnt通路抑制劑FH535、Sonic Hedgehog(Shh)通路抑制劑HPI-1(Abcam公司,美國);兔抗人β聯蛋白單抗、兔抗人八聚體結合轉錄因子4(octamer-binding transcrip?tion factor 4,Oct4)單抗、兔抗人zeste同源物增強子2(enhancer of zeste homolog 2,EZH2)多抗、兔抗人鈣黏蛋白轉錄抑制因子(snail)多抗、兔抗人Shh單抗、兔抗人融合抑制劑(suppressor of fused,SUFU)多抗、兔抗人周期蛋白D1單抗、兔抗人凋亡抑制因子單抗、兔抗人磷酸甘油醛脫氫酶(glyceraldehyde phosphatedehydrogenase,GAPDH)單抗、兔抗人CD24單抗、兔抗人CD133單抗和兔抗人CD44單抗(均Cell Signaling Technology公司,美國);小鼠抗人Id1多抗和小鼠抗人Id3多抗(Santa Cruz公司,美國);小鼠抗人富含亮氨酸重復序列的G蛋白偶聯受體5(leucine-rich repeat containing G protein-coupled receptor 5,Lgr5)多抗、兔抗人CD166、兔抗人細胞性骨髓細胞瘤病癌基因(cellular-myelocytomatosis viral oncogene,c-myc)多抗、兔抗人膠質瘤相關癌基因同源蛋白2(glioma-associated oncogene homologue 2,GLI2)多抗和兔抗人Hedgehog受體(PTCH2)單抗(Abcam公司,美國);兔抗人CD133單克隆熒光抗體、兔抗人CD24單克隆流式抗體及其同型抗體對照(Miltenyi公司,德國)。生物安全柜(哈爾濱市東聯電子有限公司),純水系統(Millipore公司,美國),二氧化碳培養箱(Heraeus公司,德國),熒光定量PCR儀(Roche公司,美國),活細胞工作站(Leica公司,美國),垂直電泳槽、CLD-RAD550型酶標儀(Bio-RAD公司,美國),普通離心機(白洋離心機廠),流式細胞儀(BD公司,美國),凝膠成像分析儀(Panasonic公司,日本),實時無標記細胞分析儀RTCA(ACEA Biosciences公司,美國)。RTCA是基于電阻抗傳感器原理的細胞檢測,能夠實時檢測細胞的生長、增殖、毒性、粘附及形態變化等動態生物學反應過程;儀器底部整合有微金電子傳感器芯片,當細胞貼壁生長時,可引起電極界面阻抗的改變,該阻抗值的變化直接反映細胞的生物學狀態,因此RTCA可在細胞生理狀態下,實時、連續、定量跟蹤細胞形態和增殖分化的改變。
1.2 細胞培養和敲減細胞株構建
HCT116細胞采用含10% FBS的1640培養液培養,傳代后分別加陰性對照質粒(質粒對照組,簡稱對照組)、Id1敲減質粒(sh-Id1組)、Id3敲減質粒(sh-Id3組)及Id1和Id3雙敲減質粒(sh-Id1Id3組),作用12 h后,更換培養液,繼續培養48 h后更換為含嘌呤霉素1.5 mg·L-1培養液篩選細胞,每3 d更換1次新鮮的嘌呤霉素抗性培養基。篩選3周后,通過熒光顯微鏡下觀察綠熒光強度確定感染效率。
1.3 實時熒光定量PCR檢測腸癌細胞中Id1和Id3 mRNA表達
取1.2構建和分組處理的細胞接種于細胞培養皿,長至融合度約80%時用Trizol液裂解細胞,提取總RNA。用逆轉錄試劑盒HiScript Q-RT Super?Mix,以1 μg RNA為模板合成cDNA。Id1引物:上游為5′-CGTGCTGCTCTACGACATGA-3′,下游為 5′-GCTCCAACTGAAGGTCCCTG-3′;Id3 引物:上游為5′-AGCCAGGTGGAAATCCTAC-3′,下游為5′-AAGCTCCTTTTGTCGTTGG-3′;內參β肌動蛋白引物:上游為5′-TGGCACCA?CACCTTCTACA-3′,下游為5′-AGCACAGCCT?GGATAGCA-3′。設定反應條件進行實時熒光定量PCR反應,按儀器的實驗操作要求設置40個循環,用2-△Ct法計算目標mRNA相對表達水平。
1.4 Western印跡法檢測基因敲減的HCT116細胞中Id1和Id3蛋白表達水平
收集1.2構建和分組處理的細胞,用裂解液裂解,冰上孵育15 min,提取細胞總蛋白。用BCA法進行蛋白定量,每組取25 μg裂解蛋白進行凝膠電泳,電轉至NC膜。用5% FBS封閉液室溫封閉1 h,加Id1和Id3抗體(1∶500),4℃過夜,以GPADH作為內參(1∶2000),用TBST洗3次后加二抗(1∶1000),室溫孵育二抗2 h后加TBST洗3次,使用化學發光試劑盒顯影。以目標蛋白與內參蛋白積分吸光度值比值表示目標蛋白表達水平。
1.5 實時無標記細胞檢測技術檢測細胞生長增殖
取1.2構建和分組的細胞,密度為2×108L-1,加到已檢測過基線的E-Plate 16檢測板中,每孔加100 μL培養液,室溫靜置30 min后將檢測板置培養箱中的RTCA S16儀器上,取0,24,48和72 h共4個時間點,對細胞增殖進行監測并繪制生長曲線圖。
1.6 克隆形成實驗檢測基因敲減的HCT116細胞克隆數
將1.2構建和分組處理的對數生長期細胞,經胰酶消化后,各取800個接種到6孔板中,12~14 d后,吸棄培養液,PBS輕輕洗3次,甲醇固定30 min,每孔加0.1%結晶紫染液600 μL,染色10 min,PBS輕洗3次,計算克隆數和克隆直徑。
1.7 流式細胞術檢測基因敲減的HCT116細胞凋亡
收集1.2構建和分組處理的細胞,按AnnexinⅤ/PI凋亡檢測試劑盒說明書,用100 μL結合液重懸,后加入5 μL FITC Annexin Ⅴ和5 μL PI,輕輕混勻,避光室溫孵育15 min后上流式細胞儀采集細胞凋亡數據。
1.8 無血清懸浮細胞球培養實驗觀察基因敲減的HCT116細胞懸浮球的大小和數量
采用極限稀釋法,將1.2構建和分組處理的細胞接種于96孔板中,每組5復孔,每孔加200 μL無血清DMEM/F12培養液培養7 d后,顯微鏡下觀察懸浮球的直徑和數量。
1.9 流式細胞術檢測基因敲減的HCT116細胞CD24和CD133表達
采用直接免疫熒光標記法分析1.2構建和分組處理的細胞中CD24和CD133(CD133/2亞型)的表達,取1×l06對數生長期細胞,加抗CD24和CD133熒光抗體以及相應同型抗體;室溫避光反應30 min,每管加1 mL洗液,800×g離心5 min,去上清,沉淀加200 μL洗液混勻后上流式細胞儀采集細胞CD24和CD133表達數據。
1.10 Western印跡法檢測基因敲減的HCT116細胞中CD24,CD133,EpCAM,Oct4,EZH2,Lgr5和 β聯蛋白表達水平
參照1.4方法,收集1.2構建和分組處理的細胞,進行Western印跡實驗,CD24,CD133,EpCAM,Oct4,EZH2,Lgr5和β聯蛋白抗體稀釋倍數為1∶500,二抗稀釋倍數為1∶1 000,使用化學發光試劑盒顯影。以目標蛋白與內參蛋白積分吸光度值比值表示目標蛋白表達水平。
1.11 Western印跡法檢測基因敲減的HCT116細胞中c-myc, β聯蛋白,SuFu,PTCH2,Shh和GLI2蛋白表達水平
收集1.2構建和分組處理的細胞,用裂解液裂解,冰上孵育15 min,提取細胞總蛋白。加入500 μL細胞裂解液,用吸頭上下抽吸數次,冰上孵育15 min,振蕩10 s,10 000×g離心5 min,收集上清,此為漿蛋白;再加入500 μL細胞裂解液振蕩5 s,離心5 min,棄除上清,加入50 μL萃取緩沖液抽吸數次;4℃孵育30 min,12 000×g離心10 min,收集上清,此為核蛋白。用BCA法進行蛋白質定量,每組取25 μg裂解蛋白進行凝膠電泳,電轉至NC膜。用5%FBS封閉液室溫封閉1 h,加一抗(1∶500)4℃過夜,用TBST洗3次后加二抗(1∶1000),室溫孵育二抗2 h后加入TBST洗3次,使用化學發光試劑盒顯影。以目標蛋白與內參蛋白積分吸光度值比值表示目標蛋白表達水平。
1.12 Western印跡法檢測基因敲減HCT116細胞過表達c-myc后CD133,Oct4,EZH2,EpCAM和Lgr5蛋白的表達
參照1.2在Id1和Id3敲減的HCT116細胞中構建c-myc過表達細胞株,參照1.4進行Western印跡實驗,抗CD133,Oct4,EZH2,EpCAM和Lgr5抗體稀釋比1∶500,二抗稀釋比1∶1000,使用化學發光試劑盒顯影。以目標蛋白與內參蛋白積分吸光度值比值表示目標蛋白表達水平。
1.13 統計學分析
2 結果
2.1 Id1和Id3基因敲減HCT116細胞的構建
通過構建慢病毒載體系統,獲得敲減Id1/Id3的HCT116細胞株,經嘌呤霉素篩選3周后,熒光顯微鏡下觀察熒光強度。如圖1顯示,HCT116對照組、sh-Id1組、sh-Id3組和sh-Id1Id3組細胞綠熒光率均達>90%,提示慢病毒成功感染細胞。
Fig.1 Construction of HCT116 cells with inhibitor of differentiation 1(Id1)and Id3 gene double-knockdown(×100).Short hairpin RNA plasmid was used to construct Id1 sin?gle gene knockout(sh-Id1),sh-Id3 and double gene knockout(sh-Id1Id3)HCT116 cells by lentiviral transfection system.
2.2 Id1和Id3基因敲減HCT116細胞中Id1和Id3 mRNA水平
如圖2所示,與對照組相比,sh-Id1組Id1mRNA水平顯著降低(P<0.01),sh-Id3組Id3mRNA水平顯著降低(P<0.01),sh-Id1Id3組Id1和Id3mRNA水平均顯著降低(P<0.01)。
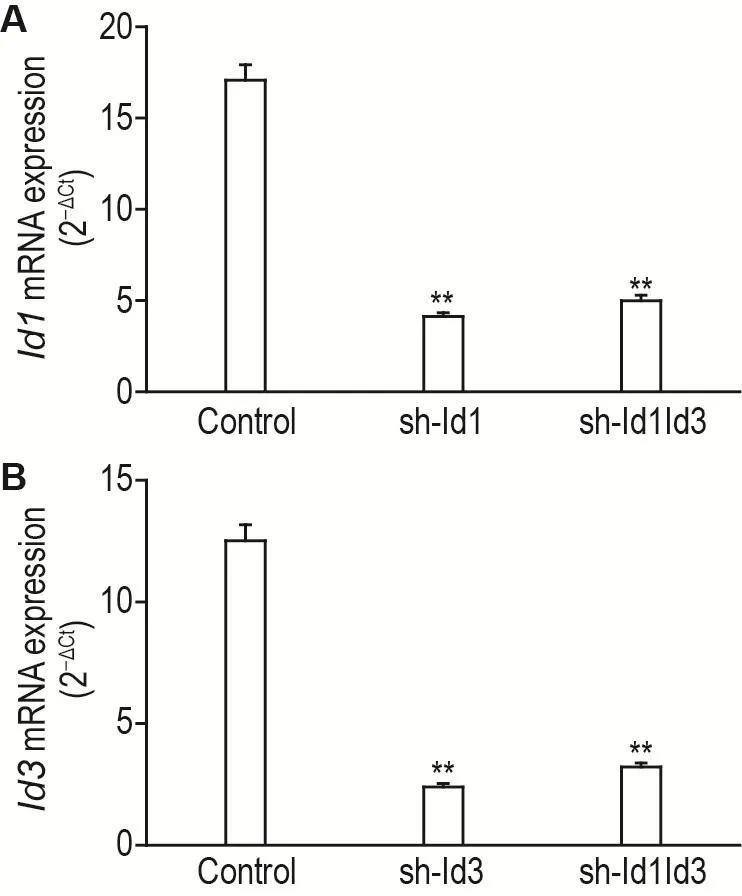
Fig.2 Id1(A)and Id3(B)mRNA expressions in HCT116 cells with Id1 and Id3 gene knockdown by qRT-PCR.See Fig.1 for the cell treatment.±s,n=3.**P<0.01,compared with control group.
2.3 Id1和Id3基因敲減HCT116細胞中Id1和Id3蛋白的表達
如圖3所示,與對照組相比,sh-Id1組Id1蛋白表達降低,sh-Id3組Id3蛋白表達降低,sh-Id1Id3組Id1和Id3蛋白表達均顯著降低(P<0.01)。
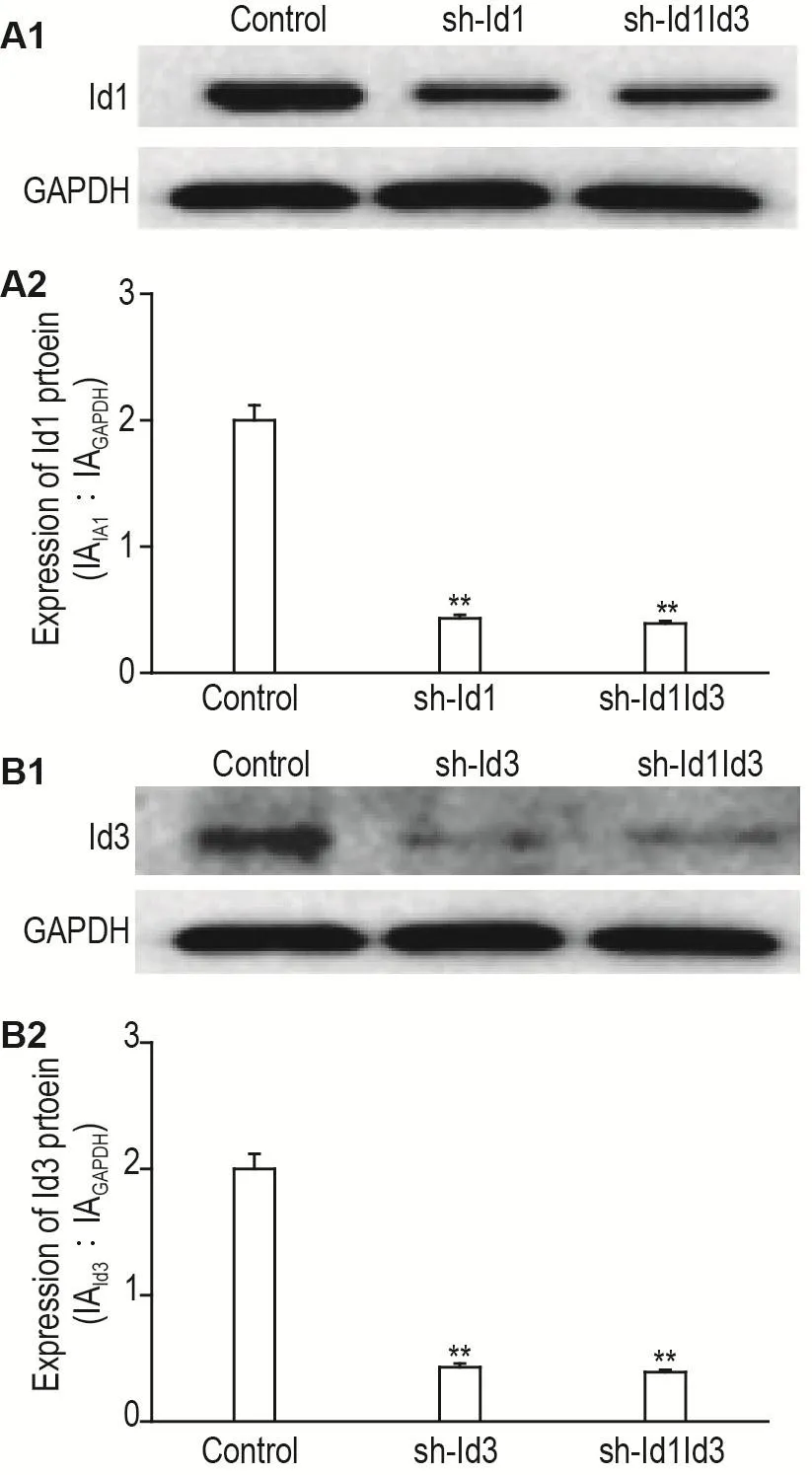
Fig.3 Protein expressions of Id1(A1,A2) and Id3(B1,B2)in HCT116 cells with Id1 and Id3 gene knock?down by Western blotting.IA:intensity analysis.A2 and B2 were the semi-quantitative results of A1 and B1,respectively.See Fig.1 for the cell treatment.±s,n=3.**P<0.01,compared with control group.
2.4 Id1/Id3敲減對HCT116細胞增殖的影響
實時無標記細胞檢測結果(圖4)顯示,48 h后,與對照組相比,sh-Id1,sh-Id3和sh-Id1Id3組細胞的增殖信號顯著減弱(P<0.05);與sh-Id1和sh-Id3相比,sh-Id1Id3組的增殖信號亦顯著減弱(P<0.05)。
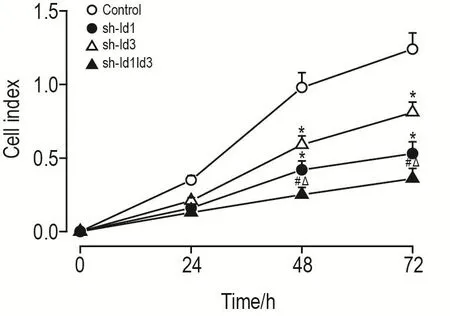
Fig.4 Effect of Id1/Id3 knockdown on proliferation of HCT116 cells by real-time cells analysis.See Fig.1 for the cell treatment.Cell proliferation was detected 48 h post-transfection.±s,n=3.*P<0.05,compared with control group;#P<0.05,com?pared with sh-Id1group;△P<0.05,compared with sh-Id3 group.
2.5 Id1/Id3敲減對HCT116細胞克隆數量和大小的影響
克隆形成實驗結果(圖5)顯示,與對照組細胞克隆數(411±18)(n=3)相比,sh-Id1,sh-Id3和sh-Id1Id3組細胞克隆數分別下降到185±24,201±20和112±21(n=3);細胞克隆的平均直徑分別由對照組(321±48)μm(n=3)下降到144±14,163±13和(87±9)μm(n=3)。sh-Id1,sh-Id3和sh-Id1Id3組與對照組相比顯著降低(P<0.05),且sh-Id1Id3組與sh-Id1、sh-Id3組相比顯著降低(P<0.05)。
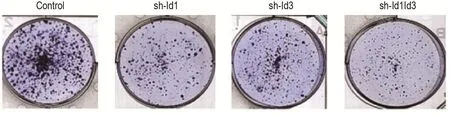
Fig.5 Effect of Id1/Id3 knockdown on colony-formation of HCT116 cells.See Fig.1 for the cell treatment.
2.6 Id1/Id3敲減對HCT116細胞凋亡的影響
圖6結果顯示,與對照組凋亡率為(42±4)%相比,sh-Id1,sh-Id3和sh-Id1Id3組細胞凋亡率顯著升高(P<0.05),分別為(69±6)%,(59±5)%和(80±7)%(n=3);sh-Id1Id3組細胞凋亡率顯著高于sh-Id1和sh-Id3組(P<0.05)。

Fig.6 Effect of Id1/Id3 knockdown on apoptosis of HCT116 cells.See Fig.1 for the cell treatment.
2.7 敲減Id1/Id3對HCT116細胞成球能力的影響
無血清懸浮細胞球培養結果(圖7)顯示,與對照組細胞球性形成率(37±2)%相比,sh-Id1,sh-Id3和sh-Id1Id3組細胞球性形成率分別下降到(15±2)%,(18±3)%和(9±2)%(n=3);干細胞球的平均直徑分別由對照組(103±6)μm下降到49±2,55±3和(43±1)μm(n=3)。sh-Id1,sh-Id3和sh-Id1Id3組與對照組相比均顯著降低(P<0.05),且sh-Id1Id3組與sh-Id1和sh-Id3組相比顯著降低(P<0.05)。

Fig.7 Effect of Id1/Id3 knockdown on sphere-formation of HCT116 cells.See Fig.1 for the cell treatment.
2.8 Id1/Id3敲減對HCT116細胞CD133和CD24表達的影響
如圖8所示,CD133+細胞比例在對照組、sh-Id1、sh-Id3和sh-Id1Id3組分別為(2.80±0.17)%,(0.50±0.12)%,(0.70±0.12)%和(0.27±0.09)%(n=3);CD24+細胞比例在對照組、sh-Id1、sh-Id3和sh-Id1Id3組分別為(24.60±2.25)%,(10.90±3.60)%,(12.70±1.13)%和(0.36±0.06)%(n=3)。sh-Id1,sh-Id3和sh-Id1Id3組中CD133+和CD24+細胞比例與對照組相比均顯著降低(P<0.05),且sh-Id1Id3組與sh-Id1和sh-Id3組相比顯著降低(均P<0.05)。
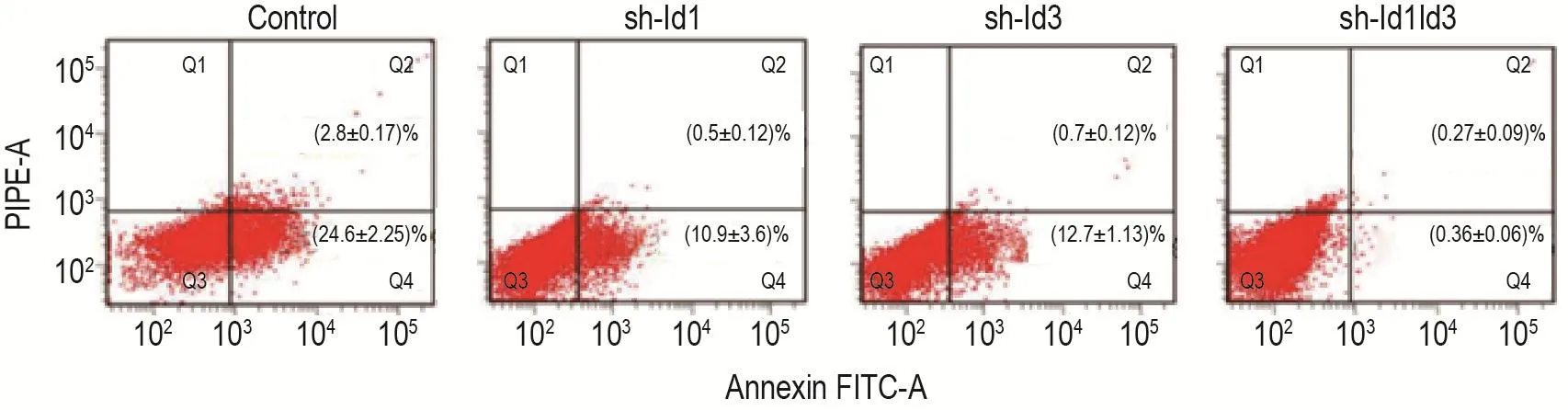
Fig.8 Effect of Id1/Id3 knockdown on stemness of HCT116 cells.See Fig.1 for the cell treatment.
2.9 Id1/Id3敲減對HCT116細胞干性相關蛋白CD24、CD133、EPCAM、Oct4、EZH2、 β 聯蛋白、Lgr5表達的影響
Western 印跡結果顯示(圖9),sh-Id1,sh-Id3和sh-Id1Id3組與對照組相比,CD24、CD133、EPCAM、Oct4、EZH2、β聯蛋白和Lgr5蛋白表達均顯著性下調(P<0.05),但 CD166和 CD44未見明顯變化。
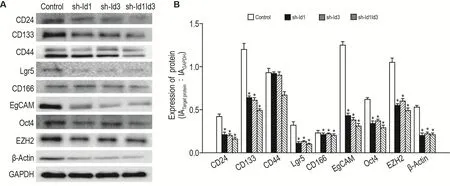
Fig.9 Protein expressions of CD24,CD133,EPCAM,Oct4,EZH2, β-catinin,CD166,CD44 and Lgr5 in HCT116 cells with Id1/Id3 gene knockdown by Western blotting.See Fig.1 for the cell treatment.B was the semi-quantitative result of A.±s,n=3.*P<0.05,compared with control group.
2.10 Id1/Id3敲減對HCT116細胞Wnt/ β聯蛋白和shh通路相關蛋白表達的影響
Western印跡結果顯示,與對照組相比,sh-Id1,sh-Id3和sh-Id1Id3組中Wnt/β聯蛋白通路關鍵分子c-myc、細胞質β聯蛋白、細胞核內β聯蛋白表達水平均顯著下降(P<0.05)(圖10A);sh-Id1,sh-Id3和sh-Id1Id3組與對照組相比,Shh通路的關鍵分子SuFu和PTCH2顯著上升,Shh和GLI2顯著下降(均P<0.05)(圖10B)。
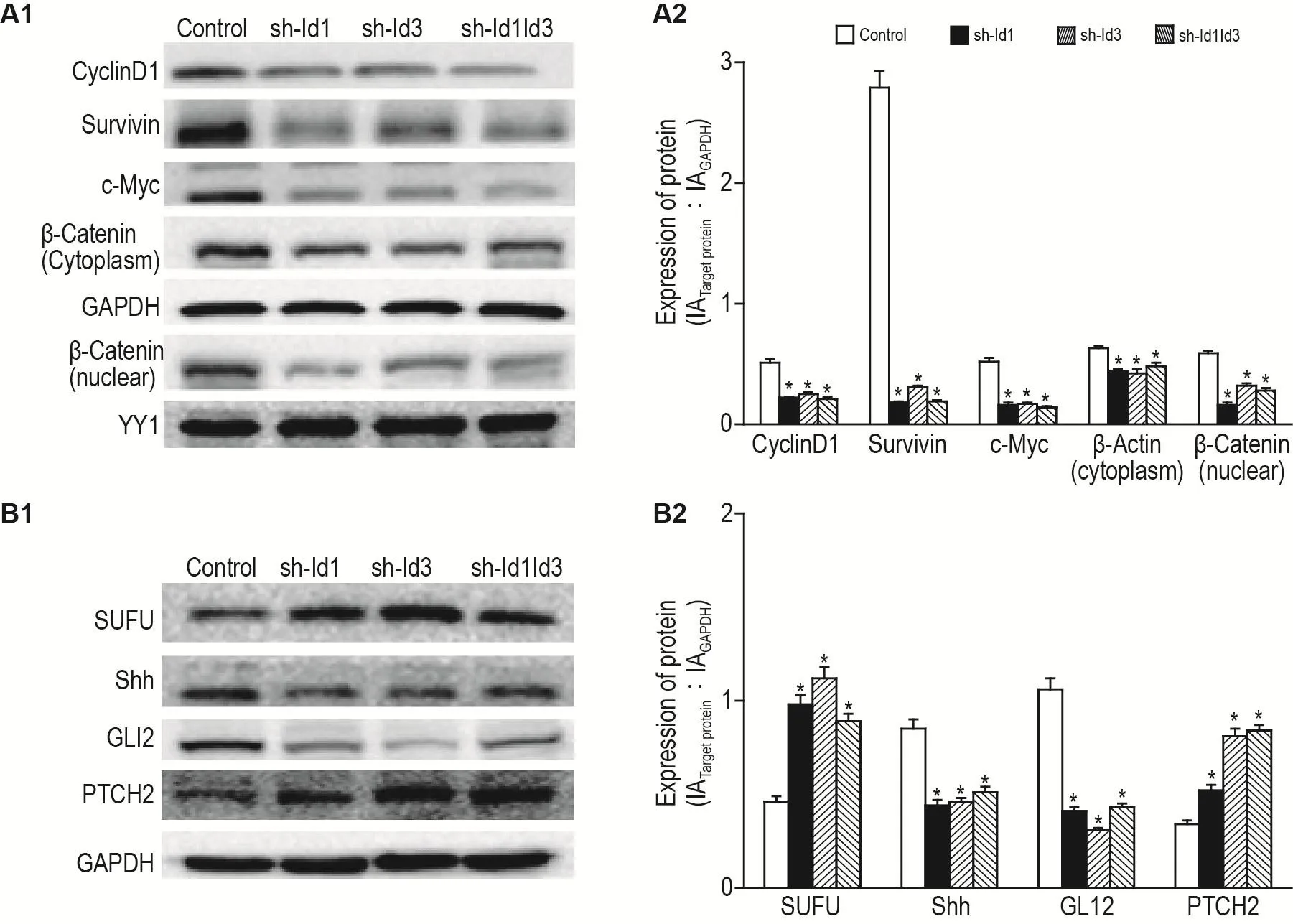
Fig.10 Id3 and Id1 co-regulate stemness characteristics of colon cancer cells through Wnt/ β-catenin and Shh signaling pathways by Western blotting.See Fig.1 for the cell treatment.A2 and B2 were the semi-quantitative results of A1 and B1,respectively.±s,n=3.*P<0.05,compared with control group.
2.11 Id1/Id3基因敲減HCT116細胞過表達c-myc對CD133,Oct4,EZH2,EpCAM和Lgr5蛋白表達的影響
Western印跡結果顯示(圖11),過表達c-myc后,Id1和Id3被敲減后降低的干性標志物CD133,Oct4,EZH2,EpCAM和Lgr5的表達重新上調(均P<0.05),CRC細胞的干性重新增強,進一步明確了Id3和Id1通過Wnt/β聯蛋白、Shh通路共同調控CRC的干性相關蛋白的表達。
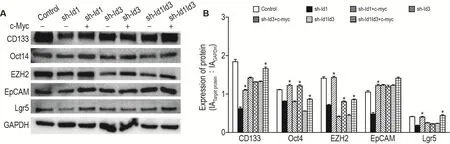
Fig.11 Expressions of CD133,Oct4,EZH2,EpCAM and Lgr5 after c-myc overexpression in HCT116 cells with Id1/Id3 gene knockdown by Western blotting.See Fig.1 for the cell treatment.B was the semi-quantitative result of A.±s,n=3.*P<0.05,compared with control group.
3 討論
本研究發現,在腸癌細胞中敲減Id1和Id3均可通過增加凋亡,從而抑制腸癌細胞的增殖以及克隆形成,且同時敲減Id1與Id3后,腸癌細胞的增殖抑制不僅與對照組相比顯著降低,而且與單獨敲減組比較顯著降低,說明Id1與Id3對HCT116細胞增殖的影響具有疊加作用。
高增殖能力是許多癌癥細胞的重要特征之一,與癌癥的進展密切相關[19-20],同時也是腫瘤干細胞的特征之一。腫瘤干細胞具有自我更新能力及增強侵襲、轉移、腫瘤形成和增殖的能力等特點,同時具有抗常規放療和化療的能力,這些干細胞特性是腫瘤治療失敗的主要原因。本研究采用無血清懸浮培養細胞球的方法,發現HCT116細胞敲減Id1/Id3后細胞成球能力下降,流式細胞術和Western印跡檢測均發現CD133和CD24等干性標志物表達更低,并且同時敲減Id1和Id3能顯著抑制HCT116細胞的干性特征,表明Id3能協同Id1更好地抑制腸癌進展。
此外,干細胞的調控涉及多種信號通路,如Wnt,Sonic,Hedgehog(Shh)和 Notch 等,它們在多種人類惡性腫瘤中失控,直接導致腫瘤的發生發展。有研究表明,Wnt/β聯蛋白信號通路在保持上皮干細胞及CRC干細胞生長和自我更新功能上起至關重要的作用,且Wnt/β聯蛋白信號通路的活化可導致EMT和腫瘤轉移[21]。同樣,Shh在調控胚胎干細胞和成體干細胞中有重要作用[22]。在本研究中敲減Id1/Id3后Wnt/β聯蛋白通路和Shh通路上的關鍵蛋白的表達水平明顯下降,這說明Id1/Id3通過Wnt/β聯蛋白、Shh通路調控CRC細胞干性相關蛋白的表達。c-myc作為Wnt通路和SHH通路共同的靶基因,參與維持胚胎干細胞的自我更新功能,可誘導Bmi1和EZH2的表達。本研究通過在敲減Id1/Id3的HCT116細胞上過表達c-myc增強了CRC細胞的干性,從而進一步明確了Id3和Id1通過Wnt/β聯蛋白、Shh通路共同調控CRC的干性相關蛋白的表達。
腫瘤細胞耐藥性的產生是腫瘤治療的主要障礙之一,而腫瘤干細胞是其耐藥的主要機制。抗腫瘤藥物一般作用于增殖的腫瘤細胞,而腫瘤干細胞多處于靜止期而耐受化療藥物,常常是CRC等惡性腫瘤復發的原因之一。從腫瘤干細胞的角度尋找治療藥物,或降低腫瘤的干性,將腫瘤干細胞標志物作為治療靶點是解決腫瘤細胞耐藥的策略之一[23]。Id1和Id3可以共同調控CRC的干性相關蛋白的表達,可能是CRC耐藥的原因之一,將Id1和Id3作為治療靶點可能是將來腫瘤治療的有效手段之一。

