芍藥苷對血管內皮生長因子誘導的人臍靜脈內皮細胞小管形成的影響
遲驍瑋 陳剛領
1.國家衛生健康委醫藥衛生科技發展研究中心,北京 100044;2.中國藥科大學中藥學院,江蘇南京 211198
血管生成是指從已存在的微血管床上芽生出新的血管系統的過程,主要包括蛋白酶的產生、內皮細胞的遷移和增殖、內皮細胞管道化分支形成血管環和形成新的基底膜等過程[1-2]。血管生成與腫瘤的發展過程關系密切,實體瘤可通過調節腫瘤微環境促使新的毛細血管生成,進而在瘤體內形成微循環網,以實現腫瘤的血液及營養物質供應[3-4]。研究證實,在瘤體內未形成新生血管前,腫瘤細胞通過組織彌散的方式獲得氧和營養物質,如果沒有血管系統,實體瘤的增長不會超過1 cm3[5-7]。因此,通過抑制血管生成的方式阻斷瘤體的給養通道,限制瘤體的氧和營養物質供應,可以有效控制瘤體的增大,是治療腫瘤的有效方式之一。腫瘤血管生成是一個多環節的過程,在促進新生血管形成中,血管內皮生長因子(vascular endothelial growth factor,VEGF)是重要的誘導因子之一,且其在體外有促進內皮細胞小管形成的作用[8-9]。芍藥苷(paeoniflorin,PF)是一種單萜糖苷類化合物,在毛茛科植物芍藥的根中含量較高,具有抑制血小板、抗血栓、減輕腦缺血再灌注損傷及抗腫瘤等藥理活性[10-12]。本研究擬針對PF 抗血管生成作用展開研究,旨在通過相關研究評定PF 抑制血管生成的作用及相關效果并初步探討相關機制。
1 材料與方法
1.1 藥品、試劑與儀器
PF:純度>98%,購自南京替斯艾么中藥研究所。M199 培養液:批號為0225,購自Invitrogen 公司。胰蛋白酶:批號為6C157D25,購自南京生興生物技術有限公司。VEGF:批號為1207CY08-1,購自PeproTech公司。低溫離心機(型號:1-15K,Sigma Corporation);酶標儀(型號:1500,Mullikan Spectrum);超凈臺(型號:SW-CJ-IF,蘇州安泰空氣技術有限公司);細胞培養箱(型號:3111,Thermo Electron Corporation);熒光倒置顯微鏡(型號:IX51,Olympus)。
1.2 實驗樣本
人臍靜脈內皮細胞(HUVECs)細胞株,購自中國科學院細胞庫。
1.3 HUVECs 的分離與培養
將HUVECs 細胞株從液氮中取出后,常規復蘇,使用含20%新生小牛血清的M199 培養液(M199 完全培養液),于37℃、5%CO2的細胞培養箱中培養。24 h后換完全培養液除去未貼壁細胞。待細胞長成單層鋪滿培養瓶后,用0.25%胰蛋白酶消化,傳代,M199 完全培養液培養。倒置顯微鏡下觀察可見培養的HUVECs呈現鋪路石樣單層排列。
1.4 噻唑蘭(MTT)法測定PF 對HUVECs 活力的影響
取對數生長期的HUVECs,接種到包被有1%明膠的96 孔板中,M199 完全培養液、37℃、5%CO2孵育培養12 h。將各實驗孔分為空白組、PF 不同劑量(1、3、10、30、100 μmol/L)組,每組做3 個復孔,72 h 后每孔加入20 μL 濃度為5 mg/mL 的MTT 溶液,繼續培養4 h,每孔加入200 μL 二甲基亞砜,待結晶物充分溶解后,測定λ=570 nm 的吸光度,實驗重復3 次。細胞活力(%)=實驗組吸光度/空白組吸光度×100%。
1.5 MTT 法測定PF 對VEGF 所致HUVECs 細胞活力的影響
取對數生長期的HUVECs,接種到包被有1%明膠的96 孔板中,用M199 完全培養液、37℃、5%CO2、孵育培養12 h,將各實驗孔分為空白組、模型組、PF不同劑量(1、3、10、30、100 μmol/L)組,每組做3 個復孔,除空白組外,其他組均給予10 ng/mL 的VEGF,給藥組同時給予不同劑量的PF(1、3、10、30、100 μmol/L),空白組、模型組給予同體積的藥物溶媒,繼續培養72 h,每孔加入20 μL 濃度為5 mg/mL 的MTT 溶液,繼續培養4 h。每孔加入200 μL 二甲基亞砜,待結晶物充分溶解后,測定λ=570 nm 的吸光度,實驗重復3 次。
1.6 PF 對VEGF 引起的HUVECs 小管形成的影響
在24 孔板中加入200 μL/孔的基質膠,取對數生長期的HUVECs,以1×105個/孔接種到該24 孔培養板中,分為空白組、模型組、PF 不同劑量(1、3、10、30、100 μmol/L)組,每組做3 個復孔,各組均用M199 培養液正常培養,除空白組外,其他組均給予10 ng/mL VEGF,給藥組同時給予不同劑量的PF(1、3、10、30、100 μmol/L),空白組、模型組給予同體積的藥物溶媒,每組做3 個復孔,24 h 后用倒置顯微鏡100 倍率下觀察細胞小管形成情況,隨機選擇每組的5 個區域,成像小管形成情況。實驗重復3 次。
1.7 PF 對VEGF 所致HUVECs 遷移的影響
取對數生長期的HUVECs 接種到24 孔板中,待細胞生長達90%融合后,采用20 μL Tip 頭沿孔的中央在縱軸方向做劃痕,構建單層融合細胞劃痕創傷模型,用磷酸鹽緩沖液沖洗2 遍以去除刮起的漂浮細胞。將各實驗孔分為空白組、模型組、PF 不同劑量(1、3、10、30、100 μmol/L)組,每組做3 個復孔,所有實驗組均用M199 培養液正常培養,除空白組外,其他組均給予10 ng/mL VEGF,給藥組同時給予不同劑量的PF(1、3、10、30、100 μmol/L),空白組、模型組給予同體積的藥物溶媒,37℃、5%CO2培養,在0、24 h用倒置顯微鏡100 倍率拍照記錄,實驗重復3 次。
1.8 統計學方法
采用SPSS 17.0 對所得數據進行統計學分析,計量資料采用均數±標準差()表示,多組間比較采用單因素方差分析,兩兩比較采用LSD-t 檢驗。以P <0.05 為差異有統計學意義。
2 結果
2.1 PF 對HUVECs 細胞活力及對VEGF 所致HUVECs細胞活力的影響
與空白組比較,不同濃度PF(1、3、10、30、100 μmol/L)對HUVECs 的細胞活力影響差異無統計學意義(P >0.05)。見圖1A。VEGF 作用后的模型組的細胞活力顯著高于空白組,差異有高度統計學意義(P <0.01)。與模型組比較,不同濃度PF(1、3、10、30、100 μmol/L)對VEGF所致的HUVECs 細胞活力升高的影響差異無統計學意義(P >0.05)。見圖1B。
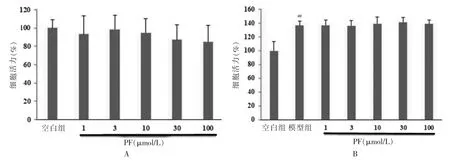
圖1 PF 對HUVECs 細胞活力及對VEGF 所致HUVECs 細胞活力的影響
2.2 PF 對VEGF 引起的HUVECs 小管形成的影響
與空白組比較,模型組的HUVECs 24 h 后在基質膠上形成類似毛細血管管腔的結構。1 μmol/L PF 作用24 h 后,除HUVECs 形成閉合的管腔數量減少外,已形成管腔的寬度和長度減少。3、10 μmol/L PF 作用24 h 后,形成的管腔不完整。30、100 μmol/L PF 作用24 h 后,對HUVECs 形成管腔的能力的抑制更顯著,視野中幾乎沒有完整且閉合的管腔形成。見圖2。

圖2 PF 對VEGF 所致HUVECs 小管形成的影響(100×)
2.3 PF 對VEGF 所致的HUVECs 遷移的影響
與空白組比較,模型組24 h 內向劃痕區域遷移的細胞數量增多,劃痕寬度縮小。與模型組比較,10、30、100 μmol/L PF 劑量組24 h 內向劃痕區遷移入的HUVECs 的數量減少,劃痕寬度縮小。見圖3。模型組24 h 劃痕寬度/0 h 劃痕寬度比值顯著低于空白組,差異有高度統計學意義(P <0.01)。10、30、100 μmol/L PF 劑量組24 h 劃痕/0 h 劃痕寬度均顯著高度模型組,差異均有高度統計學意義(均P <0.01)。見圖4。
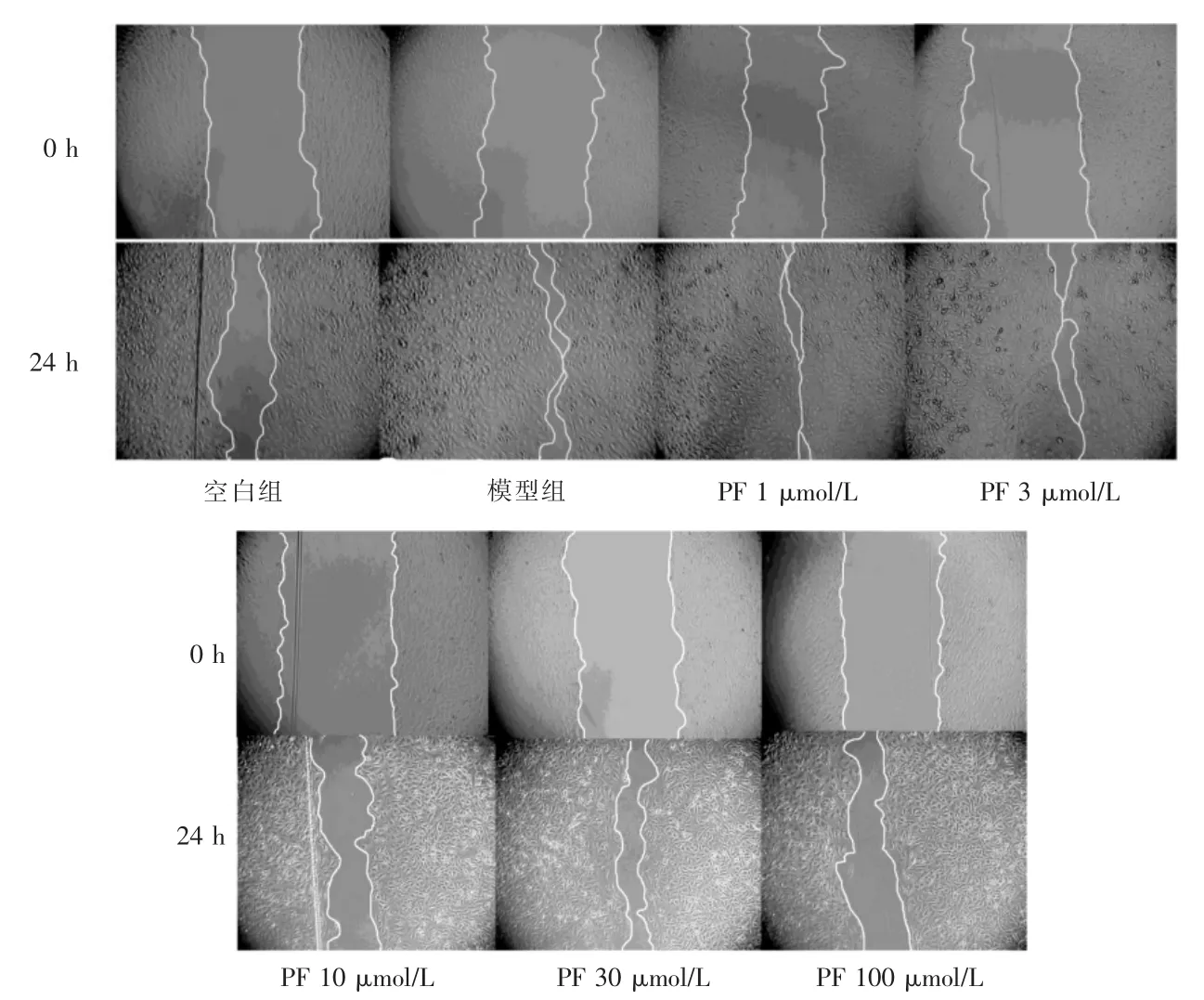
圖3 PF 對VEGF 所致的HUVECs 遷移的影響(100×)

圖4 PF 對VEGF 引起的HUVECs 遷移的影響
3 討論
正常情況下,血管生成是一個受到嚴格調控的過程。在病理狀態下,血管生成主要發生在類風濕性關節炎[13]、固體腫瘤和動脈粥樣硬化[14-15]等疾病的發展過程中。以類風濕性關節炎為例,呈低氧狀態的關節腔內微環境會促進血管新生活性因子(如VEGF)的生成,同時患者的血清中亦有較高濃度的VEGF,且伴隨該病的發生發展[16-17]。新生的血管在類風濕性關節炎患者的關節腔內形成血管翳,后者為增生的滑膜細胞提供營養物質,同時也促進了炎癥細胞對滑膜的浸潤。此外,新生血管形成與腫瘤的發展關系密切,除有助于腫瘤細胞的增殖使瘤體增大外,亦能為后繼的血行轉移提供條件[18]。在此過程中,VEGF、堿性成纖維生長因子(bFGF)、表皮生長因子受體(EGFR)、基質金屬蛋白酶(MMP)、腫瘤壞死因子-α 等表達增高,是誘發新生血管形成,促進瘤體快速增長,以及促進腫瘤血行轉移的重要因素[19-21]。在上述疾病狀態下,有效抑制病灶部位新生血管生成是控制疾病發展的重要治療手段。
VEGF 發揮作用主要依賴于VEGF 受體(VEGFR),后者廣泛分布于血管內皮細胞膜上,主要包括VEGFR-1 和VEGFR-2,其中VEGFR-1 在腫瘤相關血管生成中發揮重要作用[22-23]。體內研究表明,VEGF 可增加血管通透性,使血漿蛋白滲漏和血管外基質發育,為血管內皮細胞生長提供條件[24]。但高濃度的VEGF 誘導生成的新生血管結構與正常血管不同,會有不規則的形狀、擴張和盲端[25],此類異常形成的新生血管加劇了疾病的惡化進程。
本研究使用VEGF 作為刺激因子,考察PF 對HUVECs的增殖、小管形成及遷移的作用。結果顯示,1、3、10、30、100 μmol/L 的PF 對HUVECs 活力及對VEGF引起的細胞活力升高均無顯著影響,但均能抑制由VEGF 引起的小管形成,且10、30、100 μmol/L 的PF 能夠抑制VEGF 誘導的HUVECs 的遷移,提示PF 抑制血管生成的作用主要通過抑制內皮細胞引起的小管重排和遷移實現。進一步的研究將關注PF 對VEGFR相關信號通路的調控作用,以闡釋PF 抑制血管生成的具體機制。

