miR-126、miR-1與心肌缺血再灌注損傷的相關性分析
鄒 青,盧少平, 張明明,程 錦,趙 佩,張玉琨
急性心肌梗死(acute myocardial infarction, AMI)是臨床常見疾病,其病死率達30%[1]。經皮冠狀動脈介入術(PCI)是治療AMI的有效手段,但是PCI術后發生的心肌缺血再灌注損傷(MIRI)可影響患者預后[2]。如何減輕PCI術后的MIRI意義重大,而通過藥物及機械手段減輕MIRI的方式在臨床轉化過程中均失敗。近年來有文獻報道,基因分子方向研究MIRI能為臨床治療提供新的思路[3]。微小核糖核酸(miRNAs)是一類長19~25個核苷酸小分子的非編碼RNA,人類基因約30%受miRNA調控,參與細胞分化、增殖、凋亡,對人體正常功能發揮尤為重要;與冠心病、高血壓病、心肌梗死、心力衰竭等疾病均相關,目前其在AMI的發展中也受到關注[4]。研究表明,miR-126在維持血管完整性方面有著重要做作用,并與MIRI早期心肌表達異常相關;而miR-1能通過線粒體調節心肌細胞凋亡[5]。因此本研究通過比較AMI患者手術前后miR-126、miR-1的表達水平,探究了二者與MIRI的關系,以期為改善AMI預后提供參考。
1 資料與方法
1.1臨床資料 選取2019年1月—2020年7月來我院就診的AMI患者100例為研究對象。①納入標準:均符合AMI診斷標準[6],且經冠狀動脈造影確診;首次發作;成功實施PCI;患者及家屬均知情并同意參與本研究。②排除標準:伴有惡性腫瘤或嚴重心臟、肺、腎疾病者;既往進行過溶栓或PCI治療者;伴有腦梗死、腦出血者;伴有視聽障礙或精神障礙者。根據冠狀動脈造影時心肌梗死溶栓治療試驗血流分為血管自發再通(SR)組42例和非SR組58例。2組性別、年齡、體質量指數等資料比較差異無統計學意義(P>0.05),具有可比性。見表1。本研究經醫學倫理委員會批準同意。

表1 2組AMI患者一般資料比較
1.2方法
1.2.1miR-126、miR-1水平檢測:PCI術前及術后12 h采集2組靜脈血3 ml,離心分離上層血清,轉移至無RNA酶試管中,提取總miRNA,反轉錄成cDNA,反轉錄引物由廣州銳博生物科技有限公司合成,采用美國ABI7500 PCR儀器檢測miR-126、miR-1水平,每個樣本設置3個復孔,反應條件95℃ 5 s,60℃ 30 s,72℃ 10 s,循環40次,相對表達水平通過2-ΔΔCt方法計算。
1.2.2心肌損傷指標檢測:分別于PCI術前及術后12 h采集2組靜脈血3 ml,離心后分離血清,采用酶聯免疫吸附法檢測心肌肌鈣蛋白I(cTnI)、白細胞介素-1(IL-1)水平。采用免疫抑制法檢測肌酸激酶同工酶(CK-MB)水平,儀器為邁瑞全自動生化分析儀BS-200。嚴格按照操作步驟進行。
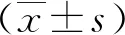
2 結果
2.1miR-126、miR-1水平比較 與術前比較,2組術后miR-126、miR-1水平上升,但SR組低于非SR組,差異有統計學意義(P<0.05,P<0.01)。見表2。
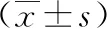
表2 2組AMI患者PCI手術前后miR-126、miR-1水平比較
2.2cTnI、CK-MB、IL-1比較 與術前比較,2組術后cTnI、CK-MB、IL-1水平上升,但SR組低于非SR組,差異有統計學意義(P<0.05,P<0.01)。見表3。
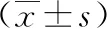
表3 2組AMI患者PCI手術前后cTnI、CK-MB、IL-1水平比較
2.3miR-126、miR-1與術后cTnI、CK-MB、IL-1的相關性 miR-126、miR-1與術后cTnI、CK-MB、IL-1水平均呈正相關(P<0.05)。見表4。

表4 miR-126、miR-1與AMI患者PCI術后cTnI、CK-MB、IL-1的相關性
3 討論
采用PCI能夠有效改善AMI患者的臨床癥狀,但是術后發生的MIRI會加重心肌結構和功能損傷,影響預后,是近年來心血管領域的研究難點[7]。關于MIRI的發生機制存在多種觀點,而miRNAs對MIRI的發生和保護機制的研究也是目前研究的熱點[8]。miRNAs是一類進化上高度保守的內源性單鏈RNA,能夠參與胚胎和組織發育,在生命活動中發揮著重要作用[9]。多種miRNA在心肌梗死、心律失常等疾病中均有廣泛應用,如miR-96在心肌梗死患者中異常表達;miR-499能夠通過抑制心肌細胞凋亡發揮心肌保護功能;miR-21在心肌缺血再灌注處理后上調;miR-133能通過調節Jak2/Stat3/Bcl-2通路來保護心肌組織[10-11]。
miR-126是目前唯一已知在內皮細胞特異表達的miRNA,在細胞生長發育及增殖分化中發揮著重要作用,與心血管疾病關系密切[12]。動物實驗研究表明,miR-126與腦缺血再灌注損傷動物的損傷嚴重程度呈正相關,還有表明研究miR-126能夠通過調控血管生長、脂質代謝等途徑參與AMI的發生[13-14]。大鼠缺血30 min再灌注24 h時miR-126表達上調[14]。本研究結果顯示,與術前相比,2組術后miR-126水平上升,說明miR-126與MIRI的發生有一定相關性,miR-126能夠抑制血管黏附細胞因子1(ICAM-1)的表達,減輕白細胞在血管內皮的黏附,從而減輕血管損傷[15]。
miR-1共有2個轉錄本,即為miR-1-1、miR-1-2,有研究表明,miR-1是正常小鼠心臟中含量最高的miRNA,其心肌特異性較好,與冠狀動脈病變嚴重程度相關[16]。文獻報道,AMI患者miR-1水平高于健康人,在進行2周的治療后miR-1水平恢復至正常水平[17]。本研究中2組術后miR-126水平均較術前上升,提示miR-126水平增加是MIRI的發病機制之一。動物試驗表明miR-1的轉基因小鼠在經過30 min缺血、24 h再灌注后,出現明顯心肌損傷[18]。有學者研究表明,心肌缺血后miR-1過表達,從而抑制Hsp60和Hsp70,可促進心肌細胞凋亡[19]。
氧化應激及炎癥反應一直被認為與MIRI相關,cTnI是反映心肌損傷靈敏度較高的標志物,當心肌受損時,游離型cTnI被釋放入血;CK-MB是CK的同工酶之一,大量存在于心肌組織之中,cTnI及CK-MB是診斷AMI的金標準[20]。炎癥反應是再灌注機制中重要的一環,IL-1是體內炎性級聯反應的始動因子,由活化的單核巨噬細胞分泌,參與機體的感染、缺血缺氧等調控過程。IL-1在MIRI中能夠通過上調E-選擇素、ICAM-1及β2整合素,增加缺血心肌的中性粒細胞,從而釋放氧自由基及細胞毒性產物,而導致心肌細胞損傷;同時能直接與腫瘤壞死因子協同作用產生一氧化氮,抑制心肌功能[21]。本研究結果顯示,與術前比較,2組術后cTnI、CK-MB、IL-1水平均上升,但SR組的cTnI、CK-MB、IL-1水平均低于非SR組,說明非SR組MIRI更重。主要是由于非SR組患者的血管支配區域血供差,心肌缺血時間較長,因而引起炎性水平及氧化應激更強[22]。miR-126及miR-1均與術后cTnI、CK-MB、IL-1水平呈正相關,說明miR-126及miR-1水平越高,MIRI程度越重;這2組指標可作為MIRI的標志物。miR-126具有抑制血管炎癥作用,可通過調控NLRP3/NF-κB信號軸,調節MIRI炎性因子分泌,從而調節組織炎癥微環境[23]。采用遠端缺血預適應能通過抑制右心房心肌miR-1的表達,減少心肌缺血缺氧損傷[24];因此可通過對miR-126及miR-1對AMI進行相關治療。
綜上所述,MIRI會使機體miR-126及miR-1的表達上調,且與心肌損傷程度呈正相關;能夠為AMI的發展、療效判定及預后提供依據;同時也可為開發miRNA作為治療AMI的藥物提供指導。

